猪前胸腺肽α 在大肠杆菌中的表达及其生物学活性鉴定
王錾彧,唐丽杰,乔薪媛,姜艳平,崔 文,李一经
(东北农业大学 动物医学学院,黑龙江 哈尔滨 150030)
前胸腺肽α(Alpha-prothymosin,proTα)是由胸腺上皮细胞和胸腺内分泌细胞产生的一种具有免疫调节活性的生物活性肽,因其N 端前28 个氨基酸与胸腺肽α1(Tα1)完整序列相同而得名,其基因序列在各物种间高度保守,人、牛、羊、猪等的proTα 均由109 个氨基酸构成[1-2]。自胸腺肽类激素发现以来,一些胸腺激素或胸腺肽制剂已作为一种免疫调节剂类药物逐渐应用于临床,其中Tα1 已在人类多种疾病的临床治疗中取得较好的疗效[3],但在兽医领域中研究较少。近些年来有学者提出proTα 的作用机理和功效与Tα1 不完全相同,而且具有比Tα1 更高的免疫调节活性[4-5]。体外试验表明proTα 能够增强脾细胞分泌IFN-γ、IFN-α 和TNF-γ[6-7],还可以增强淋巴细胞对PHA 刺激的反应活性,进而提高细胞的增殖能力,具有广泛的免疫调节活性和抗癌活性。此外,proTα 作为DNA 疫苗的免疫佐剂,可以提高免疫保护效果[8-9]。而且近年来人们对proTα 不同氨基酸区域与免疫细胞相互作用的研究表明,其蛋白无规则卷曲的空间结构特征使之免疫原性极低[8],更适合作为疫苗佐剂的开发。
本研究利用大肠杆菌表达猪proTα 基因,制备了具有生物活性的可溶性proTα,为重组proTα 作为疫苗佐剂开发和应用奠定了基础。
1 材料和方法
1.1 病毒株、菌株及实验动物 猪轮状病毒(PRV)JL94 株,大肠埃希菌Rosetta 菌株及质粒pET32a 由本实验室保存;原核表达的重组PRV VP6 蛋白由本实验室制备;6 周龄~8 周龄BALB/c 小鼠购自中国农业科学院哈尔滨兽医研究所实验动物中心。
1.2 主要试剂 T4 DNA 连接酶、限制性内切酶均购自TaKaRa 公司;辣根过氧化物酶(HRP)标记羊抗鼠IgG(IgG-HRP)购自北京中杉金桥生物技术有限公司;小量DNA 胶回收试剂盒、质粒抽提试剂盒购自上海华舜生物工程有限公司;BCA 蛋白浓度检测试剂盒购自北京索莱宝技术有限公司。
1.3 proTα 基因合成根据猪proTα 基因序列(NM_001160086.1),上下游分别添加Bam H Ⅰ和XhoⅠ位点,由金斯瑞生物技术有限公司以重组质粒(pUC57-proTα)形式合成。
1.4 表达重组质粒的构建 利用Bam HⅠ和XhoⅠ酶切pUC57-proTα 获得目的基因,亚克隆至pET32a载体中构建重组表达质粒pET-proTα,并将其转化于E.coli Rosetta 株感受态细胞中。同时将pET32a转化于Rosetta 株中作为对照。
1.5 目的蛋白的诱导表达及纯化 将过夜培养的pET-proTα/Rosetta 和pET32a/Rosetta 按1∶20 接种至LB 培养基,IPTG(终浓度为0.5 mmol/L)诱导4 h。菌体经超声波裂解,上清液采用镍离子亲和层析柱纯化proTα 蛋白和pET32a/Rosetta 表达的硫氧还蛋白(Trx)标签蛋白。收集洗脱液并用PBS 平衡,进行SDS-PAGE 检测,并利用BCA 蛋白浓度检测试剂盒测定纯化的蛋白浓度。
1.6 proTα 促小鼠脾和胸腺细胞增殖活性的检测制备分离未经免疫的健康BALB/c 小鼠脾淋巴细胞,每孔5×106个细胞铺板,分别加入50 μg/mL、10 μg/mL、5 μg/mL 和0.5 μg/mL 的纯化重组蛋白proTα,同时将用相同方法纯化和相同浓度的Trx 作为对照组,ConA(终浓度为5 μg/mL)作为阳性对照,RPMI1640 培养液组为阴性对照,每组每个浓度设3 个复孔。常规细胞培养后采用MTT 染色法,用酶标仪测定OD492nm值[10]。同时取抗原刺激的每个孔的上清150 μL,用于检测INF-γ。测定胸腺淋巴细胞增殖活性方法步骤同上。
1.7 proTα 对小鼠抗体水平影响 30 只BALB/c 小鼠随机分为3 组,肌肉注射200 μL PRV(107TCID50/mL),同时连续5 d 腿部肌肉注射以下物质:PBS 组肌注PBS 100 μL/只,Trx 组肌注纯化的Trx 200 μg/只,proTα 组肌注纯化目的蛋白200 μg/只。免疫结束后第0 d、5 d、9 d、14 d、21 d 和28 d,每组各取尾静脉血分离血清。全部血清采用间接ELISA 方法检测抗体:以纯化的PRV VP6 蛋白[11]包被ELISA板,血清1∶10 稀释作为一抗,羊抗鼠IgG-HRP(1∶5 000)作为二抗,OPD 显色后测定OD490nm值。
1.8 proTα 对小鼠脾细胞分泌IFN-γ 的影响 取Trx 组和proTα 组小鼠脾脏按1.6 方法制备脾细胞,用无菌的VP6 蛋白分以25 μg/mL、5 μg/mL 和0.5 μg/mL 3 种浓度抗原为刺激组,RPMI1640 培养液组为阴性对照,设复孔。37 ℃、5%CO2培养72 h后吸取上清液150 μL,离心后采用Biosource 细胞因子检测试剂盒测定上清液中INF-γ,方法参照试剂盒说明书。
1.9 统计学分析 实验数据利用SPSS 统计软件处理,实验组与对照组之间的比较采用t 检验的方法。
2 结果
2.1 重组表达质粒pET-proTα 的构建和鉴定 提取重组质粒pET-proTα进行酶切鉴定,Bam HⅠ/XhoⅠ双酶切获得约330 bp DNA 片段,鉴定结果与预期相符。
2.2 重组蛋白的表达和纯化 重组质粒pET-proTα和空载体质粒pET32a 同步转化Rosetta,培养、诱导、收获和裂解后,经12 % SDS-PAGE 电泳检测显示,空载体菌pET32a/Rosetta 在20 ku 处出现Trx 表达带,而pET-proTα/Rosetta 出现一条约30 ku 的目的条带,与预期的大小相符(图1)。菌体超声波裂解后,分别收集上清液和沉淀进行SDS-PAGE 检测,结果显示,重组蛋白以可溶性蛋白形式存在。pETproTα/Rosetta 和pET32a/Rosetta 表达产物经纯化得到单一纯化的目的蛋白,测定其浓度为1.5 mg/mL(图1),同样方法纯化空载体菌表达蛋白Trx 并稀释至相同浓度。
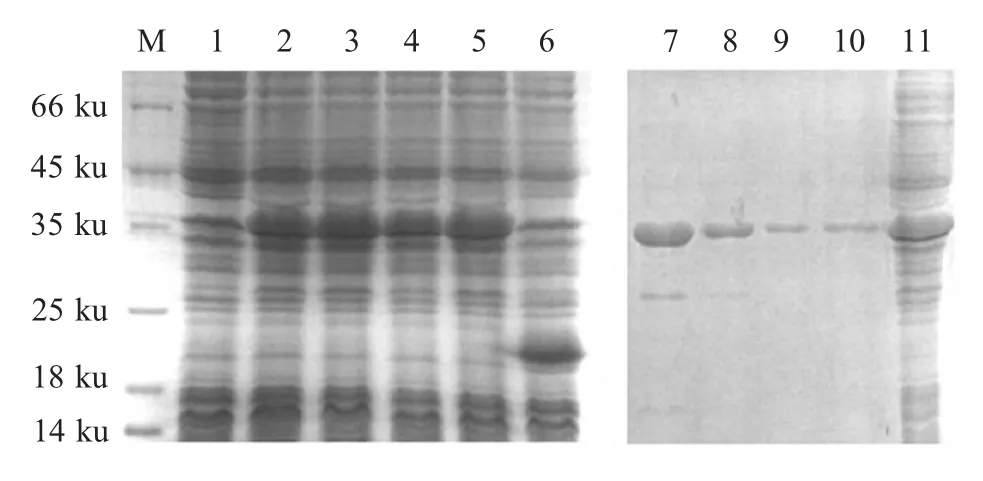
图1 proTα 蛋白表达和纯化SDS-PAGE 鉴定结果Fig.1 The identification of proTα protein expression and purification by SDS-PAGE
2.3 重组proTα 对淋巴细胞增殖影响 用MTT 方法测定重组proTα 对小鼠脾细胞和胸腺细胞增殖的影响,结果显示高剂量的proTα 与Trx 组相比较差异极显著(p<0.01),蛋白浓度降至0.5 μg/mL 对两种细胞均无促进增殖作用,表明proTα 具有促进小鼠脾和胸腺淋巴细胞(图2 和图3)增殖的作用,并具有浓度依赖性。
2.4 proTα 蛋白对小鼠抗体水平的影响 将重组蛋白与PRV 共同免疫小鼠,ELISA 方法检测PRV VP6特异性抗体,自免疫后第9 d 开始proTα 组抗体水平显著高于Trx 组(p<0.01),而Trx 组和PBS 组抗体水平差异不显著,表明proTα 能够增强小鼠特异性体液免疫应答(图4)。
2.5 proTα 对脾细胞分泌IFN-γ 的影响 小鼠脾细胞在VP6 抗原作用下培养72 h 后,吸取培养上清液IFN-γ 检测结果显示:与Trx 组相比较,proTα 组脾细胞上清液中IFN-γ 含量均有所提高,但只有最高抗原刺激剂量时,proTα 组与对照组Trx 比较差异显著(p<0.05),这可能由于VP6 蛋白纯化的质量不高,因此低剂量时未达到有效刺激水平(表1)。
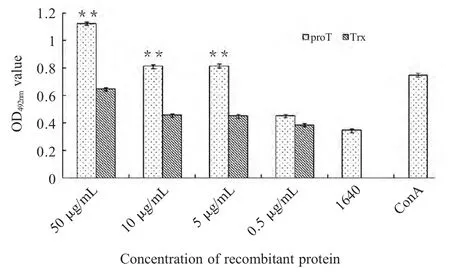
图2 蛋白proTα 对小鼠脾淋巴细胞增殖的影响Fig.2 The effect of recombinant proTα on the proliferation of spleen lymphocytes
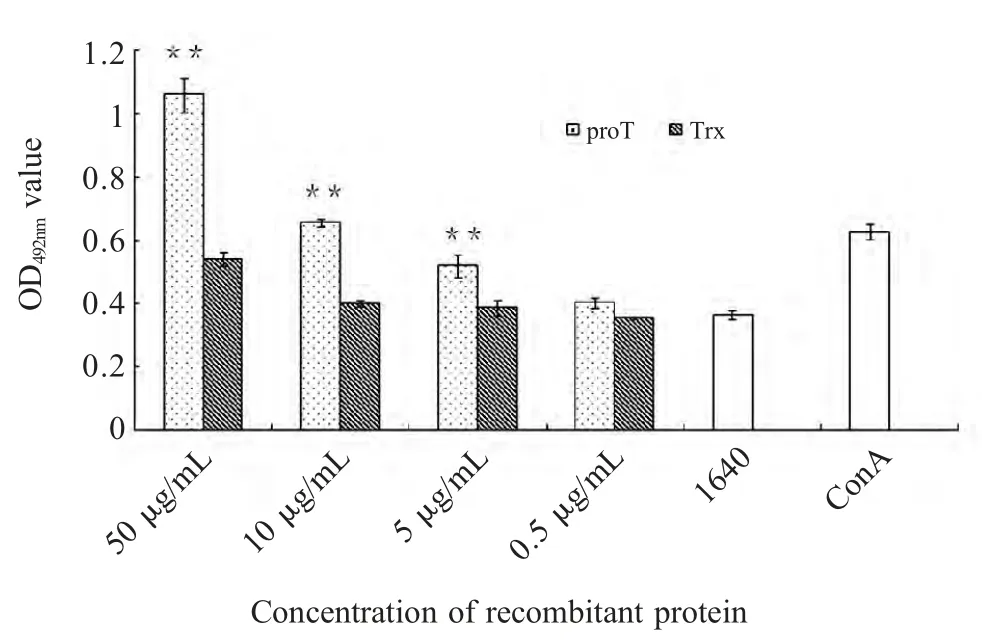
图3 蛋白proTα 对小鼠胸腺细胞增殖的影响Fig.3 The effect of recombinant proTα on the proliferation of thymus lymphocytes
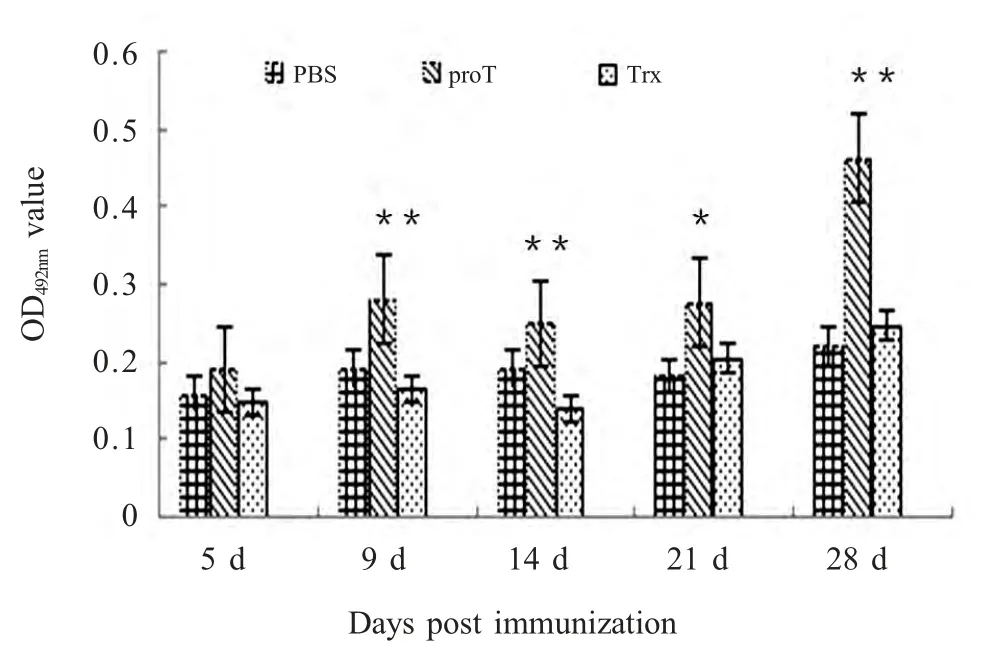
图4 ELISA 检测proTα 对小鼠特异性抗体水平影响Fig.4 The effect of proTα on the level of mouse antibody by ELISA
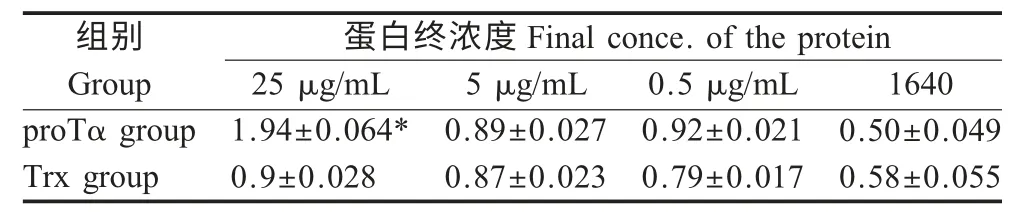
表1 脾细胞分泌IFN-γ 含量(pg/mL)Table 1 Production of IFN-γ in splenocy culture supematant(pg/mL)
3 讨论
本研究建立了能够大量、可溶表达具有生物活性的proTα 大肠杆菌表达系统,以GenBank(NM_001160086.1)氨基酸序列为模板,在合成pro-Tα 基因序列时替换了其中的E.coli 稀有密码子;同时,使用pET32a 表达载体构建重组菌,因其具有提高表达量和蛋白可溶性的Trx 标签,为蛋白的进一步纯化和应用提供基础。经过镍柱亲和层析纯化,获得纯度较好的proTα 蛋白和标签蛋白Trx,在检测其生物活性时排除标签蛋白的影响。
本实验利用PRV 作为免疫原与proTα 共同免疫小鼠,模拟疫苗与佐剂共同注射的形式,研究pro-Tα 的体内免疫增强作用。结果显示proTα 能够明显提高PRV VP6 特异性抗体水平;并且检测免疫后小鼠脾细胞分泌INF-γ 水平,当抗原VP6 刺激剂量为25 μg/mL 时,proTα 组INF-γ 水平高于Trx 对照组。INF-γ 在机体主要起到免疫调节的作用,可以促进Th1 型细胞分化和NK 细胞毒作用,因此推测proTα与抗原共同免疫也增强了抗原特异性的细胞免疫应答水平。首次证明了proTα 不仅能够以分子佐剂的形式增强核酸疫苗的免疫效果[12],以蛋白形式与抗原共同注射也可发挥佐剂作用。
本研究建立了能够可溶性表达proTα 的原核表达体系,证明了proTα 在体内和体外、细胞和体液水平的免疫调节功能,为其生物学活性和功能的研究提供了理论与物质基础,对新型疫苗免疫佐剂的研究具有重要意义。
[1]Tao Lian,Wang Rui-hong,Enkemann S A,et al.Metabolic regulation of protein-bound glutamyl phosphates:Insight into the function of prothymosin alpha[J].J cell Physiol,1999,178(2):154-163.
[2]Pan L X,Haritos A A,Widernann J.Human prothymosin alpha:amino acid sequence and immunoloeic nronerties[J].Arch Biochem Bionhvs,1986,250:197-205.
[3]史秀山.胸腺肽增强狂犬病疫苗免疫效果的研究[J].中国热带医学,2004,10(4):703-704.
[4]Goldstein A L,Low L K,McClure J,et al.Thymosinα1:Isolation and sequence analysis of an immunologically a active thymic peptide[J].PNAS USA,1977,74:725-731.
[5]Goya R G,Bolognani F.Homestasis,thymic Hormone sand aging[J].Gerontology,1999,45(2):174-178.
[6]邱磊,郭葆玉,苗红,等.重组前胸腺肽α 对IFN-α 体外分泌的影响[J].药学学报,2002,37(5):326-328.
[7]陈慰峰,张惠华.胸腺肽对小鼠胸腺细胞亚群增殖能力的作用[J].实验生物学,1985,3.
[8]王斌,周霞秋,减国庆,等.乙型肝炎DNA 疫苗诱导小鼠免疫反应的实验研究[J].中华肝脏病杂志,2001,9:108-111.
[9]Shian A L,Chub C Y,Liao Chen-yu,et al.Prothymosin alpha enhances protective immune response induced by oral DNA vaccination against Pseudorabies delivered by Salmonella choleroesuis[J].Vaccine,200l,19:3277-3282.
[10]魏艳丽,李红梅,任艳,等.犊牛前胸腺素α 基因在大肠埃希菌中的表达及活性分析[J].微生物学杂志,2008,9(28):56-60.
[11]陈淑红,王新生,师东方.猪轮状病毒的分离鉴定及部分特性研究[J].中国预防兽医学报,2004,26(1):42-44.
[12]Jin Yan-wen,Cao Cheng,Li Ping.Boosting immune response to hepatitis B DNA vaccine by coadministration of prothymosin α-expressing plasmid[J].Clin Diagn Lab Immunol,2005,12:1364-1369.

