京海黄鸡杂交配套系亲本两种球虫疫苗免疫效果的比较
林雨鑫,孙明明,戴国俊*,张菁菁,张跟喜,谢恺舟,王金玉,宋 野,王永娟
(1.扬州大学 动物科学与技术学院,江苏 扬州 225009;2.江苏省动物遗传繁育与分子设计重点实验室,江苏 扬州 225009;3.江苏京海禽业集团有限公司,江苏 海门 226103)
鸡球虫病是由艾美耳球虫(Eimeria)所引起的,以雏鸡高死亡率和出血性肠炎为主要特征。特别是鸡柔嫩艾美耳球虫(Eimeria tenella)在雏禽3 周龄至2月龄时最易感染,发病率高达50 %~70 %,对我国养禽业造成了严重的危害。目前球虫疫苗为防治球虫病的主要手段之一。华绍桂等以成活率、料重比、均重等为指标,研究了不同剂量正典“球苗”的免疫效果[1]。闫鸿斌等通过测定增重率、每克粪便卵囊数(OPG)、抗球虫指数(ACI)等指标,研究了鸡球虫四价苗(LCV)和球虫疫苗(LCV-2)的安全性和免疫保护性[2-3]。另外,研究表明血浆中一氧化氮(NO)、γ 干扰素(IFN-γ)、β-C(β 胡萝卜素)的含量可以作为鸡球虫疫苗的免疫效果和鸡球虫抗性的评价指标[4]。
良凤鸡(BB 鸡)和岭南黄鸡(FF 鸡)作为京海黄鸡杂交配套系的亲本,具有生长速度快,饲养周期短,肉质优,适应性强等特点。本实验综合采用存活率、体增重、OPG、盲肠记分、ACI、NO、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)等免疫效果和球虫抗性评价指标,比较BB 鸡和FF 鸡经两种疫苗免疫后的免疫效果和鸡球虫抗性差异,为京海黄鸡杂交配套系培育及球虫疫苗免疫效果的评价提供一定依据。
1 材料和方法
1.1 虫株和虫苗 E.tenella 由扬州大学兽医学院寄生虫教研室提供;正典鸡球虫病四价活疫苗(E.tenella PTMZ 株+毒害艾美耳球虫PNHZ 株+巨型艾美耳球虫PMHY 株+堆型艾美耳球虫PAHY 株)购自佛山市正典生物技术有限公司。
1.2 实验动物的分组与处理 BB、FF 1 日龄肉鸡购自江苏省海门京海黄鸡资源场。试验挑选发育均匀、健康无球虫的90 只7 日龄公鸡(45 只BB,45只FF)。每个群体分为3 组:500 个活卵囊免疫组(V1 组),正典球虫苗免疫组(V2 组),非攻虫空白对照组,每组15 只。9 日龄时V1 组每只鸡经口灌喂500 个E.tenella 孢子化活卵囊,V2 组每只鸡饮水接种1 100 个孢子化卵囊。饲养至34 日龄时免疫组鸡经口注射2.5 万个E.tenella 孢子化卵囊,单笼饲养于汽油喷灯火焰消毒的无球虫鸡笼中,并在攻虫后第8 d 解剖所有鸡只。
1.3 检测指标和方法 详细记录鸡只临床表现、攻虫前和屠宰前体重、攻虫后5 d~7 d 血便记分[5],屠宰时盲肠解剖特征和病变记分[6],并计算存活率、相对增重率、病变值[7];收集攻虫后5 d~7 d 的粪便和屠宰时取盲肠内容物,计算OPG、卵囊值[7]和ACI 值[7];采用生物素双抗体夹心ELISA 法测定屠宰前血浆NO、CAT、SOD、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、IFN-γ、β-C 含量。
2 结果
2.1 经E.tenella孢子化卵囊攻虫后各组临床症状和解剖特征比较 试验过程中,对照组鸡只均表现为无下痢,无血便,精神、食欲良好。9 日龄免疫后,免疫鸡只精神、食欲、排粪均正常。攻虫后5 d,V1 组出现少量血便,精神状态良好;V2 组出现少量血便,精神沉郁,食欲稍下降。攻虫后6 d,V1组食欲开始下降,精神稍沉郁。V2 组出现少量血便的鸡只数增加。攻虫后7 d,鸡只食欲基本恢复正常,精神状态良好。解剖后采集鸡只盲肠,其中对照组鸡只肠道中无眼观异常;V1 组盲肠壁轻度增厚,有少量点状出血斑内容物较稀,个别鸡只有偏血色肠芯,V2 组盲肠病变程度略高于V1 组,盲肠壁高度肿大,有弥漫性出血,有较多鸡只肠内容物为血色肠芯;BB 鸡群体盲肠壁增厚程度、肠壁出血程度、血色肠芯鸡只数均低于FF 群体。
2.2 敏感性试验结果 攻虫后0~8 d 实验鸡均未发生死亡,各组存活率均为100 %,而相对增重率,BB 鸡V1 组最高(84.6%),FF 鸡V2 组最低(79.2%);在病变值方面,FF 鸡V2 组最高(25),BB 鸡V1 组最低(15);在ACI 值方面,BB 鸡V1 组ACI 在160~180,为抗球虫中效,其余3 组均在120~160,为抗球虫低效(表1)。
2.3 同一鸡群体各免疫组血浆指标比较结果 攻虫后第8 d 测定各组血浆指标。BB 鸡群体CAT、SOD、IFN-γ 含量,V1 组显著高于V2 组;FF 鸡群体CAT、SOD、β-C 含量,V1 组显著高于V2 组。同一鸡群体其余各免疫指标含量在V1 组、V2 组、对照组之间差异均不显著(表2)。
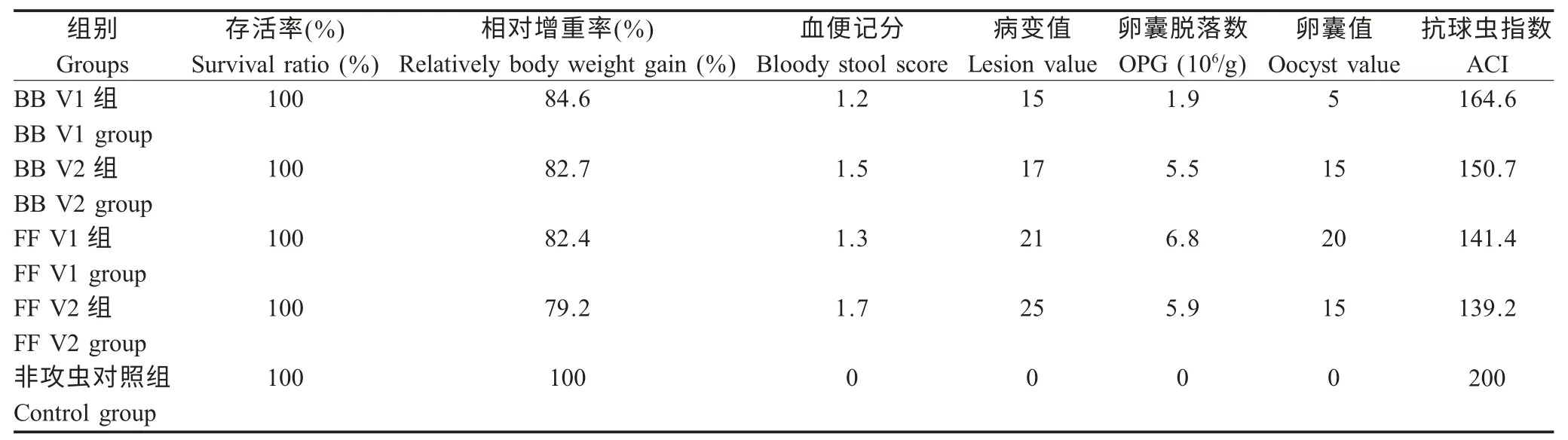
表1 各免疫组鸡柔嫩艾美耳球虫敏感性试验结果Table 1 E.tenella sensitivity test among different vaccine groups

表2 同一鸡群体各免疫组之间血浆指标的比较Table 2 Comparison of parameter indicator among vaccine groups in the same chicken population
2.4 同一免疫组BB鸡与FF鸡各指标的比较结果攻虫后8 d 测定各组血浆指标,比较同一鸡群各血浆指标。所测各血浆指标在BB 和FF 两个鸡群体间差异均不显著(p>0.05)(表3)。
3 讨论
本研究显示,BB 鸡免疫组相对增重率略高于FF 鸡免疫组,而ACI 值明显高于FF 鸡免疫组,表明BB 鸡在生长速度及对鸡球虫病的抗性方面优于FF 鸡,这与本实验室之前做的一些试验结果相一致[8];研究表明两鸡群体V1 组在相对增重率、ACI 上均优于V2 组,表明500 个孢子化活卵囊免疫方法优于正典球虫苗免疫方法。这可能是由于500 个孢子化活卵囊本身就是E.tenella,所以免疫效果较好,而正典球虫苗在抵抗一种球虫时,可能由于疫苗球虫株与攻毒虫株的抗原差异而导致免疫效果不佳[9]。
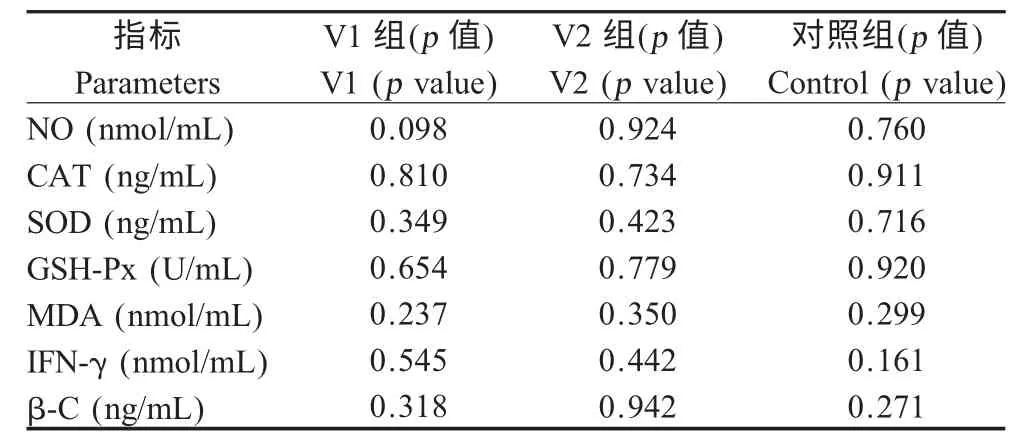
表3 BB 鸡与FF 鸡相同免疫组各指标比较的显著性概率值Table 3 Significance of parameters between the same treatment in BB and FF chicken
鸡感染E.tenella 后机体抗氧化防御系统平衡会发生改变,CAT、SOD 均属于机体抗氧化防御系统中的重要酶,其含量会发生变化来维持机体抗氧化系统的平衡[10]。窦新红等研究表明鸡感染E.tenella后,组织中CAT 的活性变化与鸡对E.tenella 的敏感性有关[7]。鸡感染球虫后,CAT、SOD 等酶活性的降低能引起剧烈的脂质过氧化作用,产生过量的脂质过氧化物(LPO),导致生物膜PU-FA/蛋白质比例的改变,引起膜的液态性与流动性改变,使膜受体与离子通道的脂质微环境遭到破坏,导致细胞肿胀,甚至细胞凋亡,致使机体出现病理损伤[11]。本实验中不管是BB 鸡还是FF 鸡,V1 组鸡血浆CAT、SOD 含量均显著高于V2 组鸡,表明V1 组鸡能够在感染球虫后产生更多的CAT、SOD 来减轻鸡感染球虫后剧烈的脂质过氧化作用,以维持机体的抗氧化系统平衡,从而使鸡只自身机体受到更小的损伤。
IFN-γ 是一种重要的细胞因子,存在于被刺激淋巴细胞上清液中,具有广泛的抗病毒和调节免疫活性的作用,能显著提高鸡抗球虫细胞免疫水平[12]。Hong 等研究表明IFN-γ 对E.tenella 在体内的发育有抑制作用,它可以降低球虫卵囊的生殖能力并提高鸡体重[13]。本实验中BB 鸡V1 组IFN-γ 含量显著高于V2 组鸡,表明BB 鸡V1 组免疫效果优于V2 组。Steenkbock 等研究表明β-C 可能具有维生素A 活性[14]。而维生素A 是机体必需的微量营养成分,具有免疫和抗氧化剂的功能,能够淬灭单线态氧和清除体内自由基的不良影响,促进细胞缝隙间联接交流[15]。本实验中,FF 鸡V1 组,β-C 含量显著高于V2 组,该组能产生更多的β-C,建立更强的免疫力以保护自身机体免受球虫对机体的损伤。
不同免疫组各血浆指标BB 和FF 两鸡群体间差异均不显著,就所测血浆指标而言,同一种疫苗对BB 和FF 的效果基本一致。
本研究通过对攻虫后两鸡群体的临床表现、第8 d 解剖时盲肠病变、相对增重率、ACI 值、血浆指标等方面的分析表明,BB 鸡群体E.tenella 抗性优于FF 鸡群体,500 个E.tenella 活卵囊免疫效果优于正典球虫疫苗。
[1]华绍桂,赖开喜,谢德华,等.鸡球虫疫苗不同剂量免疫效果的临床比较[J].畜牧与兽医,2010,42(9):88-89.
[2]闫鸿斌,田广孚,贾万忠,等.鸡球虫苗(LCV-2 号)安全性和免疫效果研究[J].中国预防兽医学报,2007,29(5):368-371.
[3]闫鸿斌,贾万忠,田广孚,等.四价鸡球虫苗的免疫效果研究[J].中国预防兽医学报,2009,31(3):236-240.
[4]尉浩华,林雨鑫,王成丽,等.京海黄鸡柔嫩艾美尔球虫抗性和易感鸡抗性指标的比较研究[J].中国兽医学报,2014,34(5):740-743.
[5]Morehouse N F,Baron R R.Coccidiosis:Evaluation of coccidiostats by mortality,weight gains,and fecal scores[J].Exp Parasitol,1970,28(1):25-29.
[6]Johnson J,Reid W M.Anticoccidial drugs:Lesion scoring techniques in battery and floor-pen experiments with chickens[J].Exp Parasitol,1970,28(1):30-36.
[7]窦新红,童海兵,许明,等.不同品种地方鸡对柔嫩艾美球虫的易感性分析[J].畜牧与兽医,2009,41(12):7-9.
[8]顾玉萍,顾云飞,俞亚波,等.京海黄鸡与快大型品系的配合力测定试验[J].扬州大学学报,2011,32(3):30-33.
[9]孙文瑶,许金俊,陶建平,等.巨型艾美球虫株间差异表达基因消减文库的构建和分析[J].扬州大学学报,2009,30(1):13-17.
[10]金光明,张岱芊.柔嫩艾美耳球虫感染后组织抗氧化功能的动态变化[J].中国兽医学报,2002,22(3):233-235.
[11]杨保收,陈越,龚伟,等.氧自由基致损伤的分子生物学机制[J].中国兽医杂志,1999,25(1):41-45.
[12]叶秀华,蔡建平,吴志光,等.重组ChIFN-γ 增强鸡球虫细胞免疫作用的研究[J].中国预防兽医学报,2005,27(5):397-401.
[13]Hong Yeong Ho,Lillehoj H S,Lee S H,et al.Analysis of chicken cytokine and chemokine gene expression following Eimeria acervulina and Eimeria tenella infections[J].Vet Immunol Immunopathol,2006,114(3-4):209-223.
[14]Steenbock H.White corn vs.yellow corn and a probable relation between the fat-soluble vitamine and yellow plant pigments[J].Science,1919,50:352-353.
[15]韩雅珊.类胡萝卜素的功能研究进展[J].中国农业大学学报,1999,4(1):5-9.

