α7nAChR在氯化甲基汞神经毒性中的作用
崔静, 杨生森, 鲁植艳, 杨维财, 田建英,*
1. 宁夏医科大学基础医学院,银川 750004 2. 宁夏医科大学总医院骨科,银川 750004 3. 武汉大学中南医院放射科,武汉 430072
α7nAChR在氯化甲基汞神经毒性中的作用
崔静1, 杨生森2, 鲁植艳3, 杨维财1, 田建英1,*
1. 宁夏医科大学基础医学院,银川 750004 2. 宁夏医科大学总医院骨科,银川 750004 3. 武汉大学中南医院放射科,武汉 430072
为探讨环境染污染物氯化甲基汞(methylmercury chloride,MeHgCl)的神经毒性作用机制,采用MTT、免疫细胞荧光、dot Blot、qRT-PCR等实验技术检测MeHgCl对PC12细胞活性及其α7亚型烟碱型胆碱能受体(α7 nicotinic acetylcholine receptor, α7nAChR)蛋白和mRNA表达水平的影响。结果显示MeHgCl抑制PC12细胞活性,显著降低α7nAChR的蛋白和mRNA的表达水平,呈浓度依赖性。上述结果表明,MeHgCl对神经细胞毒性作用可能与抑制α7nAChR表达有关。
氯化甲基汞;α7nAChR;记忆;神经毒性
汞是继砷和铅之后排名第三的环境毒物。一般人群汞暴露主要源于淡水鱼和深海鱼、牙科用汞合金材料和含硫柳汞的疫苗等。甲基汞是汞的毒性最强的形式,吸收后分布于人体所有器官和组织,包括脑和胎盘。体内外研究表明,汞具有显著的神经毒性,可以引起神经元丢失,破坏神经系统结构和功能完整性,造成记忆和认知功能障碍[1],但其神经细胞毒性机制尚不清楚。
烟碱型胆碱能受体(nicotinic acetylcholine receptor, nAChR) 广泛分布于中枢神经系统,α7 nAChR是其中较为特殊的亚型,能激活神经元上的α7nAChR可以调节神经元兴奋性和神经递质释放[2]、改变突触可塑性[3]、帮助神经元抵御内外因素的损伤,维持正常的生理功能状态,对维持记忆和认知功能的十分重要。研究表明,α7 nAChR对改善阿尔茨海默症(Alzheimer's disease,AD)和精神分裂症患者的认知障碍有显著作用[4]。本研究拟探讨α7nAChR在汞的神经毒性作用机制。
1 材料与方法(Materials and methods)
1.1 实验材料
嗜铬细胞瘤细胞株PC12细胞(上海神经科学研究所), 噻唑蓝 (MTT)、二甲基亚砜 (DMSO) (Sigma公司),MeHgCl (Dr. Ehrenstorfer公司,纯度97%)α7nAchR兔多克隆抗体 (Santa Cruz公司),胰蛋白酶、PBS、DMEM/F12、青霉素/链霉素(Hyclone公司),新生牛血清(四季青公司),TRITC(中杉金桥),Hoechst 33342(碧云天公司)。全蛋白提取试剂盒和BSA蛋白定量试剂盒(南京凯基公司),总RNA提取试剂盒(Omega公司),反转录试剂盒(Thermo Fisher公司),荧光定量试剂盒(Takara公司)。
iMark酶标仪(BIO-RAD,美国)、NanoDrop 2000c 分光光度计(Thermo Fisher,美国)、CFX96实时定量PCR仪(BIO-RAD,美国),BX51荧光显微镜(OLYMPUS,日本)。
1.2 实验方法
1.2.1 实验分组
观察MeHgCl对PC12细胞活性的影响,随机分为对照组(0 μmol·L-1)MeHgCl组,1~4 μmol·L-1MeHgCl组,并观察MeHgCl处理后对PC12细胞分子水平改变。
1.2.2 细胞培养
PC12细胞于含15%新生牛血清、1%青霉素/链霉素的 DMEM/F12 1:1中培养,于37℃、5%CO2培养箱进行孵育。取对数生长期细胞分别接种于 96 孔板和24孔板中,于37 ℃、5%CO2培养箱中孵育24 h。
1.2.3 MTT法检测PC12细胞活性
上述各组细胞在96孔板培养24 h后,移除培养基,每孔加入90 mL DMEM/F12培养基和10 μL MTT (5 mg·mL-1),继续孵育4 h, 加入 150 μL的DMSO,振摇10 min,于酶标仪读取OD值,检测波长490 nm, 分析。
1.2.4 免疫细胞荧光法检测α7nAchR亚单位蛋白水平
取各组细胞以 4%的多聚甲醛固定, PBS振洗, 10%山羊血清室温封闭1 h, 加一抗 (1∶100稀释),4 ℃孵育48 h; 移除一抗,加TRITC二抗, 37 ℃、1 h, 加Hoechst 33342,37 ℃、10 min。PBS洗3次,每次5 min,抗淬灭封片剂封片。
1.2.5 BCA蛋白检测法进行蛋白定量
全蛋白提取试剂盒制备蛋白样品,取不同浓度BSA蛋白标准品及待测样品分别加入96孔板,37 ℃温箱孵育30 min,于酶标仪570 nm检测波长下测量OD值。根据标准品OD值绘制标准曲线,计算蛋白样品含量。
1.2.6 Dot-Blot检测α7nAChR蛋白水平
取定量后的等量蛋白样品点膜。TBST洗膜,脱脂奶粉封闭,将膜浸入一抗(1:200), 4 ℃孵育48 h,洗膜3次,加入HRP标记的二抗,DAB显色10 min,自然晾干,扫描后进行灰度分析。
1.2.7 qRT-PCR检测α7nAChR mRNA水平
总RNA提取试剂盒提取总mRNA,测A值计算RNA纯度。逆转录后,取cDNA做qPCR,qPCR所用引物(见表1),由上海生工生物技术有限公司设计并合成。反应条件为:qPCR反应条件为预变性95 ℃ 30 sec,95 ℃ 5 sec, 60 ℃ 30 sec,39个循环。每组设3个复孔,以GAPDH基因为内参,结果以2-ΔΔCt的形式表达,Ct为循环阈值。

表1 基因引物设计
1.2.8 统计学方法
2 结果(Results)
2.1 MTT法检测MeHgCl对PC12细胞活性的影响
MTT分析结果表明,与对照组比较,MeHgCl处理组PC12细胞活性随浓度递增而降低,在MeHgCl 1 μmol·L-1组(0.4927±0.0204) PC12细胞活性与对照组相比变化不明显94.33%(P>0.05),在2~4 μmol·L-1组细胞活性明显降低,细胞活性分别为对照组的87.57% (P<0.01) 和66.72% 、25.71% (P<0.001)(见图1)。
2.2 免疫荧光细胞化学法测定MeHgCl对PC12细胞α7 nAchR蛋白表达的影响
对照组细胞细胞轮廓清楚,胞体呈梭形,突起细长;MeHgCl处理组随MeHgCl浓度增高,α7 nAchR的阳性细胞数目逐渐减少,细胞突起缩短,高浓度组甚至断裂或消失,胞体变圆,细胞轮廓不清。MeHgCl组α7 nAchR阳性细胞荧光强度明显减弱,平均光密度(average optical density, AOD)减小(P<0.05)(见表2,图2)。
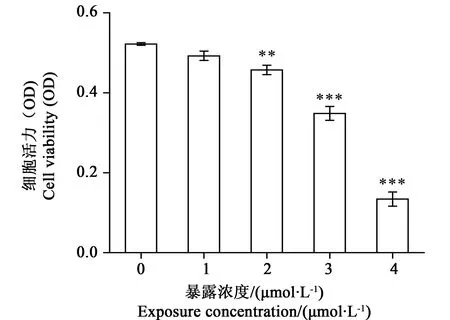
图1 不同浓度MeHgCl对PC12细胞活性的影响Fig. 1 Effect of MeHgCl on cell viability(n=5,**P<0.01,***P<0.001vs control group)
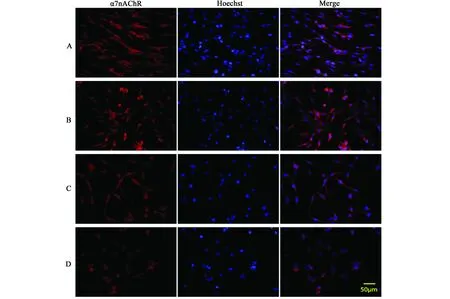
图2 不同浓度MeHgCl对PC12细胞α7nAChR 阳性表达的影响注:A. 对照组(0 μmol·L-1)、B. MeHgCl 1 μmol·L-1组、C. MeHgCl 2 μmol·L-1、D. MeHgCl3μmol·L-1组,标尺:50 μmFig. 2 Effect of MeHgCl on positive expression of α7nAChR in PC12 cellsNote: A. control group (0 μmol·L-1), B. MeHgCl 1 μmol·L-1, C. MeHgCl 2 μmol·L-1, D. MeHgCl3μmol·L-1, bar: 50 μm
表2 不同浓度MeHgCl对PC12细胞α7nAChR 阳性表达的影响
Table 2 Effect of MeHgCl on positive expression of α7nAChR(n=4,x±s)
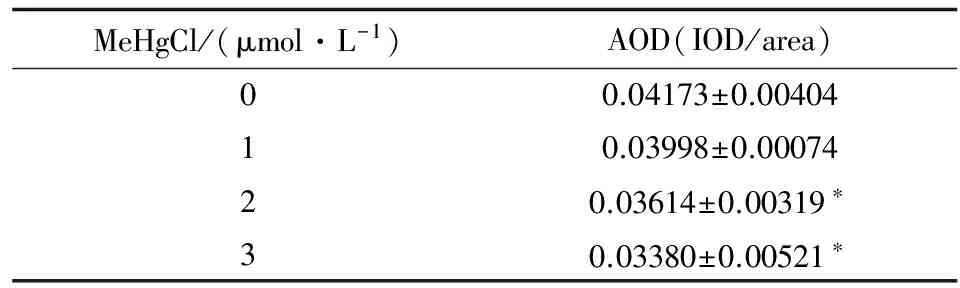
表2 不同浓度MeHgCl对PC12细胞α7nAChR 阳性表达的影响
MeHgCl/(μmol·L-1)AOD(IOD/area)00.04173±0.0040410.03998±0.0007420.03614±0.00319∗30.03380±0.00521∗
注:*P<0.05与对照组(0 μmol·L-1)比较,IOD是积分光密度。
Note:*P<0.05vscontrol group (0 μmol·L-1), IOD is integration of optical density.
2.3 Dot-Blot测定MeHgCl对PC12细胞α7 nAchR蛋白水平的影响
Dot-Blot斑点试验观察各组PC12细胞α7 nAchR蛋白的变化。结果表明,与对照组比较, MeHgCl不同浓度组PC12细胞α7 nAchR蛋白水平均有明显下降,并呈浓度依赖性递减(见表3,图3)。
表3 不同浓度MeHgCl对PC12细胞α7nAChR蛋白水平的影响

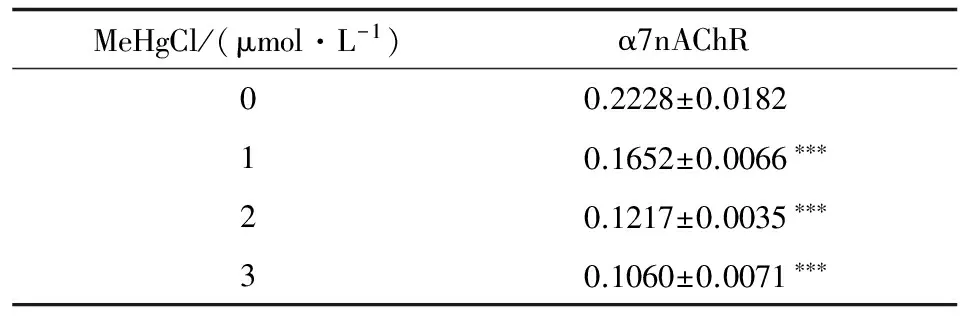
MeHgCl/(μmol·L-1) α7nAChR00.2228±0.018210.1652±0.0066∗∗∗20.1217±0.0035∗∗∗30.1060±0.0071∗∗∗
注:***P <0.001与对照组(0 μmol·L-1)比较
Note:***P <0.001vscontrol group (0 μmol·L-1)

图3 不同浓度MeHgCl对PC12细胞α7nAChR蛋白表达的影响(μmol·L-1)Fig. 3 Effect of MeHgCl on protein level of α7nAChR(n=3,***P <0.001vs control group)
2.4 qRT-PCR测定MeHgCl对PC12细胞α7 nAchR mRNA水平的影响(2-ΔΔCt)
qRT-PCR方法,观察α7 nAchR mRNA水平的变化。结果显示,与正常对照组比较,MeHgCl (1~3 μmol·L-1)对PC12细胞α7 nAchR mRNA水平均有显著抑制作用 (P <0.001) (见图4)。
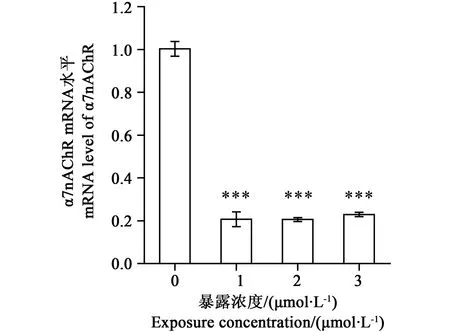
图4 不同浓度MeHgCl对PC12细胞α7nAChR mRNA水平的影响Fig. 4 Effect of MeHgCl on mRNA level of α7nAChR(n=3,***P<0.001vs control group)
3 讨论(Discussion)
有机汞在环境中具有分布广、生物蓄积性高和神经毒性强等特征。
不论是动物,还是人体,中枢神经系统是有机汞毒性最敏感的部位。甲基汞容易跨过血脑屏障,诱导氧化应激和细胞毒性[5],靶向杀死神经系统中视觉皮层、小脑、背根神经节内的神经元。环境污染水平的甲基汞暴露诱发海马区神经干细胞凋亡,造成不可修复的细胞缺陷,导致青春期海马依赖性功能障碍[1]。定量蛋白质组学分析表明汞通过诱导氧化应激,细胞骨架组装功能障碍和代谢障碍引起神经毒性[6]。我们前期的研究也发现,pmol·L-1浓度的MeHgCl可致海马干细胞活性降低,且抑制其向神经元分化[7]。本研究MTT的实验结果显示,随MeHgCl浓度增高,PC12细胞线粒体还原酶活性逐渐下降,细胞存活率降低,存在浓度依赖性,表明甲基汞通过诱导自由基产生、氧化应激,导致神经细胞线粒体活性的下降,细胞死亡。神经细胞结构和功能的破坏,是有机汞引起神经功能障碍的重要原因。
α7nAChR在海马和皮层神经元中高表达[8],是胆碱能神经元表达nAChR的主要亚型之一。配体门控型离子通道α7nAChR对Ca2+通透性极强,维持细胞内钙稳态,调节神经元兴奋性[2],改变突触信号传递效率[9-10]。α7nAChR的缺损是胆碱能神经元退化的关键因素。海马是人和啮齿类动物学习和记忆功能形成的基础。α7nAChR胆碱能神经元丢失是AD等神经退行性疾病认知功能障碍的重要病理基础[11]。AD患者皮质和海马α7nAChR表达水平显著低于一般人群,激活α7nAChR可以保护胆碱能神经元,改善记忆和认知[4]。另外,激活α7nAChR抑制神经母细胞瘤细胞和小鼠原代皮层神经元的自噬活动,降低Aβ的神经毒性[12]。我们前期实验结果显示当归芍药散脑脊液通过α7nAChR降低PC12细胞氧化应激损伤和细胞凋亡[13-14]。本实验结果表明,低浓度1 μmol·L-1MeHgCl处理24 h无明显细胞活性变化,但α7nAChR mRNA和蛋白水平已显著低于正常对照组,显示α7nAChR在基因和蛋白水平对MeHgCl的毒性均十分敏感,表明α7nAChR生物合成降低先于细胞凋亡。
国际上研究表明α7nAChR亚型在认知功能缺失以及AD的病理过程中有举足轻重的作用。本研究证实α7nAChR亚型介导MeHgCl诱发的神经细胞毒性作用。鉴于α7nAChR在认知功能、感觉处理、情绪调节和神经保护作用中起关键作用。MeHgCl抑制中枢神经元α7nAChR的表达可能是其导致记忆和认知功能障碍的病理机制之一。
[1] Sokolowski K, Obiorah M, Robinson K, et al. Neural stem cell apoptosis after low-methylmercury exposures in postnatal hippocampus produce persistent cell loss and adolescent memory deficits [J]. Developmental Neurobiology, 2013, 73(12): 936-949
[2] Komal P, Gudavicius G, Nelson C J, et al. T-cell receptor activation decreases excitability of cortical interneurons by inhibiting α7 nicotinic receptors [J]. The Journal of Neuroscience, 2014, 34(1): 22-35
[3] Nordman J C, Philips W S, Kodama N, et al. Axon targeting of the alpha 7 nicotinic receptor in developing hippocampal neurons by Gprin1 regulates growth [J]. Journal of Neurochemistry, 2014, 129(4): 649-662
[4] Russo P, Del Bufalo A, Frustaci A, et al. Beyond acetylcholinesterase inhibitors for treating Alzheimer's disease: α7-nAChR agonists in human clinical trials [J]. Current Pharmaceutical Design, 2014, 20(38): 6014-6021.
[5] Olivieri G, Brack C, Müller-Spahn F, et al. Mercury induces cell cytotoxicity and oxidative stress and increases beta-amyloid secretion and tau phosphorylation in SHSY5Y neuroblastoma cells [J]. Journal of Neurochemistry, 2000, 74(1): 231-236
[6] Wang Y, Wang D, Lin L, et al. Quantitative proteomic analysis reveals proteins involved in the neurotoxicity of marine medaka Oryzias melastigma chronically exposed to inorganic mercury [J]. Chemosphere, 2015, 119: 1126-1133
[7] 陈维维, 金国华, 张新华, 等. 枸杞多糖对氯化甲基汞诱导海马神经干细胞损伤的保护作用[J]. 解剖学报, 2012, 43(4): 445-450
[8] Conejero-Goldberg C, Davies P, Ulloa L. Alpha7 nicotinic acetylcholine receptor: A link between inflammation and neurodegeneration [J]. Neuroscience and Biobehavioral Reviews, 2008, 32(4): 693-706
[9] Cheng Q, Yakel J L. Presynaptic α7 nicotinic acetylcholine receptors enhance hippocampal mossy fiber glutamatergic transmission via PKA activation [J]. The Journal of Neuroscience, 2014, 34(1): 124-133
[10] Zhong C, Talmage D A, Role L W. Nicotine elicits prolonged calcium signaling along ventral hippocampal axons [J]. Public Library of Science one, 2013, 8(12): e82719
[11] Tong L M, Fong H, Huang Y. Stem cell therapy for Alzheimer's disease and related disorders: Current status and future perspectives [J]. Experimental and Molecular Medicine, 2015, doi:10.1038
[12] Hung S Y, Huang W P, Liou H C, et al. LC3 overexpression reduces Aβ neurotoxicity through increasing α7nAchR expression and autophagic activity in neurons and mice [J]. Neuropharmacology, 2015, 93C: 243-251
[13] 马丽君, 马科, 李霞, 等. 含当归芍药散简方脑脊液对神经细胞的保护作用[J]. 中国实验方剂学杂志, 2012, 18(9): 165-168
[14] 田建英, 马锋, 马伟, 等. 当归芍药散神经保护作用的实验研究[J]. 山东医药, 2008, 48(23): 1-3
◆
The Effects of α7nAChR on the Neurotoxicity of Methylmercury Chloride
Cui Jing1, Yang Shengsen2, Lu Zhiyan3, Yang Weicai1and Tian Jianying1,*
1. Ningxia Medical University School of Basic Medical Sciences, Yinchuan 750004, China 2. Department of Orthopedics, General Hospital of Ningxia Medical University, Yinchuan 750004, China 3. Department of Radiology, Zhongnan Hospital of Wuhan University, Wuhan 430072, China
Received 12 January 2015 accepted 29 March 2015
To investigate the neurotoxicity of environmental pollutant, methylmercury chloride (MeHgCl) on the nervous system, the PC 12 cell viability was detected by MTT assay. The gene expression level of α7 nicotinic acetylcholine receptor, α7nAChR, was evaluated by immunofluorescence, Dot-Blot and qRT-PCR both at protein and mRNA levels when PC12 cells were treated with MeHgCl. The results demonstrated that MeHgCl impaired the cell viability and inhibited α7nAChR gene expression both in transcriptional and translational levels in a dose-dependent manner. These results illustrated that the neurotoxicity of MeHgCl might be associated with the inhibition of α7nAChR gene expression.
MeHgCl; α7nAChR; memory; neurotoxicity
国家自然科学基金 (No.81060231,81160338);宁夏高校重点项目(NGY2011039) ;湖北省自然科学基金(No. 2013CFB277)
崔静(1987-),女,硕士研究生,研究方向为环境因素与老年性痴呆的发病机制及防治,E-mail: 15109685679@163.com
*通讯作者(Corresponding author), E-mail: jianyingt@hotmail.com
10.7524/AJE.1673-5897-20150112001
2015-01-12 录用日期:2015-03-29
1673-5897(2015)3-276-05
X171.5
A
田建英,女,教授,硕士研究生导师,主要研究方向环境因素与老年性痴呆的发病机制及防治。
崔静,杨生森,鲁植艳, 等. α7nAChR在氯化甲基汞神经毒性中的作用[J]. 生态毒理学报,2015, 10(3): 276-280
Cui J, Yang S S, Lu Z Y, et al. The effects of α7nAChR on the neurotoxicity of methylmercury chloride [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 276-280 (in Chinese)

