双酚A对青岛大扁藻的干扰效应
向昆仑, 王晶晶, 唐思, 段舜山,*
1. 暨南大学水生生物研究中心, 水体富营养化与赤潮防治广东普通高校重点实验室, 广州 510632 2. 广东省海洋与渔业环境监测中心, 广州 510000
双酚A对青岛大扁藻的干扰效应
向昆仑1, 王晶晶2, 唐思1, 段舜山1,*
1. 暨南大学水生生物研究中心, 水体富营养化与赤潮防治广东普通高校重点实验室, 广州 510632 2. 广东省海洋与渔业环境监测中心, 广州 510000
为了探讨双酚A(bisphenol A, BPA)对海洋微藻的生态毒性效应,实验选择了以青岛大扁藻(Platymonas helgolanidica)作为受试物种,设置6个实验浓度(即0、2、4、6、8、10 mg·L-1)对微藻进行了96 h暴露处理,测定了不同浓度暴露下对青岛大扁藻的生长以及抗氧化系统酶活性等指标。研究结果表明,BPA对青岛大扁藻的96h-EC50为9.32 mg·L-1,属高毒类污染物。青岛大扁藻经过BPA暴露处理后,细胞密度下降,细胞色素含量降低,并且呈现明显的剂量-效应关系;细胞抗氧化系统中超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)、谷胱甘肽还原酶(GR)活性均受到干扰。
双酚A; 青岛大扁藻;干扰效应
双酚A(bisphenol A, BPA)属于苯酚和丙酮的衍生物,是重要的有机化工原料[1],年产量超过60亿磅[2]。它广泛应用于物品包装稳定化和抗氧化处理过程,与人类生活关系密切。与大多数污染物一样,BPA在生产和应用过程中绝大部分会经过各种途径进入水体,BPA本身亲脂性强,易在生物体中富集并能随着食物链发生传递[3]。研究表明,BPA对人类和动物个体的生理、生殖以及子代发育产生负面影响[4-7]。在水体介质中(地表水)的BPA的含量范围为0.002~112.0 μg·L-1[8],占到了在各环境介质中分布总含量的半数以上,世界各地水域均有BPA被检出,其含量范围为0.0005~4.00 μg·L-1[9-12],且检出量逐年上升。BPA对生活在水中的大型溞和斑马鱼卵发育有显著的抑制作用,甚至有致畸作用[13]。此外双酚A还可以通过直接或者间接机制增加人体和水生动物的患癌风险[14]。目前,有关BPA对人类和哺乳动物等的毒性效应均有报道,但对于海洋微藻的毒性效应研究较少。
海洋微藻是海洋生态系统中最主要的初级生产者,是整个海洋食物链的基础。其对水环境的各种变化极为敏感[15],藻类对污染物不同的响应结果会通过食物网影响着整个水域生态环境的稳定。青岛大扁藻(Platymonas helgolanidica)属于绿藻门、绿藻纲、团藻目、衣藻科、扁藻属。在我国沿海水域广泛分布,并且适应性强,个体微小,结构简单,是较为理想的受试物种。本文以青岛大扁藻为受试物种,测定了其在BPA不同浓度干扰下生长密度、光合特性、抗氧化系统的响应情况,初步探讨了BPA对该藻的生理干扰机理,以期对BPA的海洋水域生态风险评估提供参考资料。
1 材料方法(Materials and methods)
1.1 实验药品
双酚A(Bisphenol, BPA):分子量为228.29,纯度≥98%,购自上海阿拉丁试剂公司。
1.2 藻种培养
实验所需藻种青岛大扁藻(Platmonas helgolanidica)由暨南大学水生生物研究中心藻种室提供。采用改良的f/2培养基静置培养,人工海水为基础介质。光照强度100 μmol·m-2·s-1,光暗周期12 h (L):12 h (D),培养温度25±2 ℃。藻种经过两个周期的活化和扩大培养后用于实验。
1.3 实验设计
以1‰二甲基亚砜作为助溶剂,经预实验分析得出二甲基亚砜的无可观察效应剂量浓度(No observed effect level, NOEL)为1‰。BPA设置6个实验浓度,即2、4、6、8、10 mg·L-1和对照组(1‰二甲基亚砜)对微藻96 h暴露处理,对照组加入等量助溶剂。f/2培养基经高温灭菌处理,接种指数生长期的青岛大扁藻细胞后,分装于250 mL的三角瓶中,培养体积为200 mL,放置于人工气候培养箱中进行一次性培养。每个处理设置三个平行,每天摇瓶3次,并随机更换三角瓶的位置,以避免光照不均匀。
1.4 指标测定与方法
1.4.1 细胞生长的测定
各暴露处理过程中,每隔24 h取藻液2 mL,于显微镜下细胞计数,然后转化为细胞密度,绘制藻类生长曲线,以细胞密度的变化反映藻细胞的生长情况。
1.4.2 光合色素含量的测定
光合色素的提取和测定参考文献[16]并在此基础上加以改良。取单一暴露和联合暴露处理96 h的藻液6 mL离心15 min(5 000 r·min-1),弃上清,加入5 mL抽提液(丙酮:乙醇=1:1配制),震荡摇匀,黑暗处4 ℃静止抽提24 h,同转速离心15 min,取上清液于440 nm、645 nm、663 nm波长下测定吸光值,以空白抽提液为对照,得出3种细胞色素的浓度,并分别换算成单位密度下的色素浓度。色素浓度(mg·L-1)计算公式如下:
叶绿素a=12.7OD663-2.69OD645
叶绿素b=22.9OD645-4.68OD663
叶绿素总量=叶绿素a+叶绿素b=20.2OD645+8.02OD663
类胡萝卜素=4.70OD440-0.27(叶绿素a+叶绿素b)
1.4.3 细胞内抗氧化酶活性测定
粗酶液提取方法参考Ma 和Knörzer[17-18];超氧化物歧化酶(superoxide dismutase, SOD)活性测定采用氮蓝四唑法;抗坏血酸过氧化物酶(aseorbateperoxidase, APX)活性测定方法参考Nakano 和Asada[19-20];单脱氢抗坏血酸还原酶(monodehydroascorbate reductase, MDHAR)活性测定方法参考Miyake[21];脱氢抗坏血酸还原酶(dehydroascorbate reductase, DHAR)活性测定方法参考Dalton 和Nakano[21-22];谷胱甘肽还原酶(glutathione reductase, GR)活性测定方法参考Grace[23]。
1.5 数据分析及处理
数据采用EXCEL 2007和SPSS 13.0进行统计分析。
2 结果(Results )
2.1 双酚A暴露对青岛大扁藻细胞密度的影响
青岛大扁藻经过双酚A暴露96 h处理后,对藻细胞的生长影响情况,如图1所示。研究发现,随着暴露时间的延长,各浓度处理组的细胞密度均逐渐升高。但随着双酚A暴露浓度的增加,升高趋势逐级减弱,与对照组相比,处理组均表现出生长受抑制效应。双酚A暴露浓度与抑制程度两者正相关,说明青岛大扁藻细胞的生长与双酚A暴露浓度呈现出明显的剂量-效应关系。10 mg·L-1处理组其96 h的抑制率达到了60.48%。肉眼观察下藻液颜色明显变浅。通过SPSS软件计算得出双酚A对青岛大扁藻96h-EC50[24]为9.32 mg·L-1,如表1所示。

表1 双酚A对青岛大扁藻的96h-EC50
2.2 双酚A暴露对青岛大扁藻的细胞色素含量的影响
青岛大扁藻经过双酚A暴露96 h处理后,对单位细胞密度下的细胞叶绿素a、叶绿素b以及类胡萝卜素含量的影响,如图2所示。双酚A作用浓度为2 mg·L-1时,即开始诱导Chla、Chlb以及Car含量下降,且随着作用浓度的上升,三者下降幅度逐渐加大,均表现出良好的剂量-效应关系。10 mg·L-1作用浓度下,青岛大扁藻细胞Chla、Chlb以及Car含量分别较对照下降了79.32%、85.73%、68.41%,其中Chlb对双酚A作用最为敏感。
2.3 双酚A暴露对青岛大扁藻SOD酶活性的影响
青岛大扁藻经过双酚A暴露96 h处理后,其超氧化物歧化酶(SOD)活性响应情况,如图3所示。与对照相比,随着BPA浓度的升高,各处理组酶活性均受到双酚A诱导活性上升,并且这种上升趋势随着BPA浓度的增大而逐渐增大。当BPA作用浓度为8 mg·L-1时,SOD酶活性达到最大,比对照增大了40.84%;当BPA作用浓度达到10 mg·L-1时,酶活性略有下降,但相比对照增大了27.98%。
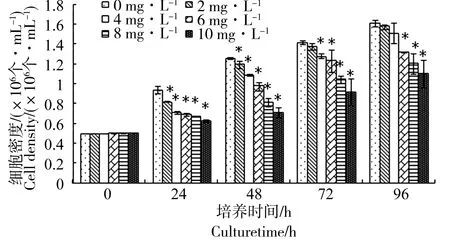
图1 BPA暴露处理对青岛大扁藻细胞密度的影响注:*表示与对照有显著差异(P<0.05)Fig. 1 Cell density of P. helgolanidicaunder differentconcertrations of BPANote: *stands for significant difference compared with CK (P<0.05)
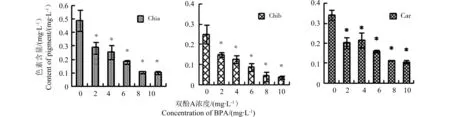
图2 BPA暴露96 h处理对青岛大扁藻单个细胞色素含量的影响注:*表示与对照有显著差异(P<0.05)Fig. 2 Pigment contents of P. helgolanidicaunder different concentrations of BPANote : * stands forsignificant difference compared with CK (P<0.05)

图3 BPA暴露96 h处理对青岛大扁藻超氧化物歧化酶(SOD)活性的影响注:*表示与对照有显著差异(P<0.05)Fig. 3 Effect of BPA on the SOD activity of P. helgolanidicaNote : *stands for significant differencecompared with CK (P<0.05)
2.4 双酚A暴露对青岛大扁藻抗坏血酸-谷胱甘肽循环酶活性的影响
青岛大扁藻经过双酚A暴露96 h处理后,藻细胞内抗坏血酸-谷胱甘肽循环酶活性的影响,如图4所示。本实验条件下,6种浓度BPA处理对青岛大扁藻的抗坏血酸-谷胱甘肽循环均起到了一定的诱导作用。除谷胱甘肽还原酶(GR)外,抗坏血酸过氧化物酶(APX)、单脱氢抗坏血酸还原酶(MDHAR)、脱氢抗坏血酸还原酶(DHAR)在较低浓度暴露(2~4 mg·L-1)时,随着浓度的升高3种酶的活性逐渐增强,4 mg·L-1时达到峰值。当BPA作用浓度继续升高时,酶活性则持续下降,但各组均高于对照组。而谷胱甘肽还原酶(GR)则随着作用浓度的升高酶活性持续增大,10 mg·L-1时最大,相比对照组增大了53.73%。
3 分析与讨论(Analyze and discussion)
3.1 不同浓度的BPA对青岛大扁藻生长的干扰效应
BPA对青岛大扁藻的生长具有抑制作用,抑制程度表现为良好的剂量-效应关系,与李睿[25]的研究结果一致。本实验中BPA对青岛大扁藻96 h EC50为9.32 mg·L-1,属于高毒类有机化合物。
研究表明,叶绿素含量的变化能够较好得反映生物各个阶段的生长发育情况是否正常[26]。本实验中,随着BPA处理浓度的增大,叶绿素a呈现明显的下降趋势,这与荆国华[27]的研究结果一致。其原因一方面可能是BPA胁迫导致叶绿体产生的大量活性氧,活性氧在未能及时清除情况下有足够的时间氧化叶绿体膜,造成基质外漏,代谢功能紊乱、叶绿体结构破坏,叶绿素a含量下降[25]。另一方面可能是由于叶绿体片层中捕光Chla/b-pro复合体的过程合成受到抑制,或者是合成受阻以及被氧化而加速降解这两个过程同时作用的结果[28]。

图4 BPA暴露96 h处理对青岛大扁藻抗坏血酸-谷胱甘肽循环中四种关键酶活性的影响注:*表示与对照有显著差异(P<0.05)Fig. 4 Effect of BPA on the activities of four key enzymes in ascorbate-glutathione cycleNote : * stands forsignificant difference compared with CK (P<0.05)
类胡萝卜素不仅是一种重要的捕光色素,也是一种重要的抗氧化剂。能通过和自由基发生反应或者破坏自由基链反应,起到清除和猝灭有害自由基的作用。青岛大扁藻受BPA暴露96 h处理后,各浓度组类胡萝卜素含量呈现下降趋势可能是受活性氧氧化的结果[29]。
3.2 对青岛大扁藻抗氧化系统的干扰效应
一般认为,一定剂量的毒性物质暴露会导致藻类的光合效率下降,产生过剩激发能,并诱导产生大量活性氧分子。藻体内的SOD酶的主要功能就是催化猝灭有害活性氧,保护细胞免受伤害。本实验中SOD活性的升高可能是由于细胞间硫醇类抗氧化物质含量升高激发了SOD基因的大量表达[30],或者是氧化压力反应基因与控制离子平衡基因受激发共活化所致,因为两者的调节转录因子有重叠[31]。当BPA浓度继续升高,SOD活性略有下降,可能是因为过量的活性氧超过了SOD催化的阈值,对酶本身的结构造成氧化损伤所致。
研究表明,适度的逆境胁迫可以提高抗坏血酸-谷胱甘肽循环中酶的活性[32]。本研究结果中,各处理组的四种酶活性均较对照组有不同程度的上升,与相关的研究结果类似[33,34]。酶活性的升高可能是活性氧刺激相关酶基因的过度表达导致[35]。而在高浓度处理组中,APX、MDHAR、DHAR活性略有下降,可能原因有:1、高浓度胁迫下导致细胞活性氧过量积累,对酶结构本身造成一定程度的损害[36];2、高浓度的BPA处理导致青岛大扁藻光合作用效率明显下降,光合作用过程被严重抑制,进而导致APX活性降低[37]。而GR活性持续上升可能与还原性谷胱甘肽有关。另外,由于GSH在清除活性氧过程中被大量氧化,导致氧化性谷胱甘肽(GSSG)含量增加,GR受到催化的底物的调节酶活性持续升高。
青岛大扁藻抗氧化系统中多种酶受到BPA诱导活性均较对照升高,一定程度上对逆境胁迫表现出积极的响应,但是毒物干扰细胞生长、细胞色素含量减少等导致细胞密度随着胁迫程度的增加逐级下降,并呈现出良好的剂量-效应关系。因此,青岛大扁藻是BPA在水域生态的风险评价中的良好受试物种,另外其对BPA胁迫表现出的各种生长、生理代谢响应也为发展环境激素海洋生态毒理学提供了参考资料。
[1] 曾湘梅. 两种典型内分泌干扰物的研究现状[J]. 有色冶金设计与研究, 2008, 29(1): 41-44
[2] Vandenberg L N, Maffini M V, Sonnenschein C, et al. Bisphenol-A and the great divide: A review of controversies in the field of endocrine disruption [J]. Endocrine-Related Cancer, 2009, 30(1): 75-95
[3] 邓红梅, 梁春营, 永亨. 水环境中双酚A的污染及生态毒理效应[J]. 环境污染与防治, 2009, 7: 70-76
[4] Staples C A, Dorn P B, Kleka G M, et a1. A review of the environmenta1 fate, effects, and exposures of bisphenol A [J]. Chemosphere, 1998, 36(10): 2149-2173
[5] Sugiura-Ogasawara M, Ozaki Y, Sonta S, et al. Exposure to bisphenol A is associated with recurrent miscarriage [J]. Human Reproduction, 2005, 20(8): 2325-2329
[6] Meeker J D, Ehrlich S, Toth T L, et al. Semen quality and sperm DNA damage in relation to urinary bisphenol A among men from an infertility clinic [J]. Reproductive Toxicology, 2010, 30(4): 532-539
[7] Cavalieri E L, Rogan E G. Is bisphenol A a weak carcinogen like the natural estrogens and diethylstilbestrol [J]. IUBMB Life, 2010, 62(10): 746-751
[8] Mackay D, Paterson S. Calculating fugacity [J]. Environmental Science & Technology, 1981, 15(9): 1006-1014
[9] Belfroid A C, Velzen M V, Horst B V, et al. Occurrence of bisphenol A in surface water and uptake in fish: Evaluation of field measurements [J]. Chemosphere, 2002, 49(1): 97-103
[10] Stachel B, Ehrhorn U, Heemken O P, et al. Xenoestrogens in the River Elbe and its tributaries [J]. Environmental Pollution, 2003, 124(3): 497-507
[11] Azevedo D A, Lacorte S, Viana P, et a1. Occurrence of nonylphenol and bisphenol A in surface water from Portugal [J]. Journal of Brazil Chemistry Society, 2001, 12(4): 532-537
[12] Fromme H, Küchler T, Otto T, et al. Occurrence of phthalates and bisphenol A and F in the environment [J]. Water Research, 2002, 36(6): 1429-1438
[13] 刘红玲, 刘晓华, 王晓玮, 等. 双酚A和四溴双酚A对大型溞和斑马鱼的毒性[J]. 环境科学, 2007, 28(8): 1784-1787
Liu H L, Liu X H, Wang X W, et al. Toxicity of BPA and TBBPA to Daphnia magna and zebrafish Brachydanio rerio[J]. Environmental Science, 2007, 28(8): 1784-1787
[14] Cavalieri E L, Rogan E G. Is bisphenol A a weak carcinogen like the natural estrogens and diethylstilbestrol? [J]. IUBMB Life, 2010, 62(10): 746-751
[15] 高玉荣. 杀虫剂单甲脒对绿藻的毒性研究[J]. 环境科学学报, 1995, 15(2): 92-98
[16] 熊丽, 吴振斌, 况其军. 氯氰菊酯对斜生栅藻的毒性研究[J]. 水生生物学报, 2002, 26(1): 66-73
[17] Ma F W, Cheng L L. Exposure of the shaded side of apple fruit to full sun leads to up-regulation of both the xanthophyll cycle and the ascorbate-glutathione cycle [J]. Plant Science, 2004, 166: 1479-1486
[18] Knörzer O C, Burner J, Boger P. Alterations in the antioxidative system of suspension-cultured soybean cells (Glycine max ) induced by oxidative stress [J]. Physiologia Plantarum, 1996, 97: 388-396
[19] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts [J]. Plant Cell Physiologia, 1981, 22: 867-880
[20] Asada K. Production and action of active oxygen species in photosynthetic tissues [M]// Foyer C H, Mullineaux P M (Eds.), Causes of Photooxidative Stress and Amelioration of Defence Systems in Plants [M]. Boca Raton, FL: CRCPress, 1994, 77-104
[21] Miyake C, Asada K. Thylakoid-bound ascorbate peroxidase in spinach chloroplasts and photoreduction of its primary oxidation product monodehydroascorbate radicals in thylakoids [J]. Plant Cell Physiology, 1992, 33: 541-553
[22] Dalton D A, Russell S A, Hanus F J, et al. Enzymatic reactions of ascorbate and glutathione that prevent peroxide damage in soybean root nodules [J]. Proceedings of the National Academy of Sciences of USA, 1986, 83(11): 3811-3815
[23] Grace S C, Logan B A. Acclimation of foliar antioxidant systems to growth irradiance in three broad-leaved evergreen species [J]. Plant Physiology, 1996, 112: 1631-1640
[24] 李晶晶, 杨璞, 叶方立, 等. 一种简单、精确计算EC50的方法[J]. 数理医药学杂志, 2001, 14(6): 481-482
[25] 李睿, 刘玉, 谭凤仪, 等. 双酚A对微小小环藻的毒性效应[J]. 中山大学学报(自然科学版), 2006, 45(3): 110-113
[26] Qian H, Li J, Chen W, et al. The effect of exog-enous nitric oxide on alleviating herbicide damage in Chlorella vulgaris [J]. Aquatic Toxicology, 2009, 92(4): 250-257
[27] 荆国华, 卓静, 李小林, 等. 表面活性剂CTAC和STAB对四尾栅藻的毒性效应[J]. 生态学杂志, 2010, 29(8): 1573-1577
[28] Rontain J F. Visible light-dependent degradation of lipidic phytoplanktonic components during sene-scence: A review [J]. Phytochemistry, 2001, 58(2): 187-202
[29] Thurnham D I. Antioxidant vitamins and cancer prevention [J]. Journal of Micronutrient Analysis, 1990, 7: 279-299
[30] Bower C, Montagu M V, Inze D. Superoxide dismutase and stress tolerance [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43: 83-116
[31] Kullik I, Storz G. Transcriptional regulators of the oxidative stress response in prokaryotes and eukaryotes [J]. Redox Report, 1994, 1: 23-29
[32] Rao M V, Hale B A, Ormrod D P. Amelioration of ozone induced oxidative damage in wheat plants grown under high carbon dioxide [J]. Plant Physiology, 1995, 109(2): 421-432
[33] Aravind P, Prasad M N V. Modulation of cadmium-induced oxidative stress in Ceratophyllum demersum by zinc involves ascorbate-glutathione cycle and glutathione metabolism [J]. Plant Physiology and Biochemistry, 2005, 43: 107-116
[34] Kyong-Suk K, Lim C J, Han T J, et al. Activation of ascorbate-glutathione cycle in Arabidopsis leaves in response to aminotriazole [J]. Journal of Plant Biology, 1998, 41: 155-161
[35] Foyer C H, Lopez-Delgado H, Dat J F, et al. Hydrogen peroxide-and glutathione-associated mechanisms of acclimatory stress tolerance and signalling [J]. Physiology Plant, 1997, 100: 241-254
[36] Alla M M N, Hassan N M, EI-Bastawisy Z M. Changes in antioxidants and kinetics of glutathione S-transferase of maize in response to isoproturon treatment [J]. Plant Biosystems, 2008, 142: 5-16
[37] Ramel F, Sulmon C, Bogard M, et al. Differential patterns of reactive oxygen species and antioxidative mechanisms during atrazine injury and sucrose-induced tolerance in Arabidopsis thaliana plantlets [J]. BMC Plant Biology, 2009, 9: 28-45
◆
Interference Effects of Bisphenol A onPlatymonashelgolanidica
Xiang Kunlun1, Wang Jingjing2, Tang Si1, Duan Shunshan1,*
1. Research Center of Hydrobiology, Key Laboratory of Eutrophication and Red Tide Prevention of Guangdong Higher Education Institutes, Jinan University, Guangzhou 510632, China 2. Centre of Oceanic and Fishery Environment Monitoring of Guangdong Province, Guangzhou 510000, China
Received 19 December 2014 accepted 8 February 2015
The effects of bisphenol A (BPA) on the growth of Platymonas helgolanidica were studied, so as to explore the ecological toxicity effects of BPA on marine microalgae. The exposure concentrations of BPA were 0, 2, 4, 6, 8, and 10 mg·L-1. The parameters such as cell densities, antioxidant enzyme systems , as well as 96 h EC50of P. helgolanidica under different BPA concentrations were measured during the experimental period. The results showed that 96h-EC50of BPA for P. helgolanidica was 9.32 mg·L-1, indicating that BPA was a high toxic pollutant to P. helgolanidica. When P. helgolanidica was exposed to BPA at the above concentrations, the growth of P. helgolanidica was inhibited: both the cell density and cell pigment content was decreased, which was demonstrated by dose effect-relationships. Besides, the activities of superoxide dismutase (SOD), ascorbic acid peroxidase (APX), dehydroascorbate reductase (MDHAR), dehydroascorbate reductase (DHAR), and glutathione reductase (GR) in cells were disturbed in the study.
bisphenol A; Platymonas helgolanidica; interference effects
NSFC-广东省联合基金重点项目(U1133003): 国家重点科学基金项目(41176104)
向昆仑(1990-), 男, 硕士研究生, 从事浮游植物方面研究, E-mail: xkl20130426@163.com
*通讯作者(Corresponding author), E-mail: tssduan@jnu.edu.cn
10.7524/AJE.1673-5897-20141219003
2014-12-19 录用日期:2015-02-08
1673-5897(2015)3-262-06
X171.5
A
段舜山(1955-), 男, 教授, 博士生导师, 主要从事藻类生理生态学研究, 发表SCI等各类论文100多篇
向昆仑, 王晶晶, 唐思, 等. 双酚A对青岛大扁藻的干扰效应[J]. 生态毒理学报,2015, 10(3): 262-267
Xiang K L, Wang J J, Tang S, et al. Interference effects of bisphenol A on Platymonas helgolanidica [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 262-267 (in Chinese)

