症状不典型的冠状动脉药物支架内急性血栓形成2例
龙向淑,吴 强,张 萍,刘志琴
(贵州省人民医院心血管内科,贵阳550002)
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是恢复冠状动脉前向血流的有效手段。药物洗脱支架(drug eluting stent,DES)可显著降低支架内再狭窄的发生率,但其支架内血栓(intra stent thrombosis,IST)形成的发生率(特别是晚期IST)较金属裸支架高[1-2]。接受标准剂量氯吡格雷及低剂量阿司匹林双联抗血小板治疗的急性冠状动脉综合征患者,植入DES后IST 总发生率为1.3%[3]。尽管急性IST 发生率相对较低,但病死率高,故应加强对IST 的判别和治疗。本文报告2例PCI后缺血性胸痛症状不典型的患者。
1 临床资料
病例1:男,78岁,因劳力性胸闷、气促5年,加重伴胸痛1个月入院。有高血压病史及长期大量吸烟史。血压160/88 mm Hg。心电图示Ⅱ、Ⅲ、aVF 见病理性Q 波伴T 波倒置;STV2~5上抬0.10~0.15 mV,TV2~3高尖。心脏超声示左房大(39mm)。三酰甘油3.03mmol/L。诊断:冠状动脉粥样硬化性心脏病;原发性高血压;高三酰甘油血症。入院后给予双联抗血小板聚集(阿司匹林、氯吡格雷)、抗凝等治疗。于入院后次日行冠状动脉造影(CAG)示:左主干狭窄约70%;前降支近中段弥漫性钙化,狭窄80%~90%;回旋支细小,中段始完全闭塞(图1A);右冠见弥漫性粥样斑块,远段节段性狭窄50%~60%。续行PCI于前降支近中段至左主干中远段置入2.5 mm×33.0mm、3.5mm×33.0mm 雷帕霉素药物涂层支架各1枚,术后重复造影示支架覆盖病变全程,未见残余狭窄及夹层,心肌梗死溶栓治疗(TIMI)血流3级(图1B)。术后在双联抗血小板聚集基础上加用替罗非班。术后约5h出现恶心、呕吐,伴间断性胸闷,无胸痛。即予心电图检查,示STI、aVL、V2~5抬高0.1~0.2mV,TV2~4较术前高尖更为明显。予对症处理后恶心、呕吐症状有所减轻,仍有阵发性胸闷,血压偏低,动态观察心电图示ST-T 无明显动态演变,肌钙蛋白I从1.18ng/mL进行性升高至8.82ng/mL,考虑支架内急性血栓形成(AIST)可能。于术后18h再次行CAG 示,左主干支架内狭窄40%~50%,TIMI血流2 级(图1C),考虑AIST。用3.5 mm×9.0mm 球囊于左主干支架内狭窄处扩张,尿激酶50万单位冠状动脉内注射。经皮冠状动脉腔内血管形成(PTCA)复查造影示,支架内狭窄消失,TIMI血流恢复3 级(图1D)。患者症状完全缓解。术后继续三联抗血小板聚集、低分子肝素钙抗凝等治疗。病情缓解出院。
病例2:男,74岁,因反复劳力性胸痛7年,加重6个月入院。有高血压病史6年及长期大量吸烟史。血压135/70mm Hg。心电图示窦性心动过缓,心肌缺血。心脏超声示左房大(42mm)。三酰甘油4.28mmol/L。诊断:冠状动脉粥样硬化性心脏病;原发性高血压;高三酰甘油血症。入院后予冠心病二级预防用药。CAG 发现,左主干未见明显异常;前降支近中段弥漫性病变,狭窄达80%~90%,第一对角支及第二对角支开口及近段狭窄约70%;回旋支细小,近段弥漫性狭窄(最重达80%~90%);右冠状动脉近中段弥漫性病变,狭窄达80%~90%,TIMI血流均为3级(图2A)。于前降支近中段置入3.0mm×36.0mm 雷帕霉素药物涂层支架1枚,于右冠近中段置入2.5mm×36.0mm、2.75mm×36.0mm 雷帕霉素药物涂层支架各1枚。复查造影示,支架覆盖处置病变全程,未见残余狭窄及夹层,TIMI血流3级(图2B)。术后替罗非班强化抗血小板聚集,术后1h患者出现烦躁、恶心及呕吐,无胸痛。心电图示:房颤心律,STV1~5抬高0.1~0.2mV。经对症处理后,患者恶心、呕吐稍缓解,但感阵发性胸闷,动态观察肌钙蛋白I从2.72ng/mL 进行性升高至79.71ng/mL。遂予CAG,前降支支架内可见血栓影,管腔狭窄约85%,TIMI血流2级(图2C)。考虑为AIST,按病例1方法处理后重复造影示狭窄消失,TIMI血流恢复3级(图2D)。患者症状完全消失,续予强化抗血小板聚集等治疗,病情缓解后出院。
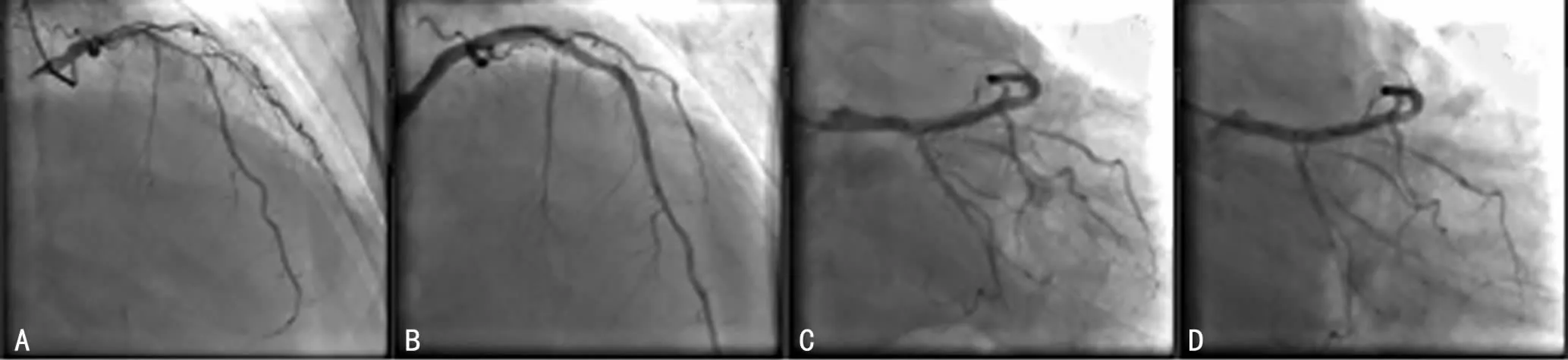
图1 病例1CAG 图像
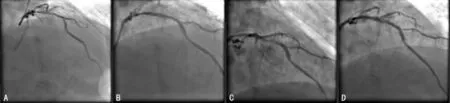
图2 病例2CAG 图像
2 讨 论
IST 是PCI术后致死性并发症之一,临床主要表现为持续胸痛、大汗、低血压、心电图ST 段抬高、病理性Q 波和心肌酶谱及肌钙蛋白升高等。本文2例患者PCI术后24h内发生恶心及呕吐等不典型缺血性胸痛症状,并经心肌坏死标志物检测及造影证实为AIST,符合2007年美国和欧洲学者组成的学术会(ARC)“明确的”AIST 的定义[4]。
IST 发生的具体机制未完全明了,最近1项回顾性研究显示,支架膨胀压力与IST 密切相关,而与是否行后扩张无明确关系[5]。有研究表明,氯吡格雷抵抗为部分患者IST 发生的主要机制[6]。结合此2例患者临床特点,分析其AIST 可能的原因如下:CAG 示冠状动脉病变、弥漫,此可能为AIST 形成的主要原因;两例患者AIST 均发生于前降支,前降支PCI是否有较高的IST 发生率有待大样本临床研究明确;此外,高三酰甘油血症、高龄、吸烟及术后血压偏低可能亦是AIST 的预测因素。冠状动脉支架常置入其主干血管,AIST 可导致灾难性后果,因此,PCI术后一旦发生AIST 应及时妥善处置。此两例患者以恶心及呕吐为主要临床表现,缺血性胸痛症状不典型,经心肌酶学、肌钙蛋白及CAG 检查及时证实为AIST 后采用球囊在IST 形成部位扩张后予冠状动脉内注射溶栓药物均取得肯定效果,在以后相似的临床情况中值得借鉴。
PCI围术期的正确管理是预防IST 的关键,有IST 高危因素的患者,应采取针对性预防措施,如血小板功能的评估与监测及ADP受体P2Y12基因型分析等,以指导个体化治疗。此外,术后控制好血压及保持情绪稳定亦非常重要。PCI术后出现恶心及呕吐等缺血性胸痛症状不典型患者,应动态观察心电图及心肌坏死标志物变化,避免AIST 漏诊,延误治疗。
[1] Kim HK,Jeong MH.Coronary stent thrombosis:current insights into new drug-eluting stent designs[J].Chonnam Med J,2012,48(3):141-149.
[2] Kolandaivelu K,Swaminathan R,William J,et al.Stent thrombogenicity erly in high risk interventional settings is driven by stent design and deployment,and protected by Ploymer-Drug coatings[J].Circulation,2011,123(13):1400-1409.
[3] Mehta SR,Tanguay JF,Eikelboom JW,et al.Double-dose versus standard-dose clopidogrel and high-dose versus low-dose aspirin in individuals undergoing precutaneous coronary intervention for acute coronary syndromes(CURRENT-OASIS7):a randomized factorial trial[J].Lancet,2010,376(9748):1233-1243.
[4] Cutlip DE,Windecker S,Mehran R,et al.Academic research consortium.clinical end points in coronary stent trials:a case for standardized definitions[J].Circulation,2007,115(17):2344-2351.
[5] Frobert O,Sarno G,James SK,et al.Effect of stent inflation pressure and post-dilatation on the outcome of coronary artery intervention.A report of more than 90000 stent implantations[J].PLoS One,2013,8(2):e56348.
[6] Mehta SR,Bassand JP,Chrolavicius S,et al.Design and rationale of CURRENT-OASIS 7:a randomized,2×2factorial trial evaluating optimal dosing strategies for clopidogrel and aspirin in patients with ST and non-ST-elevation acute coronary syndromes managed with an early invasive stragety[J].Am Heart J,2008,156(6):1080-1088.

