脱氢洛伐他汀对佐剂性关节炎的作用研究*
邓庆华,杨元娟△,周岐新,刘晓颖,顾 群
(1.重庆医药高等专科学校药学院 401331;2.重庆医科大学药学院药理教研室 400016)
脱氢洛伐他汀(dehydrolovastatin,DLVT)是他汀类的一个新衍生物,前期的研究表明DLVT 在使用相当于洛伐他汀的用量时,其调脂作用、改善脂肪肝的作用及抗炎作用强度与等剂量的洛伐他汀大致相当,具有潜在的应用价值[1]。本实验以AA 小鼠为模型,进一步观察脱氢洛伐他汀对小鼠佐剂性关节炎(adjuvant arthritis,AA)的治疗作用,并探讨作用机制。
1 材料与方法
1.1 药品、试剂及仪器 药品:DLVT 由重庆大新药业股份有限公司提供,批号20120501。对照药物:洛伐他汀(lovastatin,LVT),由重庆大新药业股份提供,批号20120501。阳性对照药:酮洛芬(ketoprofen,KPF)由西南合成制药股份有限公司提供,批号20120401。临用时,用电子分析天平称取一定量,在研钵内研磨细后用0.5%的羧甲基纤维素钠配成适当的溶液备用。弗氏完全佐剂(Freund′s complete adjuvant,FCA)由Sigma公司提供,10mL。仪器包括电子分析天平、YLS-7B足跖容积测量仪、3K30型超低温离心机、台式高速离心机、显微镜、DNP-9052型电热恒温培养箱、酶标仪等。
1.2 动物 昆明小鼠(20±2)g 60只,清洁级,雄性,由重庆医科大学实验动物中心提供。批号SCXK(渝)2012001。
1.3 方法
1.3.1 分组及给药 将60只小鼠随机分为6组,即正常对照组、佐剂性关节炎模型(AA)组、DLVT 低剂量组(8.4 mg·kg-1·d-1)和高剂量组(16.8mg·kg-1·d-1)、LVT 组(8.4 mg·kg-1·d-1)、KPF 组(20 mg·kg-1·d-1),每组10 只。各药物处理组小鼠造模后灌胃相应药物,正常组和模型组给予等体积0.5%的羧甲基纤维素钠。
1.3.2 小鼠佐剂性关节炎模型的建立[2]于第3天给予弗氏完全佐剂后30min,除正常对照组外,其余各组每只小鼠右后足跖皮内注射FAC 0.1mL,正常对照组注射等量生理盐水,造模后连续给予弗氏完全佐剂30d。
表1 DLVT 对AA 小鼠原发性、继发性足肿胀的影响(±s,mL,n=10)
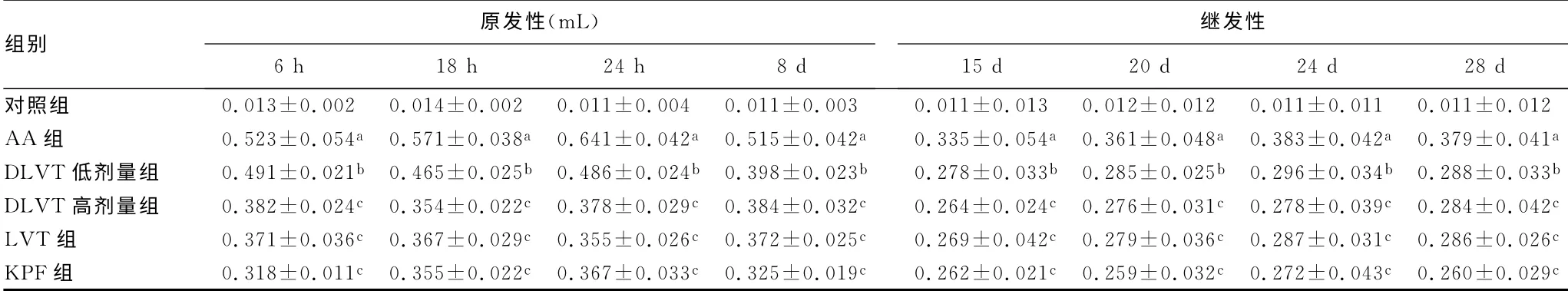
表1 DLVT 对AA 小鼠原发性、继发性足肿胀的影响(±s,mL,n=10)
a:P<0.01,与对照组比较;b:P<0.05,c:P<0.01,与AA 组比较。
组别原发性(mL)6h 18h 24h 8d继发性15d 20d 24d 28d对照组 0.013±0.002 0.014±0.002 0.011±0.004 0.011±0.003 0.011±0.013 0.012±0.012 0.011±0.011 0.011±0.012 AA 组 0.523±0.054a 0.571±0.038a 0.641±0.042a 0.515±0.042a 0.335±0.054a 0.361±0.048a 0.383±0.042a 0.379±0.041a DLVT 低 剂 量 组 0.491±0.021b 0.465±0.025b 0.486±0.024b 0.398±0.023b 0.278±0.033b 0.285±0.025b 0.296±0.034b 0.288±0.033b DLVT 高 剂 量 组 0.382±0.024c 0.354±0.022c 0.378±0.029c 0.384±0.032c 0.264±0.024c 0.276±0.031c 0.278±0.039c 0.284±0.042c LVT 组 0.371±0.036c 0.367±0.029c 0.355±0.026c 0.372±0.025c 0.269±0.042c 0.279±0.036c 0.287±0.031c 0.286±0.026c KPF组 0.318±0.011c 0.355±0.022c 0.367±0.033c 0.325±0.019c 0.262±0.021c 0.259±0.032c 0.272±0.043c 0.260±0.029 c
1.3.3 小鼠佐剂性关节炎模型的评价[3]致炎前先用足跖容积测量仪分别测量小鼠左右足爪容积作为基础值,分别在致炎后6、18、24h,8d,测量小鼠致炎侧足爪容积,以致炎前后足跖容积之差为肿胀度,观察AA 小鼠原发性病变;在致炎后第15、20、24、28天分别测量小鼠致炎对侧足足爪容积,以致炎前后足跖容积之差为肿胀度,观察AA 小鼠继发性炎症情况。致炎后15~28d,同时观察小鼠前肢、后肢、耳、鼻和尾部病变的发生情况,并进行评分,每只动物的评分相加得关节炎指数。计算各组的关节炎指数来评价继发性病变的严重程度。
1.3.4 小鼠爬梯实验 小鼠爬梯箱为白色塑料制成,结构标准化,内含5级高2.5cm、宽10cm 的相同楼梯,内壁高度恒定,以使小鼠在楼梯的所有水平都有相同的站立分布,在安静、光线恒定的环境下进行。致炎后30d将各组小鼠依次置于箱的底部,背朝楼梯放入。记录3 min内小鼠的爬梯数和站立数。每只动物实验结束后迅速放入清洁实验箱,以排除嗅觉暗示对下一只动物的干扰。通过爬梯实验反映小鼠的运动活性。
1.3.5 MTT 法检测LPS诱导的脾淋巴细胞增殖反应[4]30 d后脱颈处死小鼠,无菌取出脾脏,剔除脂肪和结缔组织后捻碎,收集单个脾细胞,调整细胞浓度为5×106/L。于96孔培养板上每孔加入100μL脾细胞悬液,在分别加入100μL 含5 mg/L脂多糖(LPS)的RPMI1640培养液。置37 ℃湿度饱和的5% CO2培养箱中培养48h,终止培养前4h每孔加入5 mg/mL的MTT 10μL,震荡后继续培养4h,培养结束后取出96孔板,离心,吸弃上清液,每孔加入100μL 二甲基亚砜,置摇床上低速震荡10min,使结晶物充分溶解。在酶联免疫检测仪570nm 处测量各孔的吸光度(A)值,每份样品做3个复孔,结果以3个复孔A值平均值表示。
1.3.6 小鼠非致炎侧踝关节病理检查 30d眼球取血处死小鼠后剪取左踝关节,10%的甲醛溶液固定,石蜡包埋切片,制作标本,苏木精-伊红(HE)染色,光镜下观察组织病理学变化。
1.3.7 小鼠血清中TNF-α、IL-6、IL-1、NO 的检测 造模30d后麻醉小鼠,摘除眼球取血。离心取血清,按照双抗体两步夹心ELISA 试剂盒说明书操作,分别检测小鼠血清中TNF-α、IL-6、TL-1、NO 细胞因子的水平。
1.4 统计学处理 采用SPSS12.0软件进行统计学分析。计量资料以±s表示,组内比较采用单因素方差分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 DLVT 对AA 小鼠原发性炎症的影响 AA 组小鼠致炎后不同时段致炎侧足肿胀度均显著高于对照组(P<0.01),致炎后第24小时足肿胀达到高峰。各药物组从致炎6h后均发挥药效,DLVT(8.4、16.8 mg·kg-1·d-1)灌胃给药可抑制AA 小鼠的原发性足肿胀,与AA 组比较差异均有统计学意义(P<0.05,P<0.01),见表1。与AA 组比较,DLVT(8.4、16.8mg·kg-1·d-1)灌胃给药可抑制AA 小鼠继发性足肿胀,并减少多发性关节炎指数。见表1、2。
表2 脱氢洛伐他汀对AA 小鼠多发性关节炎 指数的影响(±s,n=10)

表2 脱氢洛伐他汀对AA 小鼠多发性关节炎 指数的影响(±s,n=10)
a:P<0.01,与对照组比较;b:P<0.05、c:P<0.01,与AA 组比较。
组别15d 20d 24d 28d对照组0.41±0.15 0.32±0.12 0.21±0.14 0.11±0.12 AA组 5.18±0.82a 6.49±0.68a 6.88±0.91a 5.29±0.75a DLVT低剂量组 4.63±0.52 5.85±0.81b 5.94±0.68c 3.87±0.73c DLVT高剂量组 4.63±0.55 4.78±0.73c 5.98±0.62b 3.85±0.65c LVT组 4.56±0.77 4.76±0.64c 4.57±0.81c 3.68±0.74c KPF组 4.83±0.62 4.58±0.52c 4.63±0.61c 3.27±0.86 c
2.2 脱氢洛伐他汀对AA 小鼠爬梯活动的影响 与正常组比较,AA 组小鼠运动活动功能明显下降,举足站立和爬梯数减少(P<0.05)。与AA 组比较,DLVT(16.8mg·kg-1·d-1)灌胃给药可明显增强AA 小鼠站立和爬梯能力。见表3。
表3 DLVT 对AA 小鼠爬梯活动及脾淋巴细胞增殖 的影响(±s,n=10)

表3 DLVT 对AA 小鼠爬梯活动及脾淋巴细胞增殖 的影响(±s,n=10)
a:P<0.01,与对照组比较;b:P<0.05、c:P<0.01,与AA 组比较。
组别 举前足数(次/3min)爬梯数(次/3min)A 值(570nm)对照组10.6±2.4 14.7±4.0 0.451±0.062 AA 组 6.3±2.4a 7.6±3.1a 0.565±0.081a DLVT 低剂量组 7.6±3.5 10.7±3.2b 0.491±0.083b DLVT 高剂量组 8.9±2.8b 11.6±3.9c 0.486±0.091b LVT 组 9.4±2.5b 12.2±4.7c 0.475±0.086b KPF组 9.7±3.4b 11.6±3.5c 0.468±0.091 b
2.3 脱氢洛伐他汀对AA 小鼠脾淋巴细胞增殖反应的影响 与对照组比较,AA 组小鼠脾淋巴细胞增值明显增强(P<0.05),而DLVT(8.4、16.8mg·kg-1·d-1)灌胃给药可抑制LPS诱导的AA 脾淋巴细胞的增殖反应。见表3。
2.4 DLVT 对AA 小鼠非致炎侧踝关节病理结果影响 对照组小鼠踝关节结构正常;AA 组踝关节滑膜上皮呈乳突状增生,滑膜大量炎症细胞浸润,血管增生,关节软骨破坏;DLVT低剂量组关节滑膜纤维组织中度增生伴少量炎症细胞浸润;DLVT 高剂量组关节滑膜纤维组织轻度增生伴少量炎症细胞浸润;LVT 组踝关节结构基本正常;KPF 组关节滑膜纤维组织轻度增生伴少量炎症细胞浸润。见图1。
2.5 DLVT 对AA 小鼠血清TNF-α、IL-6、IL-1、NO 水平的影响 AA 组小鼠血清IL-6、IL-1、NO 及TNF-α含量均显著高于对照组(P<0.01),其余各给药组小鼠血清IL-6、IL-1、NO及TNF-α含量均显著低于AA 组(P<0.01),见图1、表4。

图1 DLVT 对AA 小鼠非致炎侧踝关节病理检查结果(HE×100)
表4 小鼠血清中IL-6、IL-1、NO、TNF-α的检测(±s,n=10)

表4 小鼠血清中IL-6、IL-1、NO、TNF-α的检测(±s,n=10)
a:P<0.01,与对照组比较;b:P<0.01,与AA 组比较。
组别 IL-6(pg/mL) IL-1(pg/mL) NO(μmol/L) TNF-α(pg/mL)对照组 47.24±1.51 53.50±1.40 120.00±1.79 207.24±24.51 AA 组 102.14±1.44a 119.36±2.51a 168.85±2.41a 402.14±31.44a DLVT 低剂量组 80.94±1.24b 86.68±1.31b 141.86±2.73b 319.94±35.24b DLVT 高剂量组 82.21±1.59b 80.90±2.91b 134.86±2.12b 296.67±24.38b LVT 组 76.67±1.38b 88.43±0.79b 140.00±2.08b 282.21±31.60b KPF组 62.22±1.55b 67.49±1.22b 129.29±2.14b 262.22±42.58 b
3 讨 论
近年的基础和临床研究发现,他汀类药物抑制类异戊二烯(isoprenoid)中间体如异戊二烯焦磷酸法尼酯(farnesylpyrophosphate,FPP)和类异戊二烯四异戊二烯焦磷酸 (geranylgeranylpyrophosphate,GGPP)合成,进而抑制细胞内类异戊二烯依赖的蛋白[5],发挥抗心血管重构、抗肿瘤、预防痴呆、抗炎和免疫调节等多种作用,因而对身患代谢性疾病兼有风湿、类风湿性关节炎(RA)和Crohn′s 病患者具有良好临床疗效[6]。
在RA 整个病理过程中都有细胞因子参与,它们构成了一个细胞因子网络,可以互相调控,其中IL-1、IL-6、TNF-α为前炎性因子。研究发现,RA 患者关节中的巨噬细胞和淋巴细胞产生大量TNF-α,患者关节滑液中TNF-α的浓度比健康人高,TNF-α刺激关节滑膜细胞增生,诱导淋巴细胞向炎性关节区聚集,并大量释放炎症相关的细胞因子,如IL-1、IL-6等,促进胶原酶和基质降解酶等金属蛋白酶的产生,这些均刺激破骨细胞的分化和活性,导致骨关节的损伤[13]。
IL-1是内源性致热原可诱导其他多种前炎症细胞因子的表达,参与RA 的病理损害[8]。研究表明RA 患者血清及关节液中检测出高水平的IL-1[9],IL-1是RA 关节软骨破坏最重要的一种细胞因子,促进滑膜细胞核软骨细胞合成并释放PGE2和胶原酶,诱导RA 关节滑液细胞增殖及产生蛋白激酶,PGE2和胶原酶可引发滑膜炎性反应、软骨基质的崩解。TNF-α与IL-1常常同时合成与分泌,还促进对方的合成,对RA 共同起到“中心犯罪”的作用。大量研究也表明在RA 患者血清及关节液中的IL-6水平升高,活动期患者滑液中IL-6含量是血清内的1 000多倍,其阻滞剂能明显改善实验动物以及临床RA患者的症状[10]。
现代研究认为NO 的过度合成是RA 发病机制的重要因素之一。研究发现在RA 和骨关节炎患者的滑膜液和血液中可检测到大量NO 代谢产物亚硝酸盐,推测NO 参与这两种疾病关节炎症的病理过程。DLVT 明显减少NO 生成,抑制了关节炎症的进一步发展。
本研究显示DLVT 减轻AA 小鼠原发性和继发性关节炎,减少多发性关节炎指数,增强AA 小鼠站立和爬梯能力,抑制AA 小鼠脾淋巴细胞的增殖反应,通过细胞因子的检测进一步发现,模型小鼠外周血清中的IL-6、IL-1、NO 及TNF-α水平显著升高。从病理改变程度方面,DLVT 能有效控制AA 小鼠关节纤维增生和滑膜增生,减少炎症细胞的浸润。因此,DLVT 能控制AA 小鼠的病情发展,其明显抑制促炎症细胞因子IL-6、IL-1、NO 及TNF-α病理性的升高可能是DLVT 有效治疗RA 的作用机制之一。
[1] 邓庆华,周岐新,陈勇,等.脱氢洛伐他汀的调脂和抗炎作用的关系[J].中国新药杂志,2011,20(2):162-166.
[2] 王贵林,朱路.生姜油对小鼠佐剂性关节炎的作用[J].中药药理与临床,2007,23(5):94-95.
[3] 徐叔云,卞如濂,陈修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:919-922.
[4] Tomita T,Kakiuchi Y,Tsao PS.THR0921,a novel peroxisome proliferators activated receptor gamma agonist,reduces the severity of collagen-induced arthritis[J].Arthritis Res Ther,2005,8(1):10-18.
[5] Ghittoni R,Paturssi L,Pirozzi K,et al.Simvastatin inhibits T-cell activation by selectively impairing the function of Ras super-family GTPases[J].FASEBJ,2005,19(6):605-607.
[6] Zhou Q,Liao JK.Pleiotropic effects of statins-basic research and clinical perspectives[J].Circ J,2010,74(5):818-826.
[7] 李可大.免疫调节和前炎性因子(TNF-α)在类风湿性关节炎中的作用与意义[J].中医药学刊,2004,22(10):1844-1849,1865.
[8] 唐恩洁.医学免疫学[M].3 版.成都:四川大学出版社,2004:75-77.
[9] Kokebie R,Aggarwal R,Lidder SA,et al.The role of synovial fluid markers of catabolism and anabolism in osteoarthritis,rheumatoid arthritis and asymptomatic organ donors[J].Arthritis Res Ther,2011,13(2):R50.
[10] 魏伟,李晓辉,张洪泉.抗炎免疫药理学[M].北京:人民卫生出版社,2005:283-284.
[11] Abdin AA,Abd El-Halim MS,Hedeya SE,et al.Effect of atorvastatin with or without prednisolone on Freund′s adjuvant induced-arthritis in rats[J].Eur J Pharmacol,2012,676(1/3):34-40.

