高糖状态下甲状旁腺素受体1对乳腺癌的作用机制研究*
梁华晟,钟宇华
(广西医科大学第九附属医院内分泌代谢研究所,广西北海536000)
近年来,流行病学研究提示,在糖尿病患者中,乳腺癌的发生率显著高于非糖尿病患者群[1]。但具体的机制仍然未阐明。G 蛋白耦联受体甲状旁腺激素受体1(type 1receptor parathyroid hormone,PTH1R)发现于20世纪80年代,是甲状旁腺素相关蛋白(parathyroid hormone-related protein,PTHrP)的作用受体,PTHrP是一种与细胞增殖与凋亡调控相关的生长因子,既往本课题组研究发现乳腺浸润性导管癌组织中,糖尿病患者PTH1R 阳性表达率高于非糖尿病患者[2]。为此,本实验拟进行在高糖状态下探讨PTH1R 对乳腺癌细胞株中的作用,为寻求糖尿病与乳腺癌之间的内在联系、糖尿病患者合并乳腺癌的防治提供实验依据。
1 材料与方法
1.1 细胞株选择及培养 选用大鼠乳腺腺癌细胞系SHZ-88(中科院)进行研究,采用RPMI1640 基础培养基(Gibco 公司),置于37 ℃含5%CO2培养箱内。每周换液2~3次。
1.2 实时(real time)PCR 检测PTH1R mRNA表达分别以0、5、15、25mmol/L葡萄糖为研究浓度,作用48h后应用real time PCR 检测不同浓度下PTH1R mRNA 表达情况。采用SybrgreenⅠ染料法,总RNA 的抽提与互补DNA(cDNA)的合成按照试剂盒说明书进行。本实验设定β-actin 为内参基因。采用Primer 5.0 软件设计相应PTH1R 和β-actin 引物。PTH1R 引物序列,正向:5′-AGT ACC GGA AGC TGC TCA GGT C-3′,反向:5′-GCA TCT GGA TCT GCC ACA AT-3′,扩增片段120bp;β-actin引物序列,正向:5′-CCT AGG CAC CAG GGT GTG AT-3′,反向:5′-TTG GTG ACA ATG CCG TGT TC-3′,扩增片段为122bp。各组PTH1RmRNA 分别在荧光定量PCR 仪上进行real time PCR 反应,△△Ct方法进行计算和统计。
1.3 PTH1R 基因沉默SHZ-88细胞的构建及鉴定 参考本研究课题组所构建PTH1R 基因沉默的细胞模型进行试验[7],共筛选出3个阳性克隆及一个阴性克隆。应用pSUPERretro-GFP/Neo载体(美国OligoEngine公司)合成干扰片段后,经过菌落PCR 及测序鉴定,应用Lipofectamine2000(美国Invitrogen公 司)转 染SHZ-88 细 胞,48 h 后 Western blot 检 测PTH1R 蛋白表达筛选出最佳的PTH1R 干扰片段的SHZ-88细胞模型。
1.4 MTT 检测SHZ-88细胞活力 取浓度 为25mmol/L 葡萄糖为研究浓度。无糖培养基组(对照组);高糖状态(25 mmol/L D-葡萄糖,后同)培养基组(高糖组);高糖状态下的阴性基因序列组(高糖siPTH1R-NC 组);高糖状态下的阳性基因序列组(高糖siPTH1R 组)。在处理后48h进行以下实验。取对数生长期SHZ-88,按每孔约3×104个接种于6孔培养板中,待细胞贴壁后,吸去原有RPMI 1640培养液,换为含10%小牛血清(FCS)培养液,培养24h 使所有细胞的生长同步化。在37 ℃,5%CO2条件下培养2d,每孔细胞均为每24小时换液1次。分别在8、16、24及48h MTT(南京凯基生物技术公司)法检测细胞增殖情况。以于酶标仪上检测490nm 波长吸光度(A)值。
1.5 SHZ-88 细胞凋亡情况 将细胞种于干净盖玻片上。PBS洗细胞3次,5min/次。4%甲醛固定20min。70%乙醇-20 ℃30min。PBS洗3次,5min/次。0.1%Triton X-100/0.1%柠檬酸三钠溶液破膜,室温10min。PBS洗3次,5min/次。3%H2O2室温孵育10min封闭内源性过氧化物酶。PBS洗3 次,5 min/次。TdT 酶反应液(buffer:TdT 酶:FITCdUTP为45∶4∶1)37 ℃湿盒避光孵育90min。PBS洗2次,2min/次,避光。Hoechst33258 复染核,室温20 min,避光。0.5%Tween 20-PBS洗3次,2min/次,避光。缓冲甘油封片,拍照。实验结果以OlympusBX51 荧光显微镜拍照(×250)。结果判定:TUNEL-FITC 染色阳性,同时Hoechst33258 染色为强蓝色为凋亡细胞。TUNEL-FITC 染色阴性,同时Hoechst33258染色浅蓝色为正常细胞。
1.6 Western blot检测PTH1R、凋亡因子Bax及抑凋亡因子bcl-2表达 进行常规细胞裂解获取蛋白后,与预染蛋白marker一起上样,经分离胶和浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,完毕后将蛋白质电转印到聚偏氟乙烯(PVDF)膜上,将膜放入含100g/L 脱脂奶粉的TBST中封闭,4 ℃过夜,然后与一抗[鼠 抗PTH1R(1∶1 000)、Bax(1∶1 000)及Bcl-2(1∶750)均为美国Santa Cruz公司]室温孵育90min或4 ℃过夜,用TBST 液洗膜3次,每次5min,PVDF膜与辣根过氧化物酶标记的相应二抗(武汉Boster公司,1∶1 000)室温孵育45 min 后,TBST 液洗膜3次,每次5min。ECL显色试剂盒显示目的条带。
1.7 统计学处理 采用SPSS17.0软件进行统计学分析,计量资料采用±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同葡萄糖浓度对SHZ-88细胞株PTH1R mRNA 水平及细胞活性的影响 应用real time PCR 检测不同浓度葡萄糖对SHZ-88细胞中PTH1R mRNA 水平,结果发现25mmol/L葡萄糖作用SHZ-88细胞PTH1R mRNA 水平高于其他3组葡萄糖浓度,差异有统计学意义(P<0.01)。且PTH1R mR-NA 水平随着葡萄糖浓度升高而升高,提示SHZ-88 细胞中PTH1R mRNA 水平具有葡萄糖浓度依赖性。为进一步检测不同浓度葡萄糖对SHZ-88 细胞活性的影响,研究将应用MTT 检测各组细胞活力,结果发现SHZ-88细胞活性具有葡萄糖浓度依赖性,25mmol/L葡萄糖浓度刺激下SHZ-88细胞活性高于0、5、15mmol/L葡萄糖的作用。见表1。
表1 不同浓度葡萄糖对PTH1R mRNA 及细胞 活性的影响(±s)

表1 不同浓度葡萄糖对PTH1R mRNA 及细胞 活性的影响(±s)
a:P<0.05,与0 mmol/L 葡萄糖比较;b:P<0.01,与0 mmol/L葡萄糖比较;c:P<0.01,与5mmol/L 葡萄糖比较;d:P<0.01,与15 mmol/L 葡萄糖比较。
葡萄糖浓度(mmol/L) PTH1R mRNA 细胞活性(%)0 1.00±0.00 0.55±0.04 5 1.13±0.11 0.57±0.02 15 1.18±0.05a 0.61±0.03a 25 1.57±0.11bcd 0.68±0.01 bcd
2.2 通过PTH1R 基因沉默SHZ-88细胞模型确定 PTH1R mRNA水平及细胞Western blot结果提示转染48h后siPTH1R-2中PTH1R 蛋白表达抑制率达到60%以上,高于siPTH1R-1及siPTH1R-3,故此,siPTH1R-2基因序列为最佳PTH1R 抑制基因序列,用于后续研究。
2.3 PTH1R 对高糖状态下SHZ-88细胞增殖及凋亡的影响 应用MTT 检测24~96h的SHZ-88细胞活力,以阐明细胞增殖能力,结果在48h时,高糖组细胞活力高于对照组、高糖siPTH1R-NC组及高糖siPTH1R 组(均P<0.01),同时与对照组及高糖siPTH1R-NC组比较,高糖siPTH1R 组细胞活力受显著抑制(均P<0.01),见图1。为进一步观察PTH1R 对SHZ-88细胞凋亡的影响,应用TUNEL-FITC/Hoechst33258检测细胞凋亡,结果如图2所示高糖siPTH1R 组细胞凋亡水平(9.13±1.61)%,显著高于对照组(0.88±0.21)%、高糖组(0.71±0.23)%及高糖siPTH1R-NC 组(0.96±0.12%)差异有统计学意义(P<0.05)。该系列结果说明高糖状态下PTH1R表达水平可能影响了SHZ-88细胞的增殖及凋亡。在高糖siPTH1R-NC组较高糖组细胞增殖水平降低、凋亡增高,考虑可能与转染试剂的细胞毒性有关。
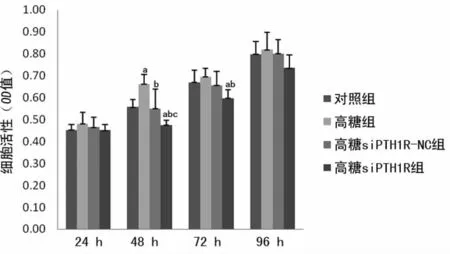
图1 PTH1R 对高糖状态下SHZ-88细胞增殖能力的影响
2.4 PTH1R 对高糖状态下SHZ-88细胞中Bax及Bcl-2表达的影响 与对照组、高糖组及高糖siPTH1R-NC 组比较,PTH1R 干扰处理后,促凋亡因子Bax表达上调,同时促增殖因子Bcl-2表达下调(均P<0.01),高糖组中Bax表达低于对照组,Bcl-2表达高于对照组(均P<0.01),进一步提示高糖状态下PTH1R 可能通过影响Bax及Bcl-2 的表达水平调控了SHZ-88细胞的存活能力。见图3。
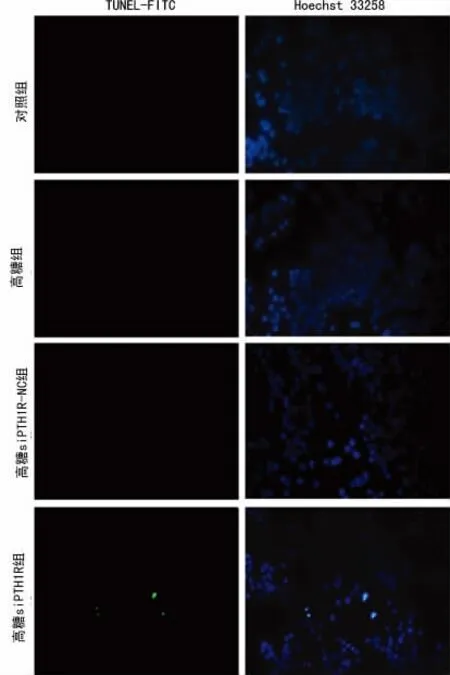
图2 细胞凋亡水平检测
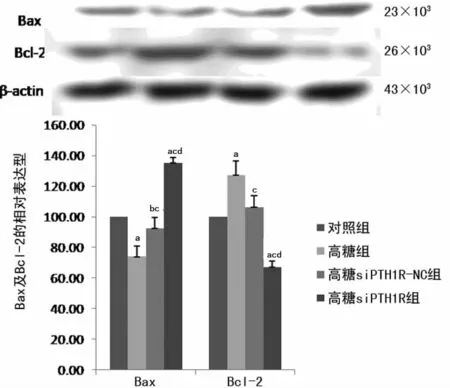
图3 PTH1R 对高糖状态下SHZ-88细胞Bax及Bcl-2表达影响
3 讨 论
近年来,由于糖尿病患者乳腺癌发病人数的迅猛增长,糖尿病和乳腺癌的关系受到越来越多的关注。大量流行病学证据表明糖尿病患者乳腺癌的发病率和病死率较非糖尿病患者显著增加[1]。糖尿病患者高发乳腺癌的原因及其机制目前仍不十分清楚,一般认为和高糖、胰岛素抵抗和(或)高胰岛素血症等因素有关。流行病学研究表明PTHrP及其受体PTH1R与恶性肿瘤的发生发展有着密切的关系,特别在乳腺癌的转移发生发展中扮演着重要的角色。目前,有关PTH1R 与乳腺癌相关方面的研究较少,既往本课题组已经发现糖尿病合并乳腺癌患者的PTH1R 表达水平显著高于非糖尿病乳腺癌患者[2],但其作用机制尚未完全清楚。
为进一步阐明高糖诱导PTH1R 表达后对SHZ-88细胞生物学行为的影响,本研究将引入PTH1R 基因沉默的细胞模型进行观察。结果发现,在高糖状态下PTH1R 基因沉默的SHZ-88细胞活力分别比较高糖组及高糖siPTH1R-NC 组下降,而且PTH1R 低表达能显著促进SHZ-88细胞凋亡,诱导促凋亡因子Bax表达上调,抑制促增殖因子Bcl-2表达,相应在高糖状态下SHZ-88细胞增殖活性显著高于对照组。由于葡萄糖是刺激或维系肿瘤细胞生长主要营养物质,Okumura等[3]研究发现高浓度葡萄糖(25mmol/L 葡萄糖)能刺激人乳腺癌细胞株MCF-7细胞增殖,既往的研究还发现各种与葡萄糖调节有关的细胞因子或激素,包括胰岛素、葡萄糖转运蛋白4、葡萄糖调节蛋白78等均是调控乳腺癌增殖的重要转录因子,该系列因子由葡萄糖诱导表达后,能显著促进乳腺癌细胞增殖,抑制凋亡[4-7]。Dittmer等[8]在应用基因干扰技术沉默PTHrP后也发现能抑制乳腺癌细胞株的增殖。
既往本课题研究也已经提示,由于PTHrP 及其受体PTH1R 在恶性肿瘤的发生发展中起着重要的作用,PTH1R的激活与肿瘤生物学行为密切相关,PTH1R 阳性的肿瘤比阴性的肿瘤有更大的恶性倾向,高糖状态下乳腺癌细胞PTH1R表达升高,并与其预后相关[2]。结合本研究的结果提示高糖可以直接刺激PTH1R 的表达,从而影响乳腺癌细胞的增殖,PTH1R 可能是高糖状态下肿瘤细胞生存保护性因素之一。也逆向提示了抑制PTH1R 的表达可能是治疗糖尿病合并乳腺癌的有效靶点之一。
[1] Michels KB,Solomon CG,Hu FB,et al.Type 2diabetes and subsequent incidence of breast cancer in the Nurses′Health Study[J].Diabetes Care,2003,26(6):1752-1758.
[2] 黄宇,梁华晟,钟宇华,等.甲状旁腺激素受体1在糖尿病合并乳腺浸润性导管癌患者的表达及意义[J].山东医药,2012,52(36):40-41.
[3] Okumura M,Yamamoto M,Sakuma H,et al.Leptin and high glucose stimulate cell proliferation in MCF-7human breast cancer cells:reciprocal involvement of PKC-alpha and PPAR expression[J].Biochimica et Biophysica Acta,2002,1592(2):107-116.
[4] Schmidt M,Voelker HU,Kapp MA,et al.Glycolytic phenotype in breast cancer:activation of Akt,up-regulation of GLUT1,TKTL1 and down-regulation of M2Pk[J].J Cancer Res Clin Oncol,2010,136(2):219-225.
[5] Gunter MJ,Hoover DR,Yu HA,et al.Insulin,Insulin-Like growth Factor-I,and risk of breast cancer in postmenopausal women[J].J Natl Cancer Inst,2009,101(1):48-60.
[6] Yeung B,Kwan B,He QY,et al.Glucose-regulated protein 78 as a novel effector of BRCA1for inhibiting stress-induced apoptosis[J].Oncogene,2008,27(53):6782-6789.
[7] Kuo SJ,Wu YC,Chen CP,et al.Expression of glucose transporter-1in Taiwanese patients with breast carcinoma--apreliminary report[J].Kaohsiung J Med Sci,2006,22(7):339-345.
[8] Dittmer A,Vetter M,Schunke D,et al.Parathyroid hormonerelated protein regulates tumor-relevant genes in breast cancer cells[J].J Biol Chem,2006,281(21):14563-14572.

