血管紧张素Ⅱ灌注在脂质肝损伤中的作用研究
吴娱,张洋,胡泽波,刘亮,王桂花,鲁荐,马坤岭
(东南大学附属中大医院 肾内科,江苏 南京 210009)
·论 著·
血管紧张素Ⅱ灌注在脂质肝损伤中的作用研究
吴娱,张洋,胡泽波,刘亮,王桂花,鲁荐,马坤岭
(东南大学附属中大医院 肾内科,江苏 南京 210009)
目的:通过制备血管紧张素Ⅱ(AngⅡ)灌注模型,观察AngⅡ在脂质肝损伤中的作用及其可能的机制。方法:将C57BL/6小鼠随机分为对照组、AngⅡ灌注组及AngⅡ灌注加AngⅡ 1型受体(AT1R)基因敲除组。采用HE、菲律宾、油红0染色以及胞内胆固醇定量测定法观察肝细胞内脂质沉积情况;免疫组化、蛋白质印迹法检测低密度脂蛋白受体(LDLR)、固醇调节元件结合蛋白2(SREBP-2)及其裂解激活蛋白(SCAP)表达水平。结果:AngⅡ刺激增加C57BL/6小鼠肝细胞内脂质沉积,且上调LDLR、SREBP-2和SCAP的表达。而AT1R基因敲除组C57BL/6小鼠肝细胞内脂质沉积明显减少,LDLR通路的相关蛋白表达也显著下调。结论:AngⅡ通过AT1R诱导LDLR负反馈调节失调,进而增加胆固醇内流、肝细胞内脂质过度沉积,介导脂质肝损伤的发生。
血管紧张素Ⅱ灌注; 低密度脂蛋白受体; 脂质肝损伤
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种以无过量饮酒史,肝实质细胞脂肪性变和脂肪贮积为特征的临床病理综合征。其病程包括单纯性脂肪肝、非酒精性脂肪性肝炎和脂肪性肝硬化,最终可能演变为肝硬化[1]和肝癌[2]。近年来,全世界NAFLD的患病率平均为20%[3],已成为危害人类健康的一种常见的慢性肝脏疾病。目前NAFLD的发病机制尚未明确。近来研究发现,应用血管紧张素Ⅱ受体拮抗剂(angiotensinⅡ receptor blocker,ARB)可延缓NAFLD的进展[4],如替米沙坦能够抑制肝内脂质沉积,且在正常饮食的小鼠模型中,替米沙坦也能减弱胰岛素的抵抗状态[5],从而改善肝脏的脂肪变性[6],提示肾素-血管紧张素系统(renin-angiotensin system,RAS)激活可能参与了脂质肝损伤的发生、发展。我们在既往的研究中已经证实,血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)可通过上调低密度脂蛋白受体(low density lipoprotein receptor,LDLR)的表达,导致细胞摄入胆固醇增加,造成人近端肾小管上皮细胞(human renal proximal tubular epithelial,HK-2)[7]以及系膜细胞[8]内脂质过度沉积,泡沫细胞形成。研究还发现RAS激活与脂代谢紊乱在疾病进展过程中存在交互作用[7]。本研究中,我们通过制备AngⅡ灌注模型,观察AngⅡ在脂质肝损伤中的作用及其可能的机制。
1 材料与方法
1.1 模型制备及分组
将24只8周龄的清洁级健康雄性C57BL/6小鼠喂以普通饮食,并随机均分为对照组、AngⅡ灌注组(AngⅡ皮下持续泵入)以及AngⅡ 1型受体(AT1R)基因敲除组(AngⅡ+AT1R-/-)。持续饲养4周后处死小鼠,并收集血液标本以及肝脏组织进行相关指标的检测。
1.2 试剂
AngⅡ、焦碳酸二乙酯(DEPC)、苏木素、胆固醇酶酯、胆固醇氧化酶、辣根过氧化物酶、4-氨基安替比林、苯酚、磷酸氢二甲缓冲液、胆酸钠、酒石酸钠、福林酚、1,2-丙二醇(美国Sigma),预染蛋白标记、十二烷基硫酸钠(南京生兴生物技术有限公司),菲律宾荧光染色试剂盒(上海杰美基因医药科技有限公司)、免疫组化试剂盒(福州迈新生物技术开发有限公司)、全蛋白提取试剂盒、蛋白测定试剂盒(南京鹭飞生物技术有限公司),ECL发光剂(英国GE),LDLR、固醇调节元件结合蛋白2(sterol regulatory element-binding protein,SREBP-2)、固醇调节元件结合蛋白裂解激活蛋白(sterol regulatory element-binding protein cleavage activating protein,SCAP)及β-actin抗体(美国Santa Cruz),辣根过氧化物酶标记的二抗(上海基因科技有限公司)。
1.3 实验方法
1.3.1肝脏病理学检查 肝脏组织经10%甲醛固定、石蜡包埋,切成3 μm薄片后行HE染色,光镜下观察肝脏组织病理学改变。
1.3.2菲律宾染色 将石蜡包埋后的蜡块切成3 μm薄片后,按菲律宾染色操作步骤说明书进行。
1.3.3胞内胆固醇定量测定 取大小约5 mm×5 mm的新鲜肝脏组织,加入1 ml氯仿与甲醇混合物(2∶1),采用超声波细胞仪破碎肝脏组织。收集上清液,真空干燥后用化学酶促法定量检测细胞总胆固醇(TC)、游离胆固醇(FC)的含量,胆固醇酯(CE)=TC-FC。向试管中沉淀部分加入1 mol·L-1氢氯化钠,孵育12 h后,用Folin-酚试剂法测定总蛋白含量,分别计算胆固醇与细胞内总蛋白的比值,分析其相对含量。
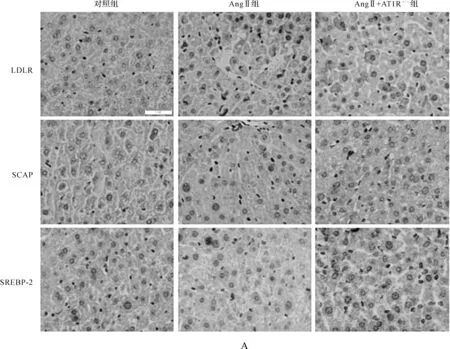
1.3.4免疫组化 石蜡切片脱蜡水化,微波修复抗原,采用SP法免疫组化试剂盒,检测指标包括LDLR、SCAP和SREBP-2(1∶100稀释),DAB显色2~5 min,显微镜下观察,控制着色时间,苏木素复染,所有操作按照说明书进行。
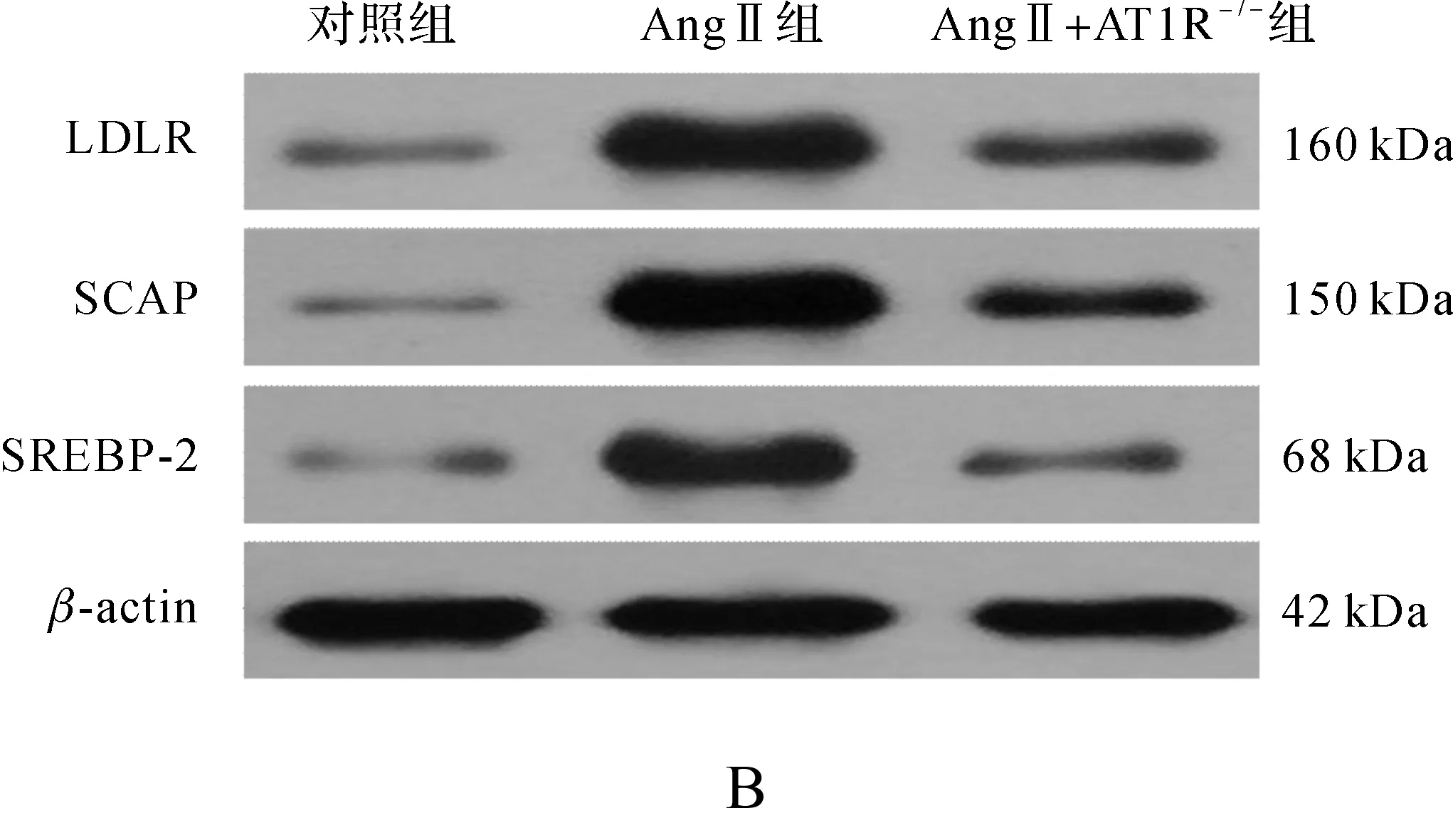
1.3.5蛋白质印迹 取液氮保存的肝组织,加适量裂解液后匀浆、离心,取上清液检测蛋白浓度。取等量组织蛋白样本变性后SDS-PAGE凝胶电泳,转入PVDF膜,5%脱脂牛奶室温封闭1 h,然后分别与特异性LDLR、SCAP和SREBP-2抗体(1∶200)4 ℃孵育过夜,TBST洗膜,再与辣根过氧化物酶标记的二抗室温下孵育1 h,洗膜,ECL化学发光法曝光。以β-肌动蛋白(1∶500)作为内参,测定蛋白相对表达水平。
1.4 统计学处理
计量资料数据以均数±标准误表示,多组间比较采用单因素方差分析。使用SPSS 16.0统计软件进行统计分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 AngⅡ促进肝细胞内脂质沉积
HE以及菲律宾染色结果显示,与对照组相比,AngⅡ组小鼠肝细胞内有泡沫细胞形成以及大量脂质沉积,但AT1R敲除的小鼠肝细胞中脂质明显减少,胆固醇定量测定结果与此一致,见图1、2。

图1 AngⅡ促进肝细胞内脂质沉积 A.HE染色×400; B.菲律宾染色×200
Fig 1 AngⅡ promotes lipid accumulation in hepatic cells
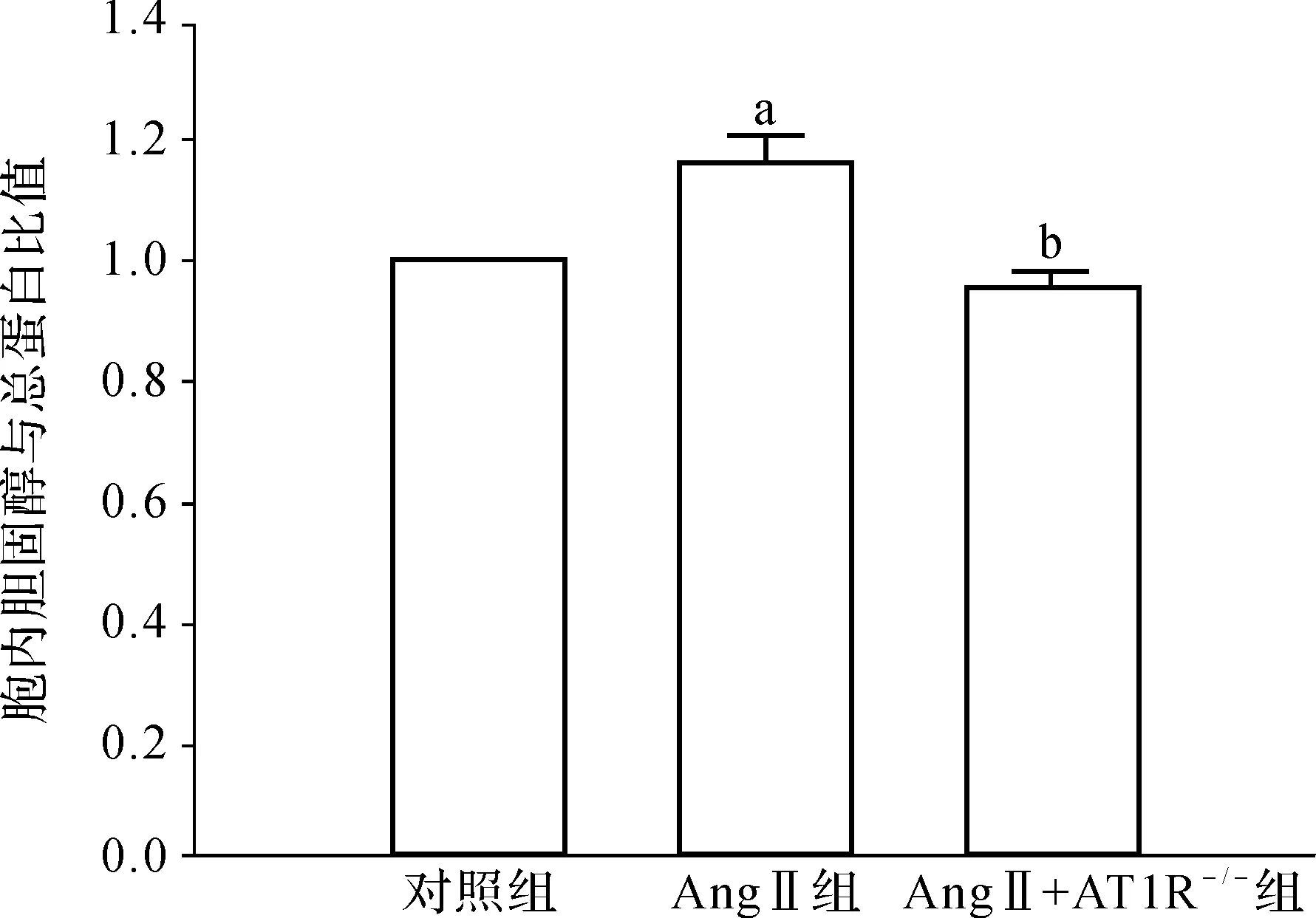
a 与对照组比较,P<0.05; b 与AngⅡ组比较,P<0.05
图2 胆固醇定量测定结果
Fig 2 The results of quantitative intracellular cholesterol analysis
2.2 AngⅡ诱导体内LDLR负反馈调节途径紊乱
免疫组化结果显示,LDLR、SCAP和SREBP-2在AngⅡ灌注组小鼠中表达明显增加,而AT1R敲除后的小鼠,其表达明显减少,蛋白质印迹结果也与此一致,见图3。
3 讨 论
早在2002年就有研究者发现,在正常肝细胞内可检测到AT1R[9],而有关RAS与肝脏疾病的研究也越来越多。RAS能促进肝脏炎症[4]、氧化应激[10]等反应,从而加速肝脏脂肪变性,最后导致NAFLD的发生。近年来研究发现,应用RAS阻断剂可促进小的、对胰岛素更敏感的脂肪细胞形成,从而改善脂肪代谢紊乱[11],但就RAS激活后对肝细胞内脂代谢紊乱的调节作用研究甚少。
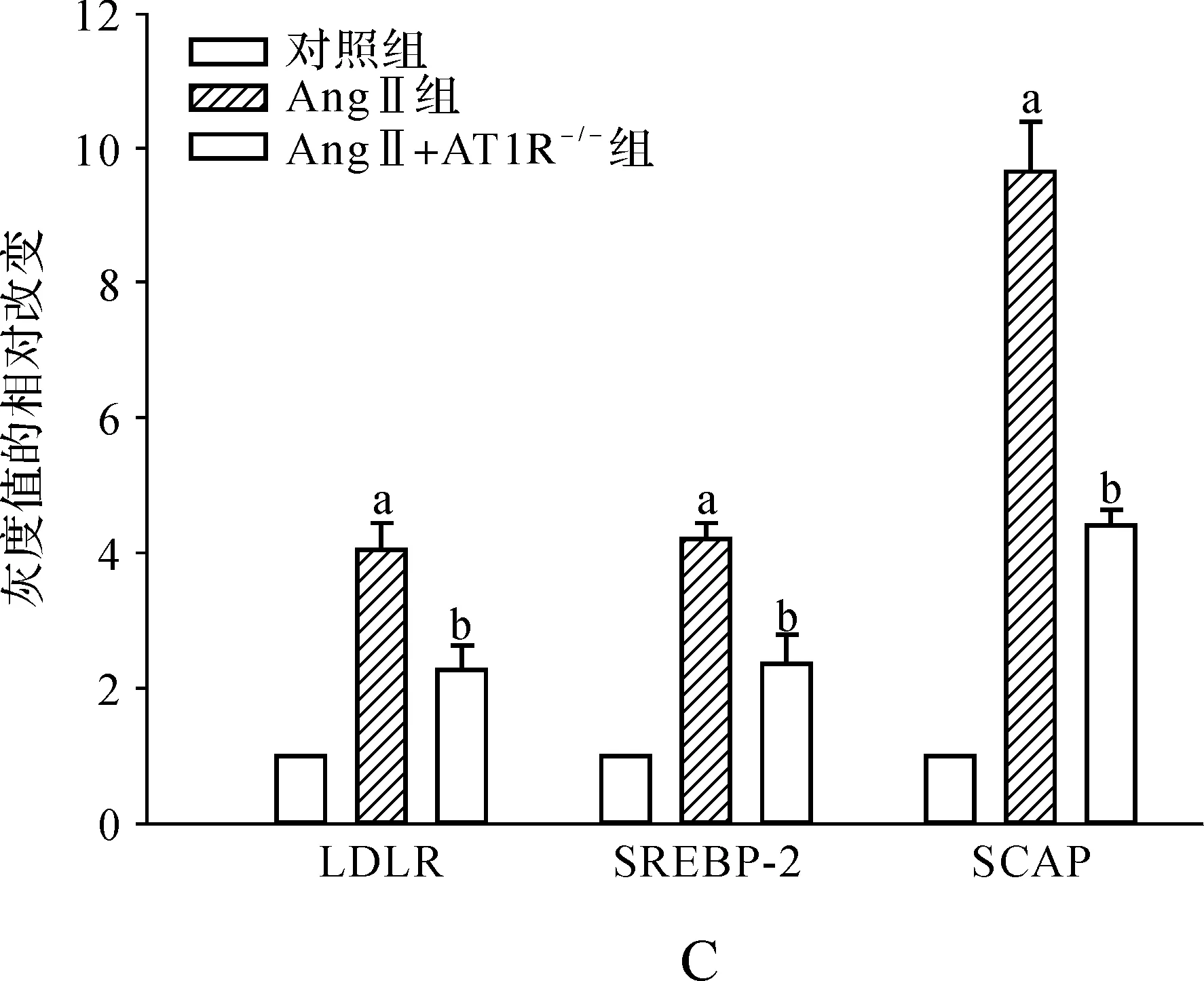
a 与对照组相比,P<0.05; b 与AngⅡ组相比,P<0.05
图3 AngⅡ诱导肝内LDLR负反馈调节途径紊乱 A.免疫组化×400; B、C.蛋白印迹法结果及灰度值定量
Fig 3 AngⅡ disrupts LDLR feedback regulation in the liver
在NAFLD的患者体内,维持肝细胞胆固醇稳态的多个环节遭到破坏,胆固醇内流增加、外流减少以及肠肝循环发生障碍,导致肝细胞内胆固醇沉积和脂肪肝的形成。而肝细胞内胆固醇代谢受多个核因子调节。SREBP-2是调节胆固醇代谢的主要核因子之一,在细胞内胆固醇缺乏时,SREBP-2被激活,从内质网转位到高尔基体,经蛋白酶水解,形成活性的SREBP-2,进入核内,进而上调LDLR等靶基因的转录,增加胆固醇的合成和摄取[12]。既往有研究发现,干扰RAS系统相关蛋白的表达会阻止由高脂饮食诱导的肥胖的发生[13],此外,将AT1R基因敲除也能减少肝脏发生脂肪变性[14]。我们的研究团队也发现,AngⅡ刺激HK-2细胞会通过破坏LDLR负反馈调节途径,诱导脂质的过度沉积[7]。本研究中,与对照组相比,AngⅡ灌注组的小鼠肝细胞内脂质沉积明显增加,同时LDLR、SCAP和SREBP-2的基因与蛋白水平都显著上调,但敲除AT1R基因后,脂质沉积明显减少,表明AngⅡ破坏了肝细胞内LDLR负反馈调节途径,增加胞内胆固醇的摄入。Lu等[15]研究发现,AngⅡ能增加LDL氧化,氧化型LDL被巨噬细胞摄取,从而促进动脉粥样硬化的形成。研究还发现应用RAS抑制剂能改善肾脏足细胞对脂的代谢,从而延缓肾小球疾病的发展[16-18]。我们首次证实了AngⅡ可通过破坏LDLR信号途径诱导肝细胞对胆固醇的过度摄取,且敲除AT1R基因后能明显抑制脂质对肝细胞的损伤。
综上所述,我们通过AngⅡ灌注模型研究证实,AngⅡ能上调LDLR的表达,从而导致肝细胞内摄取胆固醇增加,胞内脂质过度沉积,进一步通过敲除AngⅡ的作用受体AT1R基因,表明了RAS激活能通过促进肝细胞内脂代谢紊乱而加速脂质肝损伤。本研究为脂质肝损伤疾病如NAFLD的治疗提供了新的思路。
[1] CLARK J M,BRANCATI F L,DIEHL A M.Nonalcoholic fatty liver disease[J].Gastroenterology,2002,122(6):1649-1657.
[2] MONTO A.Hepatitis C and steatosis[J].Semin Gastrointest Dis,2002,13(1):40-46.
[3] VERNON G,BARANOVA A,YOUNOSSI Z M.Systematic review:the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults[J].Aliment Pharmacol Ther,2011,34(3):274-285.
[4] TOBLLI J E,MUNOZ M C,CAO G,et al.ACE inhibition and AT1 receptor blockade prevent fatty liver and fibrosis in obese Zucker rats[J].Obesity(Silver Spring),2008,16(4):770-776.
[5] RONG X,LI Y,EBIHARA K,et al.Angiotensin Ⅱ type 1 receptor-independent beneficial effects of telmisartan on dietary-induced obesity,insulin resistance and fatty liver in mice[J].Diabetologia,2010,53(8):1727-1731.
[6] MUNOZ M C,ARGENTINO D P,DOMINICI F P,et al.Irbesartan restores theinvivoinsulin signaling pathway leading to Akt activation in obese Zucker rats[J].J Hypertens,2006,24(8):1607-1617.
[7] 马坤岭,倪杰,王长娴,等.血管紧张素Ⅱ通过干扰低密度脂蛋白受体途径促进肾小管上皮细胞内脂质沉积[J].中华肾脏病杂志,2013,29(4):293-297.
[8] MA K L,NI J,WANG C X,et al.Interaction of RAS activation and lipid disorders accelerates the progression of glomerulosclerosis[J].Int J Med Sci,2013,10(12):1615-1624.
[9] PAIZIS G,COOPER M E,SCHEMBRI J M,et al.Up-regulation of components of the renin-angiotensin system in the bile duct-ligated rat liver[J].Gastroenterology,2002,123(5):1667-1676.
[10] WEI Y,CLARK S E,MORRIS E M,et al.Angiotensin Ⅱ-induced non-alcoholic fatty liver disease is mediated by oxidative stress in transgenic TG(mRen2)27(Ren2) rats[J].J Hepatol,2008,49(3):417-428.
[11] STRAZZULLO P,GALLETTI F.Impact of the renin-angiotensin system on lipid and carbohydrate metabolism[J].Curr Opin Nephrol Hypertens,2004,13(3):325-332.
[12] 吴娱,马坤岭.细胞胆固醇稳态失衡在非酒精性脂肪性肝病中的作用研究进展[J].东南大学学报:医学版,2014,33(6):778-782.
[13] YVAN-CHARVET L,QUIGNARD-BOULANGE A.Role of adipose tissue renin-angiotensin system in metabolic and inflammatory diseases associated with obesity[J].Kidney Int,2011,79(2):162-168.
[14] NABESHIMA Y,TAZUMA S,KANNO K,et al.Deletion of angiotensin Ⅱ type Ⅰ receptor reduces hepatic steatosis[J].J Hepatol,2009,50(6):1226-1235.
[15] LU J,MEHTA J L.LOX-1:a critical player in the genesis and progression of myocardial ischemia[J].Cardiovasc Drugs Ther,2011,25(5):431-440.
[16] GURLEY S B,COFFMAN T M.The renin-angiotensin system and diabetic nephropathy[J].Semin Nephrol,2007,27(2):144-152.
[17] REISER J,MUNDEL P.Dual effects of RAS blockade on blood pressure and podocyte function[J].Curr Hypertens Rep,2007,9(5):403-408.
[18] KALAITZIDIS R,BAKRIS G L.Effects of angiotensin Ⅱ receptor blockers on diabetic nephropathy[J].J Hypertens Suppl,2009,27(5):S15-S21.
The role of angiotensinⅡ perfusion in fatty liver injury
WU Yu,ZHANG Yang,HU Ze-bo,LIU Liang,WANG Gui-hua,LU Jian,MA Kun-ling
(DepartmentofNephrology,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
Objective: To investigate the possible effects of angiotensinⅡ(AngⅡ) on fatty liver injury and its possible mechanism via the construction of AngⅡ perfusion model. Methods: C57BL/6 mice were randomly divided into three groups: the control group, the AngⅡ group and the AngⅡ with angiotensinⅡ type 1 receptor(AT1R) gene knockout group. Lipid accumulation was examined with haematoxylin-eosin(HE) staining, Oil red O staining, Filipin staining, and a quantitative assay of intracellular cholesterol. The protein expressions of low-density lipoprotein receptor(LDLR), sterol regulatory element-binding protein 2(SREBP-2) and its cleavage activating protein(SCAP) were determined by immunochemical staining and Western blotting. Results: AngⅡ stimulation increased lipid deposition in livers of C57BL/6 mice, which was associated with increased protein expression of LDLR,SCAP, and SREBP-2. However, lipid accumulation in hepatic cells of AT1R gene knockout C57BL/6 mice dropped; moreover, the expression of LDLR pathway related protein significantly dropped. Conclusion: AngⅡ disrupts LDLR feed-back regulation via its receptor AT1R to increase cholesterol uptake and induce intracellular lipid accumulation, contributing to the development of liver injury.
angiotensinⅡ perfusion; low density lipoprotein receptor; fatty liver injury
2015-03-23
2015-05-04
国家自然科学基金资助项目(81470957,81170792);江苏省自然科学基金资助项目(BK20141343)
吴娱(1988-),女,江苏江阴人,在读硕士研究生。E-mail:wu_yu_126@126.com
马坤岭 E-mail:klma05@163.com
吴娱,张洋,胡泽波,等.血管紧张素Ⅱ灌注在脂质肝损伤中的作用研究[J].东南大学学报:医学版,2015,34(5):740-744.
R575.5
A
1671-6264(2015)05-0740-05
10.3969/j.issn.1671-6264.2015.05.012

