小鼠骨髓来源肥大细胞的诱导培养及功能鉴定
石任任,王珊,何颖,邹泽红,张可俊,李林梅,肖春梅,关志澳,陶爱林
(广州医科大学附属第二医院/呼吸疾病国家重点实验室变态反应研究室/变态反应国家临床重点专科/广东省过敏反应与免疫重点实验室,广东 广州 510260)
·论 著·
小鼠骨髓来源肥大细胞的诱导培养及功能鉴定
石任任,王珊,何颖,邹泽红,张可俊,李林梅,肖春梅,关志澳,陶爱林
(广州医科大学附属第二医院/呼吸疾病国家重点实验室变态反应研究室/变态反应国家临床重点专科/广东省过敏反应与免疫重点实验室,广东 广州 510260)
目的:探讨体外诱导培养小鼠骨髓细胞来源肥大细胞的方法,为体外组胺激发试验提供试材。方法:采用白细胞介素3(IL-3)和干细胞因子(SCF)联合刺激小鼠骨髓细胞4、6周诱导其分化为肥大细胞,光镜下观察细胞形态,甲苯胺蓝染色观察细胞成熟度,蛋白免疫印迹法分析表面FcεRⅠ和CD117表达情况,HistaReader 501组胺仪检测细胞脱颗粒能力。结果:诱导培养4、6周后的细胞为大小均一且具折光性的圆形悬浮细胞;甲苯胺蓝染色显示培养4、6周后的细胞胞核染为蓝色,胞质含有丰富的粗大紫红色颗粒,镜下统计成熟肥大细胞比例达85%以上;蛋白免疫印迹法分析发现培养4、6周后的细胞皆表达FcεRⅠ和CD117,其中培养6周的细胞FcεRⅠ表达水平更高;组胺仪检测培养6周的细胞发现,经浓度为100、500、1 000 μmol·L-1的钙离子载体刺激后,与阴性对照组相比,细胞组胺释放量依次为3.86%、17.04%及23.47%(P<0.05),其脱颗粒具有钙离子载体浓度依赖性。结论:获得大量高纯度的小鼠骨髓来源肥大细胞,可促进后期的组胺激发试验及Ⅰ型变态反应机制研究。
肥大细胞; 骨髓; 组胺检测; 诱导培养; 小鼠
Ⅰ型变态反应如过敏性鼻炎、过敏性哮喘、荨麻疹、过敏性胃肠炎、过敏性休克等严重影响人们的健康与生活质量。大部分Ⅰ型变态反应都是由患者体内肥大细胞系统被激活而诱发的,故此,肥大细胞是参与Ⅰ型变态反应的重要效应细胞[1]。目前认为,肥大细胞驱动的Ⅰ型变态反应主要通过表达IgE高亲和力FcεRⅠ受体,与过敏原特异性IgE抗体结合形成IgE/FcεRⅠ复合物,大量IgE/FcεRⅠ复合物交联聚集,活化肥大细胞导致多种炎症介质和细胞因子的释放,从而引起Ⅰ型变态反应[2]。肥大细胞是Ⅰ型变态反应的初级效应细胞,其激活直接影响次级效应细胞嗜酸粒细胞和中性粒细胞的募集和激活,尽管目前存在可以传代的肥大细胞株,然而这些细胞系常缺乏显著的成熟肥大细胞特性和功能[3],因此体外诱导培养获取大量高纯度的肥大细胞对我们进一步研究其在Ⅰ型变态反应疾病进程中的作用有重要意义。
肥大细胞由骨髓中表达CD34和CD13抗原的多能祖细胞分化而成,广泛分布于皮肤及内脏黏膜下的微血管周围,与巨噬细胞、树突状细胞、自然杀伤细胞等共同构成机体的第一道防线。白细胞介素3(IL-3)和干细胞因子(SCF)在骨髓细胞向肥大细胞的分化与活化过程中起着重要作用[4-5]。本研究旨在通过提取小鼠骨髓细胞,利用IL-3和SCF联合作用诱导培养骨髓来源肥大细胞(BMMCs)并鉴定其纯度与活性,为进一步研究肥大细胞激活与Ⅰ型变态反应疾病发生发展的关联性及制定完善的Ⅰ型变态反应疾病诊治方案提供实验参考数据。
1 材料与方法
1.1 实验动物
雌性BALB/c小鼠,6~8周龄,清洁级,购自广东省医学动物实验中心。
1.2 主要试剂
RPMI 1640培养基及胎牛血清购自Gibco公司;小鼠重组IL-3、SCF购自Peprotech公司;小鼠FcεRⅠ、CD117及Tubulin抗体、辣根过氧化物酶标记山羊抗小鼠IgG抗体购自Abcam公司;HR-Test组胺检测试剂盒购自Biopharm公司。其他实验试剂均为分析纯。
1.3 小鼠骨髓来源肥大细胞的制备与培养
无菌环境下钝性分离小鼠双侧股骨,剪断股骨两端骨骺,用1 ml注射器吸取适量RPMI 1640培养基将骨髓腔内的骨髓细胞冲至无菌培养板中,收集液体至15 ml离心管中,1 500 r·min-1离心5 min,弃去上清,用含IL-3(10 ng·ml-1)、SCF(10 ng·ml-1)和体积分数10%胎牛血清的RPMI 1640 培养基重悬细胞并将细胞转移至培养瓶中,置于37 ℃、体积分数5%CO2饱和湿度培养箱中培养;每7 d收集悬浮的细胞并转移至新的培养体系中继续培养,在培养4周和6周后分别收集细胞,对其形态及功能进行鉴定。
1.4 小鼠骨髓来源肥大细胞甲苯胺蓝染色
分别收集培养4、6周的悬浮细胞,将细胞甩片后用1% pH 7.4的甲苯胺蓝染液染约30 s,体积分数95%的酒精分色,双蒸水洗涤,光镜下观察。
1.5 蛋白免疫印迹法分析小鼠骨髓来源肥大细胞FcεRⅠ及CD117表面分子表达
收集诱导培养4、6周的悬浮细胞,加入适量RIPA裂解液裂解细胞,提取蛋白,BCA蛋白定量后进行SDS-PAGE凝胶电泳,将SDS-PAGE凝胶中的蛋白质转移到PVDF膜上,0.1% PBST清洗4次,5%脱脂牛奶室温封闭2 h;0.1% PBST清洗2次,分别滴加稀释后的一抗(FcεRⅠ、CD117、Tubulin)4 ℃孵育过夜;0.1% PBST清洗4次,滴加稀释后的辣根过氧化物酶标记的山羊抗小鼠IgG抗体(二抗),室温孵育1 h;0.1% PBST清洗2次,PBS清洗2次后滴加化学发光剂曝光。
1.6 小鼠骨髓来源肥大细胞脱颗粒能力检测
按照HR-Test组胺检测试剂盒说明书,使用配套试剂进行实验。具体步骤为:在玻璃纤维板上分别加入25 μl·孔-1的pipes缓冲液、0.5% Triton X-100及不同浓度(100、500、1000 μmol·L-1)的钙离子载体,再加入25 μl(约3000个细胞)诱导培养的小鼠骨髓来源肥大细胞,混匀后37 ℃孵育1 h;双蒸水清洗5次,加入结合缓冲液75 μl·孔-1,室温孵育10 min;加入终止缓冲液75 μl·孔-1终止反应,利用HistaReader 501组胺仪检测肥大细胞组胺释放量。经0.5% Triton X-100处理的肥大细胞组胺释放量设定为组胺最大释放量;经pipes缓冲液处理的肥大细胞组胺释放量设定为组胺基础释放量。肥大细胞组胺释放量(%)=(待测肥大细胞组胺释放量-组胺基础释放量)/(组胺最大释放量-组胺基础释放量)×100%。
1.7 统计学处理
采用SPSS 18.0软件按以下方法对所得数据进行统计分析:实验组与空白组之间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠骨髓来源肥大细胞形态学观察
加入细胞因子IL-3、SCF培养72 h后开始出现贴壁细胞,多为长梭形,并可见大小不一的悬浮细胞(图1A);培养7 d后贴壁细胞逐渐减少,圆形悬浮细胞逐渐增多(图1B);培养4~6周,悬浮细胞大小、形状、分布逐渐均匀且具有折光性(图1C、D)。
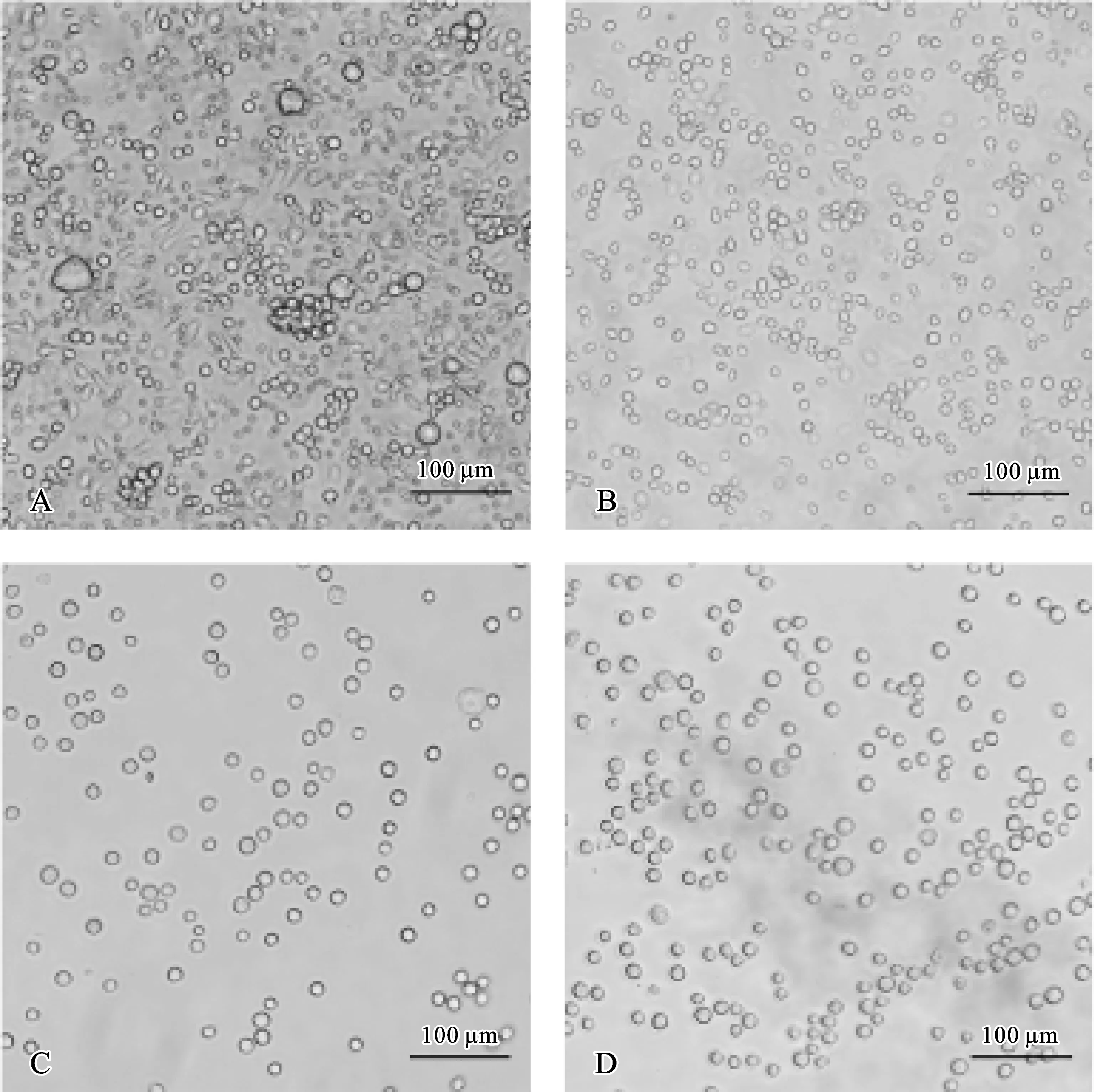
图1 光镜下观察不同诱导时期的细胞形态(×200) A.细胞诱导培养3 d; B.细胞诱导培养7 d; C.细胞诱导培养4周; D.细胞诱导培养6周
Fig 1 Morphology of cells under light microscope in different induced culturing periods(×200)A.Cells after 3 days’ induced culturing; B.Cells after 7 days’ induced culturing; C.Cells after 4 weeks’ induced culturing; D.Cells after 6 weeks’ induced culturing
2.2 小鼠骨髓来源肥大细胞甲苯胺蓝染色
诱导培养4、6周后收集悬浮细胞进行甲苯胺蓝染色,可见细胞胞核为蓝色,大部分胞质含有丰富的紫红色异染颗粒(图2),表明所收集的细胞确有吞噬甲苯胺蓝的特性,镜下统计超过85%的悬浮细胞为成熟肥大细胞。

图2 甲苯胺蓝染色不同诱导时期的细胞(×1 000) A.未诱导培养细胞; B.细胞诱导培养4周; C.细胞诱导培养6周
Fig 2 Toluidine blue staining of cells in defferent induced culturing periods(×1 000)A.Cells without induced culturing; B.Cells after 4 weeks’ induced culturing; C.Cells after 6 weeks’ induced culturing
2.3 蛋白免疫印迹法分析小鼠骨髓来源肥大细胞FcεRⅠ及CD117分子表达
分别用细胞因子IL-3、SCF诱导培养4、6周后收集悬浮细胞,采用蛋白免疫印迹法分析所诱导培养的肥大细胞表面FcεRⅠ及CD117表达情况。诱导培养4、6周后,相对于未诱导的骨髓细胞,小鼠骨髓来源肥大细胞表面FcεRⅠ及CD117分子表达量明显增多;另外与诱导培养4周的细胞相比,诱导培养6周的小鼠骨髓来源肥大细胞表面FcεRⅠ的表达水平更高(图3),表明诱导培养6周的小鼠来源肥大细胞成熟度更佳。
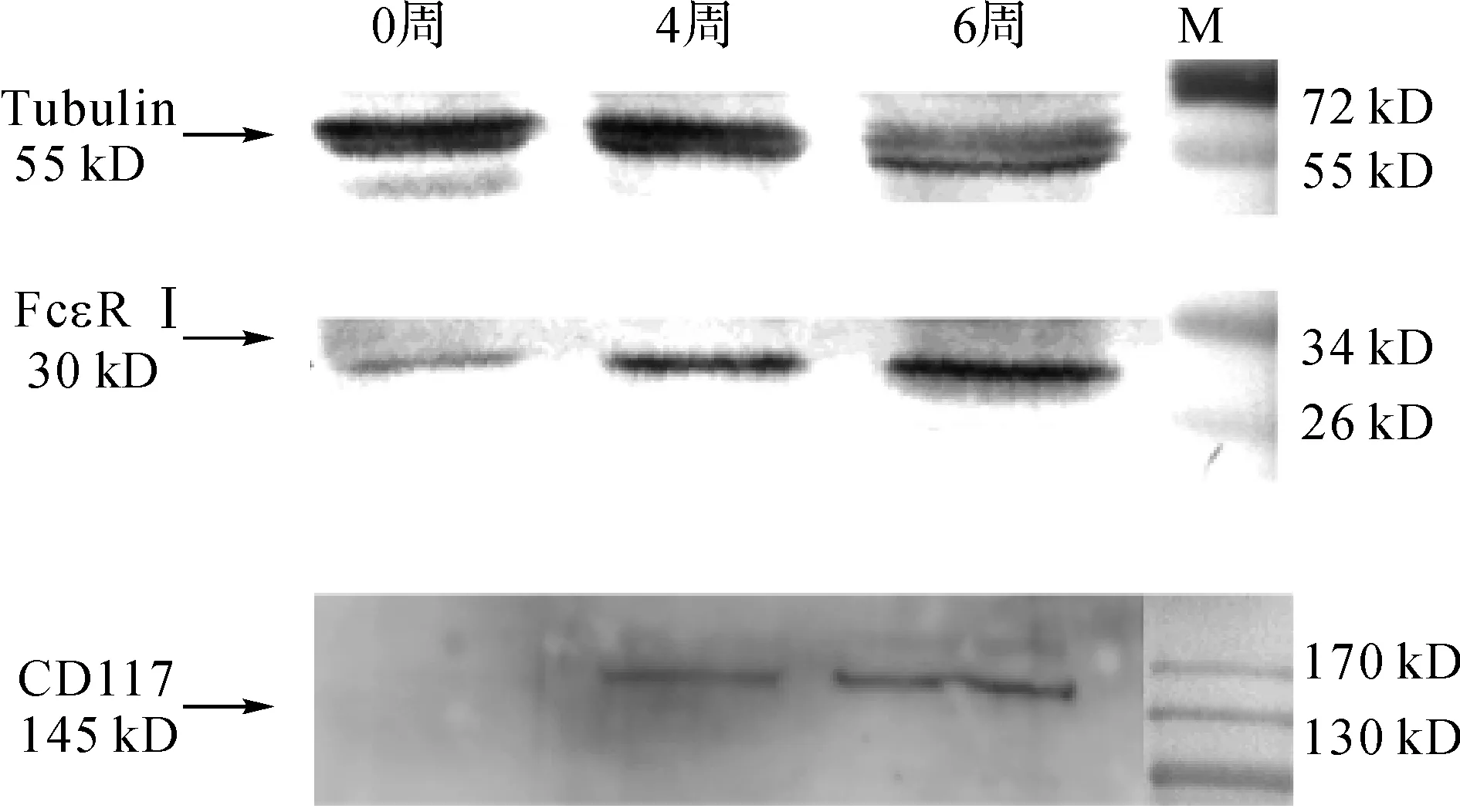
图3 蛋白免疫印迹法分析不同诱导时期的细胞表面FcεRⅠ及CD117分子表达
Fig 3 Western blotting analysis of FcεRⅠand CD117 expression of cells in defferent induced culturing periods
2.4 小鼠骨髓来源肥大细胞脱颗粒能力检测
收集诱导培养6周的小鼠骨髓来源肥大细胞,分别与pipes缓冲液、0.5% Triton X-100及不同浓度的钙离子载体孵育1 h后,检测肥大细胞组胺释放量。结果显示,经浓度为100、500、1 000 μmol·L-1的钙离子载体孵育后,与对照组相比,小鼠骨髓来源肥大细胞组胺释放量依次为3.86%、17.04%及23.47%(P<0.05)(图4),表明所诱导培养的小鼠骨髓来源肥大细胞能被钙离子载体活化脱颗粒释放组胺,且具有浓度依赖性,具备良好的成熟肥大细胞活性。
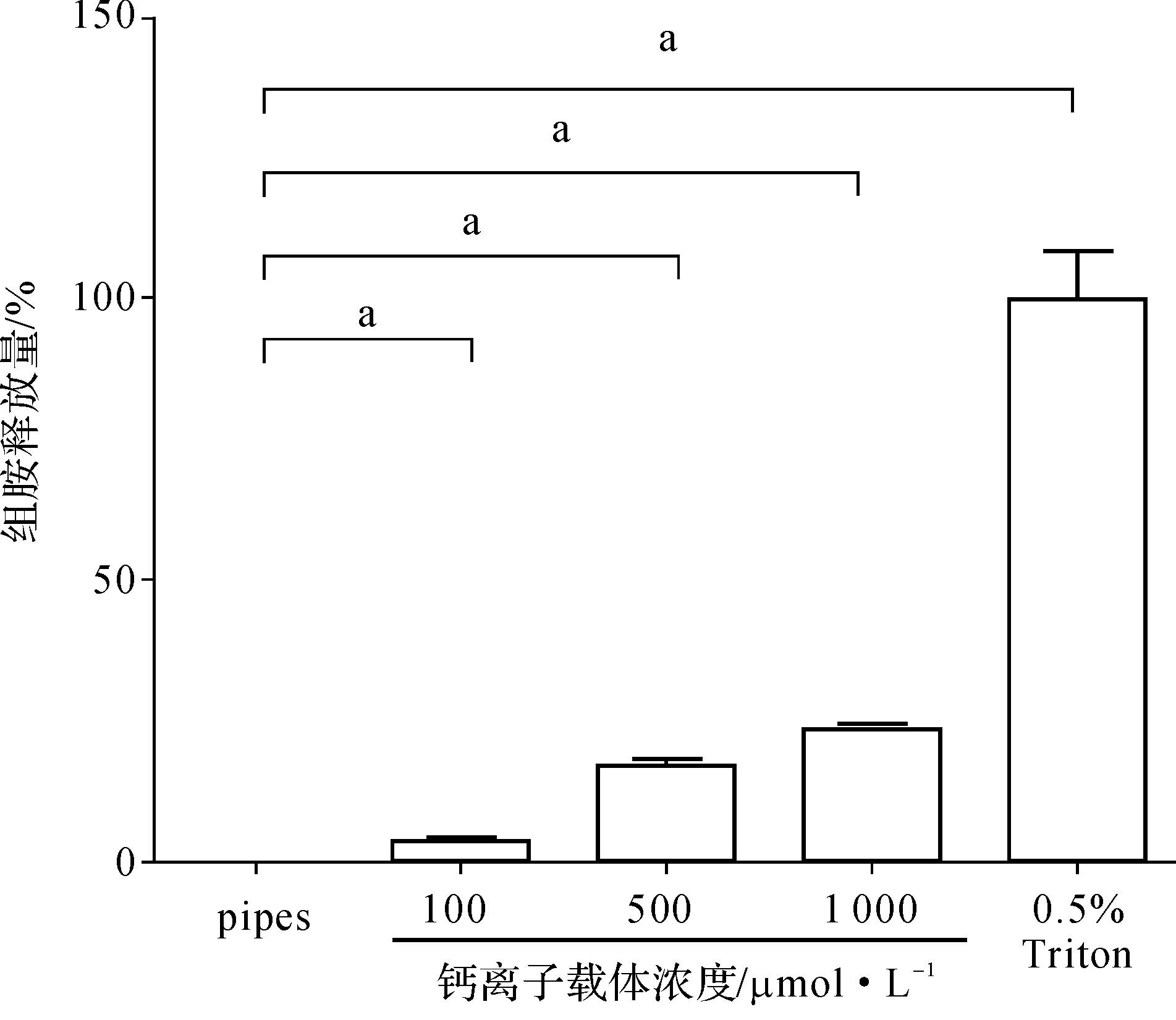
aP<0.05
图4 小鼠骨髓来源肥大细胞组胺释放
Fig 4 Histamine release of BMMCs
3 讨 论
IL-3又称为多重集落刺激因子和造血细胞生长因子,能刺激多能干细胞和多种祖细胞的增殖与分化;SCF可增强肥大细胞的增殖、存活、分化和趋化的能力,在肥大细胞的发育和存活中起关键作用[6]。肥大细胞在IgE介导的Ⅰ型变态反应中有着至关重要的作用,而肥大细胞的细胞表面需要表达FcεRⅠ才能识别特异性IgE,进而参与Ⅰ型变态反应[7];CD117(c-Kit)为干细胞因子受体,是另一种影响肥大细胞功能的重要受体,调控肥大细胞的生长发育,并可增强FcεRⅠ交联引起肥大细胞脱颗粒的能力[8],故可通过检测肥大细胞表面FcεRⅠ和CD117的表达来对所诱导培养的小鼠骨髓来源肥大细胞进行鉴定[9]。本研究采用IL-3和SCF联合刺激小鼠骨髓细胞4~6周,诱导培养4周后即可见大量大小均一、分布均匀且具有折光性的圆形悬浮细胞,而诱导培养6周的细胞,其细胞形态上与诱导培养4周的细胞类似。甲苯胺蓝染色显示诱导培养4、6周后,大部分的细胞内皆可见粗大的、紫红色异染性的颗粒,镜下统计成熟肥大细胞比例占到85%以上;同时蛋白免疫印迹法分析显示,诱导培养4、6周的肥大细胞明显表达FcεRⅠ和CD117分子,且诱导培养6周的肥大细胞FcεRⅠ表达水平更高,成熟度更佳。故相比于较为传统的腹腔冲洗液分离肥大细胞或磁珠分离肥大细胞获取细胞数量有限、成本高[10],本研究采用的骨髓细胞诱导培养肥大细胞的方法更为经济、便捷,同时保证了获取的肥大细胞的数量、纯度和成熟度。
组胺是肥大细胞内组氨酸脱羧基后产生的一种胺类物质,是肥大细胞脱颗粒的标志物质,故检测肥大细胞释放组胺的量,可以了解肥大细胞活化脱颗粒情况。在肥大细胞的脱颗粒机制中,Ca+/Ca M蛋白激酶系统是经典的细胞内信息传递系统,Ca+内流使细胞内Ca+浓度升高,从而导致组胺释放增加[11]。本研究将诱导培养的肥大细胞与不同浓度的Ca+载体共孵育,激活Ca+/Ca M蛋白激酶系统导致肥大细胞释放组胺,通过HistaReader 501组胺仪直接检测肥大细胞组胺的释放量。结果显示,与对照组相比,与钙离子载体孵育后,诱导的肥大细胞皆可释放组胺且组胺释放量与钙离子载体浓度成正比,表明本研究中诱导培养的小鼠骨髓来源肥大细胞具有良好的活性。另外,组胺半衰期短,容易降解,故能否及时而准确地检测组胺是影响Ⅰ型变态反应诊治的不可忽视的因素。本研究使用HistaReader 501组胺仪直接检测肥大细胞组胺释放情况,敏感性较好且步骤简单、用时短,具有良好的使用前景,为更好地利用组胺激发试验,研究肥大细胞在Ⅰ型变态反应中的作用提供参考。
[1] GUILLEN D,FIANDOR-ROMAN A,CABALLERO T,et al.Urticaria caused by ingestion of pasta and bread containing buckwheat flour[J].J Investig Allergol Clin Immunol,2013,23(3):206-207.
[2] HONG G U,LIM J Y,KIM N G,et al.IgE and IgA produced by OX40-OX40L or CD40-CD40L interaction in B cells-mast cells re-activate FcepsilonRI or FcalphaRI on mast cells in mouse allergic asthma[J].Eur J Pharmacol,2015,754:199-210.
[3] 李洪涛.铜绿假单胞菌Quorum Sensing信号分子N-(3-oxododecanoyl)homoserine lactone对肥大细胞作用研究[D].武汉:华中科技大学,2009.
[4] OLIVEIRA S H,LUKACS N W.Stem cell factor:a hemopoietic cytokine with important targets in asthma[J].Curr Drug Targets Inflamm Allergy,2003,2(4):313-318.
[5] IRSNI A M,NILSSON G,MIETTINEN U,et al.Recombinant human stem cell factor stimulates differentiation of mast cells from dispersed human fetal liver cells[J].Blood,1992,80(12):3009-3021.
[6] HAIG D M,HUNTLEY J F,MACKELLAR A,et al.Effects of stem cell factor (kit-ligand) and interleukin-3 on the growth and serine proteinase expression of rat bone-marrow-derived or serosal mast cells[J].Blood,1994,83(1):72-83.
[7] EL-AGAMY D S.Targeting c-kit in the therapy of mast cell disorders:current update[J].Eur J Pharmacol,2012,690(1-3):1-3.
[8] GILFILLAN A M,BEAVEN M A.Regulation of mast cell responses in health and disease[J].Crit Rev Immunol,2011,31(6):475-529.
[9] DEPINAY N,HACINI F,BEGHDADI W,et al.Mast cell-dependent down-regulation of antigen-specific immune responses by mosquito bites[J].J Immunol,2006,176(7):4141-4146.
[10] SORURI A,GRIGAT J,KIAFARD Z,et al.Mast cell activation is characterized by upregulation of a functional anaphylatoxin C5a receptor[J].BMC Immunol,2008,9:29.
[11] LAW M,MORALES J L,MOTTRAM L F,et al.Structural requirements for the inhibition of calcium mobilization and mast cell activation by the pyrazole derivative BTP2[J].Int Biochem Cell Biol,2011,43(8):1228-1239.
Induced culture and functional identification of mouse bone marrow-derived mast cell
SHI Ren-ren,WANG Shan,HE Ying,ZOU Ze-hong,ZHANG Ke-jun,LI Lin-mei,XIAO Chun-mei,GUAN Zhi-ao,TAO Ai-lin
(GuangdongProvincialKeyLaboratoryofAllergy&ClinicalImmunology,TheStateKeyClinicalSpecialtyinAllergy,TheStateKeyLaboratoryofRespiratoryDisease,TheSecondAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou510260,China)
Objective: To investigate induced culture methods of bone marrow-derived mast cells(BMMCs) to provide materials for allergen challenge assay. Methods: BMMCs were differentiated from bone marrow cells cultured for 4 to 6 weeks with interleukin-3(IL-3) and stem cell factor (SCF) supplemented. The cell features were characterized by light microscopy and toluidine blue staining. The maturity of the cells was investigated by analyzing the membrane markers FcεRⅠand CD117 by Western blotting, and potency of BMMCs was calculated through histamine release assay by HistaReader 501 instrument. Results: The induced BMMCs, all in uniformed size with refraction, were observed to be filled with typical purple granules. The mature mast cells accounted for more than 85% of all cells. FcεRⅠand CD117 were positively expressed in BMMCs and FcεRⅠwere more expressive after 6 weeks of culture. The rate of histamine release by BMMCs cultured for 6 weeks were 3.86%, 17.04% and 23.47% (P<0.05) after stimulated with calcium ionophore at concentrations of 100, 500 and 1 000 μmol·L-1, compared to control group. Conclusion: A large amount of highly purified BMMCs have been obtained, which will facilitate the subsequent allergen challenge assay and mechanism research on typeⅠallergy.
mast cell; bone marrow; histamine detection; induced culture; mice
2015-05-15
2015-05-25
国家科技重大专项重点项目(2014ZX08011-005B);国家自然科学基金资助项目(81373128);国家临床重点专科建设项目(520102)
石任任(1987-),女,广东佛山人,在读硕士研究生。E-mail:doreen87@163.com
陶爱林 E-mail:aerobiologiatao@163.com
石任任,王珊,何颖,等.小鼠骨髓来源肥大细胞的诱导培养及功能鉴定[J].东南大学学报:医学版,2015,34(5):684-688.
Q813.11
A
1671-6264(2015)05-0684-05
10.3969/j.issn.1671-6264.2015.05.002

