DHA逆转卵巢癌细胞A2780/T紫杉醇耐药的机制研究
吴翌楠,王苏立,王迎春,赵丽君,卢锦,王金华,2
(1.南京医科大学附属江苏省肿瘤医院 妇瘤科,江苏 南京 210009; 2.解放军南京军区总医院 普外科,江苏 南京 210002)
·论 著·
DHA逆转卵巢癌细胞A2780/T紫杉醇耐药的机制研究
吴翌楠1,王苏立1,王迎春1,赵丽君1,卢锦1,王金华1,2
(1.南京医科大学附属江苏省肿瘤医院 妇瘤科,江苏 南京 210009; 2.解放军南京军区总医院 普外科,江苏 南京 210002)
目的:探讨二十二碳六烯酸(DHA)对卵巢癌耐药细胞的耐药逆转作用及其机制。方法:利用MTT评估细胞对紫杉醇耐药性的改变,罗单明实验验证细胞的药物外排能力,流式细胞仪检测细胞周期的分布,实时定量PCR及蛋白质印迹检测多药耐药蛋白1(MDR1)的mRNA水平、耐药相关蛋白及通路蛋白的蛋白水平。结果:DHA作用48 h后A2780/T对紫杉醇的半数抑制率(IC50)下降(P<0.05),且罗丹明在胞内的含量增加,呈剂量依赖性(P<0.05)。同时紫杉醇与DHA联合使用可以改变细胞周期的分布,GO/G1期的细胞百分比上升(P<0.05),P-糖蛋白(P-gp)及其他MDR相关蛋白的表达下降,NF-κB及磷酸化p38 MAPK表达下降,而p38 MAPK未见明显变化。结论:DHA可以通过改变细胞周期分布,抑制P-gp及MDR相关蛋白的功能和表达,逆转卵巢癌耐药细胞的耐药性,同时该机制还可能与抑制NF-κB通路、抑制p38 MAPK的磷酸化有关。
二十二碳六烯酸; 卵巢癌; 紫杉醇耐药; P-糖蛋白; 核转录因子-κB信号通路; p38 促分裂素源活化蛋白激酶
卵巢癌是妇科最常见的恶性肿瘤之一,死亡率居首位。由于卵巢解剖位置隐匿,早期症状不明显,70%的卵巢癌患者发病时已属晚期。卵巢癌传统的治疗方法主要是手术及化疗,但晚期患者往往不适合直接手术治疗,常以化疗为主[1]。在众多化疗药物中,紫杉醇因其对顺铂耐药及多数未控的卵巢癌效果显著而成为一线化疗药物之一;然而紫杉醇的广泛应用又导致了其耐药的出现,约85%的患者最终出现了肿瘤复发、转移以致治疗失败[2]。因此紫杉醇耐药成为了临床医师治疗卵巢癌过程中的最大障碍。流行病学及临床学研究均表明,二十二碳六烯酸(DHA)可以增加肿瘤细胞对化疗药物的敏感性[3]。这也意味着,DHA可以与化疗药协同作用,逆转细胞的耐药性,增加化疗药物对肿瘤细胞的杀伤力。然而目前DHA在卵巢癌中的耐药逆转作用几乎没有报道。本研究旨在通过比较DHA作用前后卵巢癌耐药细胞A2780/T在RNA水平及蛋白水平等多方面的变化,探讨DHA对卵巢癌紫杉醇耐药细胞A2780/T的耐药逆转作用。
1 材料与方法
1.1 材料与试剂
紫杉醇(太极制药有限公司),罗丹明(Rh123)、DHA(Sigma公司),P-gp抗体(Abcam 生物技术公司),抗β-肌动蛋白、人磷酸甘油酸脱氢酶(GADPH)、多重耐药相关蛋白1/2(multidrug resistance-related protein 1/2,MRP 1/2)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)、肺癌耐药相关蛋白(lung resistance-related protein,LRP)、HRP标记的二抗(horseradish peroxidase-linked)(南京Enogene生物技术有限公司),抗p38促分裂素源活化蛋白激酶(p38 MAPK)、磷酸化p38 MAPK(pp38 MAPK)、核转录因子-κB(NF-κB,cell signal technology)、细胞凋亡试剂盒和细胞周期试剂盒(BIO-BOX生物技术公司),RIPA裂解液、BCA试剂盒和Trizol试剂RNA提取试剂盒(Beyotime生物技术研究所),Taq DNA聚合酶、dNTPs和逆转录聚合酶链反应(polymerase chain reaction,PCR)试剂盒(TaKaRa公司)。
1.2 方法
1.2.1细胞培养
1.2.1.1培养条件 A2780细胞培养于RPMI 1640完全培养基(含体积分数10%胎牛血清和体积分数1%双抗)。A2780/T细胞在含有Taxol的完全培养基中。细胞培养在37 ℃、含体积分数5% CO2的细胞培养箱中培养。
1.2.1.2细胞株 人卵巢癌细胞株A2780由Enogene生物技术有限公司赠送,在前期实验中实验组成员成功诱导出了稳定的紫杉醇耐药株A2780/Taxol(A2780/T)。
1.2.2MTT检测细胞增殖抑制实验
将1×105个对数生长期细胞接种于96孔板中,每株细胞设立3个复孔,只加培养基不加细胞为空白对照孔。24 h后弃掉培养基,加入不同浓度的药物,共10个梯度。于37 ℃、体积分数5% CO2的饱和湿度孵箱内培养72 h后弃上清,每孔加入MTT 15 μl(5 mg·ml-1)及无血清DMEM 200 μl继续培养4 h,取出后2 000 r·min-1离心10 min,弃上清,每孔加200 μl DMSO振荡10 min,用酶标分析仪在570 nm波长处测定各孔吸光值(A值)。实验重复3次,取平均值。以药物浓度为横坐标,以A值为纵坐标绘制细胞增殖抑制曲线。相同条件下实验重复3次。根据细胞生长的抑制率,计算半数抑制率(IC50)。逆转倍数=对照组IC50/实验组IC50(对照组细胞为A2780/T,实验组细胞为DHA预处理后的A2780/T)。
1.2.3Rh123实验
将5×105个对数生长期细胞接种于6孔板中培养过夜。A2780/T细胞中加入3 μmol·L-1Taxol和不同浓度的DHA,于37 ℃、体积分数5% CO2的培养箱内培养48 h,后直接加入5 μmol·L-1Rh123培养2 h,吸去细胞上清后用PBS洗3遍,1 h内采用流式细胞仪进行分析和免疫荧光显微镜进行观察。
1.2.4细胞周期检测
处理过的细胞用PBS洗3遍后,用含体积分数70%的无水酒精4 ℃孵育过夜,加入PBS重悬以洗去残余的酒精,然后加入核糖核酸酶A(RNase A)100 μl避光孵育30 min,并加入400 μl PI染色,上流式细胞仪检测。
1.2.5实时定量PCR(RT-PCR)分析
1.2.5.1总RNA的提取 取对数生长期细胞,用Trizol试剂盒提取总RNA,按照提取试剂的试剂盒说明书进行操作。
1.2.5.2逆转录 RNA逆转录为cDNA,按照TaKaRa逆转录试剂盒说明书步骤进行操作。反应条件为逆转录50 ℃ 30 min和激活PCR 95 ℃ 15 min。cDNA置于-20 ℃保存。
1.2.5.3RT-PCR RT-PCR扩增反应体系为20 μl,SYBR 10 μl,Rox Dye 0.4 μl,cDNA模板1 μl,GADPH正义反义引物各0.5 μl,多药耐药蛋白1(MDR1)正义反义引物各0.5 μl,无RNA水解酶(RNase free)去离子水7.6 μl。MDR1的引物序列:正向为5′-CCCAGGAGC
CCATCCTGT-3′,反向为5′-CCCGGCTGTTGTCTCCATA-3′;GADPH:正向为5′-AATCCCATCACCATCTTCCA-3,反向为5′-TGGACTCCACGACGTACTCA-3′。PCR循坏为:95 ℃ 15 s,60 ℃ 60 s,72 ℃ 10 s,共40个循环。最后用StepOnePlusTMRT-PCR系统进行检测分析。每次试验每种细胞设置3个复孔,mRNA水平用ΔCT平均值来表示,按照2-ΔΔCT法计算基因的相对表达含量。
1.2.6免疫印迹
收集的细胞加入含有10 mmol·L-1苯甲基磺酰氟(PMSF) RIPA裂解液冰浴,30 min后用细胞刮刀将细胞刮下,收集后4 ℃ 12 000 r·min-1离心15 min。吸出上清液,BCA法进行蛋白定量。按照50 μg蛋白的量加入到10%SDS-PAGE凝胶电泳分离蛋白,然后将蛋白转至PVDF膜上。5%脱脂牛奶室温封闭2 h,一抗(1∶1 000稀释)4 ℃孵育过夜后TBST洗涤,每次10 min,共3次,二抗(1∶20 000)室温孵育2 h,TBST洗涤,每次10 min,共4次,洗涤后加入化学发光液,最后通过GelPro gel分析软件拍照。
1.2.7统计学处理
每个实验独立重复3次及以上,计算数据以均数± 标准差表示,实验数据采用SPSS 17.0软件进行t检验和卡方检验。P<0.05为差异有统计学意义。
2 结 果
2.1 DHA对卵巢癌耐药细胞的细胞毒性
为了排除DHA细胞毒作用对实验结果的干扰,我们用MTT法评估DHA对A2780及A2780/T细胞生存率的影响,以选出最适浓度。检测结果(图1)显示,随着DHA浓度的增加,A2780(图1B)及A2780/T(图1A)细胞存活率下降。当DHA浓度分别低于64 μmol·L-1及296 μmol·L-1时,细胞毒作用可以忽略不计(细胞存活率不低于90%)。因此我们分别选择64 μmol·L-1和296 μmol·L-1作为A2780及A2780/T细胞中DHA的作用浓度。
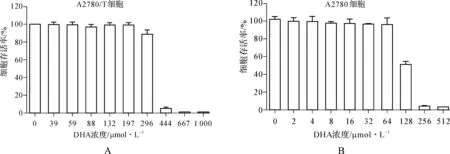
图1 DHA对A2780/T及A2780细胞的毒性作用
Fig 1 Cytotoxicity of DHA in A2780/T and A2780 cells
2.2 DHA对A2780/T细胞的耐药逆转作用
A2780和A2780/T细胞在分别用64 μmol·L-1和296 μmol·L-1DHA进行48 h的预处理后,加入不同浓度的紫杉醇(0~32 μmol·L-1),合成曲线并分别计算IC50。我们发现,DHA作用后,A2780/T细胞的存活率曲线向左移动,而A2780细胞的曲线未见明显变化(图2)。表1结果显示A2780/T细胞的IC50为5.42±1.45,而DHA作用后为1.83±0.53,差异具有统计学意义(P<0.05),DHA对A2780/T细胞紫杉醇耐药的逆转倍数为2.96。
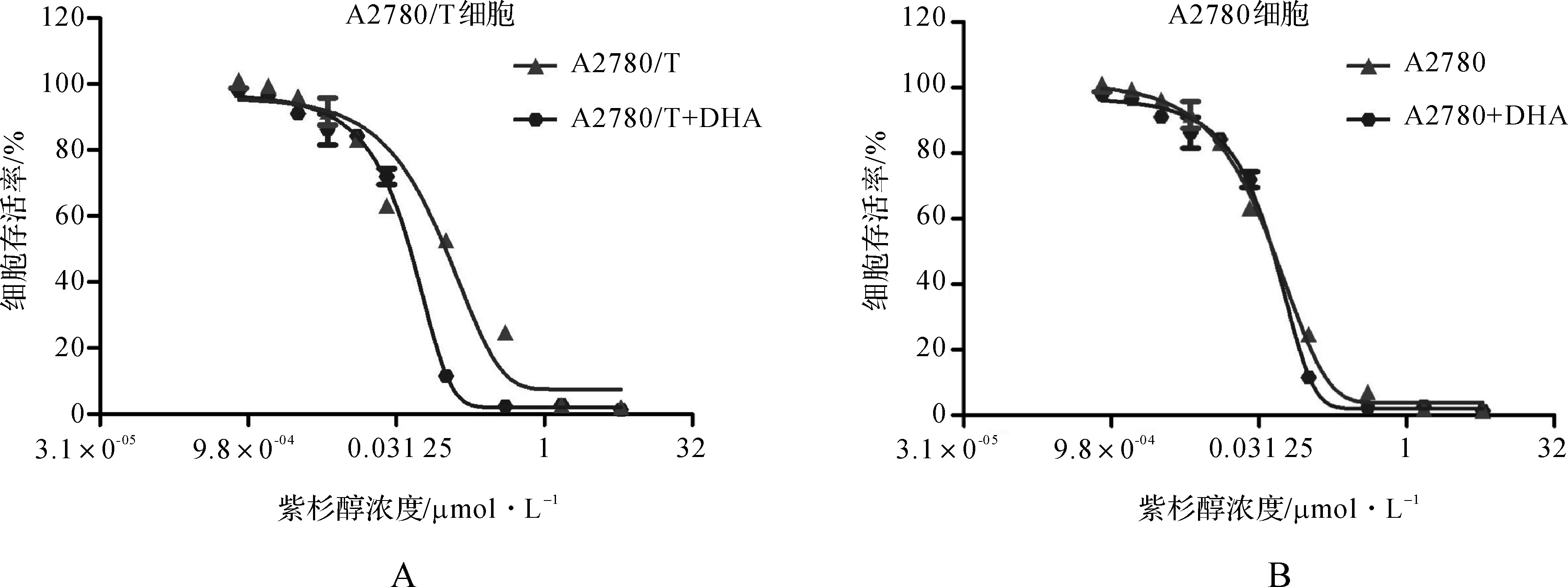
图2 DHA对紫杉醇在A2780及A2780/T细胞的细胞毒作用的影响
Fig 2 Effects of DHA on taxol toxicity in A2780 and A2780/T cells
表1 A2780/T 及A2780细胞对紫杉醇的药敏试验
Tab 1 The sensitivity test of taxol in A2780/T and A2780 cells
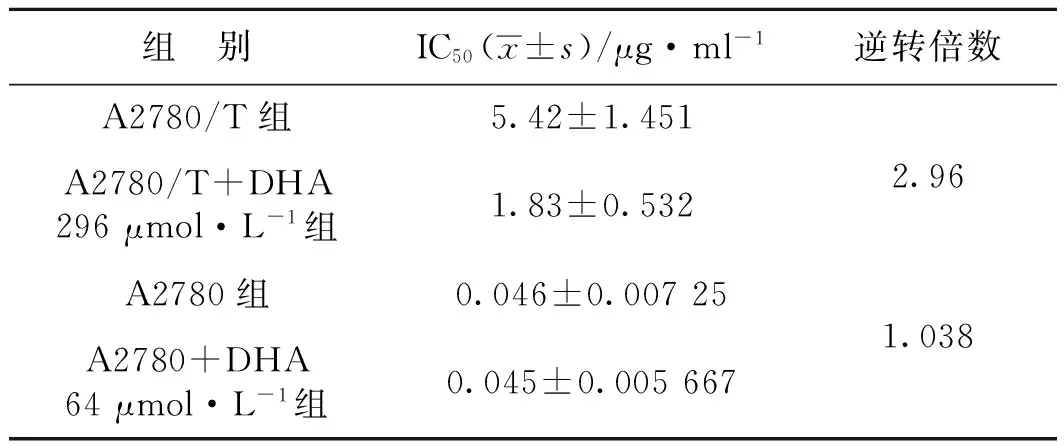
组 别IC50(x±s)/μg·ml-1逆转倍数A2780/T组5.42±1.4512.96A2780/T+DHA296μmol·L-1组1.83±0.532A2780组0.046±0.007251.038A2780+DHA64μmol·L-1组0.045±0.005667
2.3 DHA促进Rh123在细胞里的聚集
为了探究DHA是否可以增加化疗药物在细胞中的含量,我们用Rh123试验进行模拟。结果显示:A2780细胞胞质里Rh123的含量显著高于A2780/T细胞(图3A、B)。而A2780/T细胞中加入DHA(11~300 μmol·L-1)48 h后(图3E~H),Rh123的含量明显增加,并呈现剂量依赖效应。图3E~H分别与图3C~D对比显示,DHA和紫杉醇共同作用,细胞内Rh123含量增加得更加明显。
2.4 DHA改变A2780/T细胞的细胞周期分布
表2结果显示,用3 μmol·L-1紫杉醇处理过的A2780/T细胞G0/G1期细胞所占比例为4.5%。而加入不同浓度DHA(33、100、296 μmol·L-1)后G0/G1期细胞逐渐增加,分别为5.7%、18.4%、20.5%。随着DHA浓度的增加G0/G1期细胞比例逐渐增加,而M/G2期细胞所占比例呈剂量依赖性下降。
2.5 DHA下调MDR1 mRNA和MDR相关蛋白的表达
我们用实时定量PCR及蛋白质印迹法检测DHA对其表达的影响。图4结果显示:A2780/T细胞MDR1 mRNA(图4A)、P-gp(图4B)及其他MDR相关蛋白(MDR1、MRP、BCRP、LRP)(图4C)表达量明显高于A2780细胞。而DHA处理过的A2780/T细胞MDR1、P-gp、MRP、BCRP、LRP表达量明显降低。并且,相对于单独使用紫杉醇,紫杉醇与DHA联合作用后MDR相关蛋白表达的下降更加明显。
2.6 DHA抑制p38MAPK的磷酸化和NF-κB通路的激活
图5的免疫印迹结果显示:DHA和紫杉醇联合处理过的A2780/T细胞表达的pp38 MAPK和NF-κB含量降低,但p38 MAPK的表达量没有明显区别。
3 讨 论
n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids,n-3 PUFAs)是人类必需脂肪酸,在深海鱼类及海藻中含量丰富。它可以预防肿瘤的发生,抑制肿瘤生长[4-5]。而其家族中的DHA和二十碳五烯酸(EPA)有着逆转肿瘤MDR的功效。MDR是指细胞对某种化疗药物耐药的同时,对其他结构不同、作用靶点不同的抗肿瘤药物也具有耐药性。它是导致肿瘤化疗失败的重要原因之一。
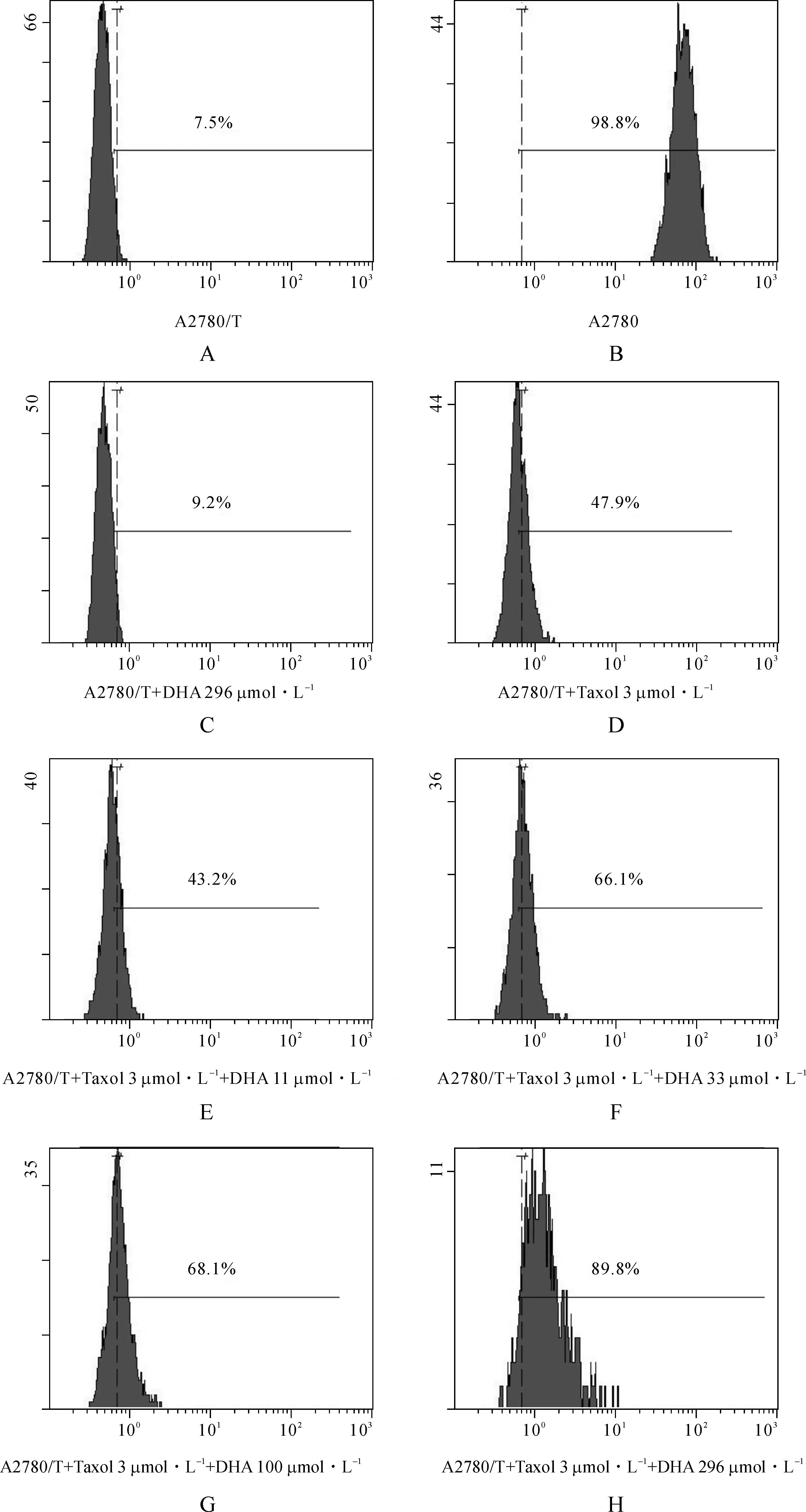
图3 DHA对Rh123在细胞内聚集的影响
Fig 3 Effects of DHA on the accumulation of Rh123
表2 A2780/T细胞的细胞周期分布
Tab 2 Cell cycle distribution of A2780/T cells
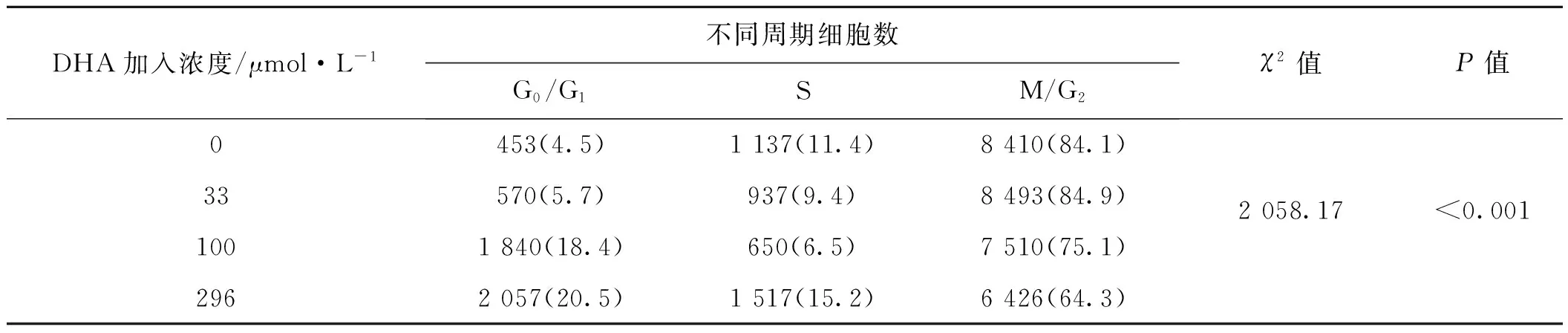
DHA加入浓度/μmol·L-1不同周期细胞数G0/G1SM/G2χ2值P值0453(4.5)1137(11.4)8410(84.1)2058.17<0.00133570(5.7)937(9.4)8493(84.9)1001840(18.4)650(6.5)7510(75.1)2962057(20.5)1517(15.2)6426(64.3)
注:括号内为百分比
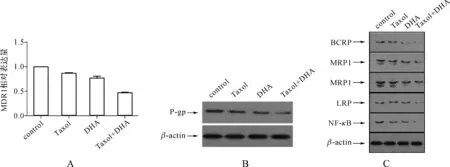
图4 DHA对MDR1mRNA和MDR相关蛋白表达的影响 A.MDR1 mRNA的相对表达; B.P-gp蛋白表达; C.MDR相关蛋白表达。control为A2780/T;Taxol为A2780/T+3 μmol·L-1Taxol;DHA为A2780/T+296 μmol·L-1DHA;Taxol+DHA为A2780/T+3 μmol·L-1Taxol+296 μmol·L-1DHA
Fig 4 Effects of DHA on MDR1 mRNA and MDR-related proteins
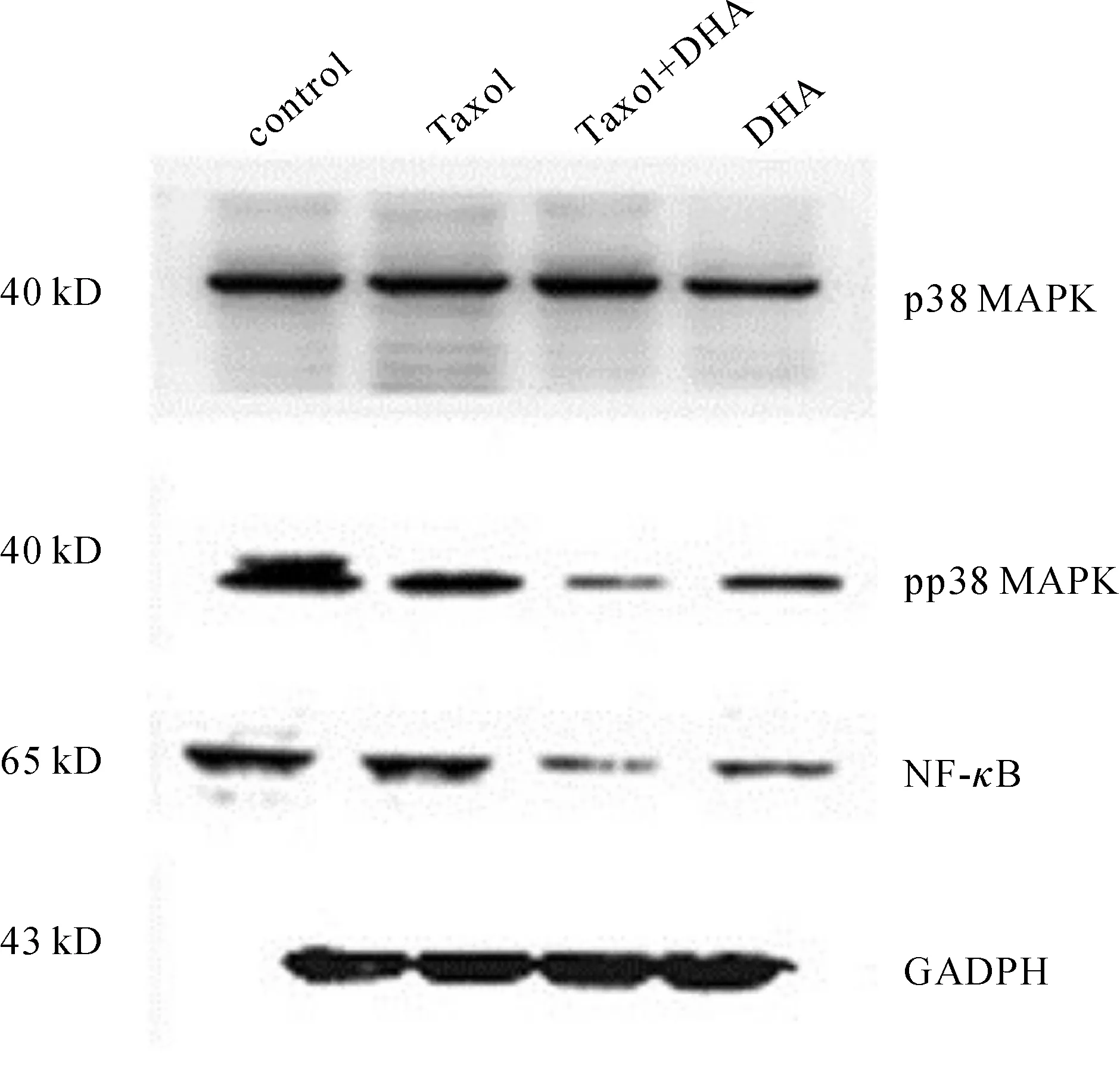
图5 DHA 对p38 MAPK、pp38 MAPK及NF-κB表达的影响 control为A2780/T;Taxol为A2780/T+3 μmol·L-1Taxol;DHA为A2780/T+296 μmol·L-1DHA;Taxol+DHA为A2780/T+3 μmol·L-1Taxol+296 μmol·L-1DHA
Fig 5 Effect of DHA on expression of p38 MAPK,pp38 MAPK and NF-κB
已有研究证实n-3 PUFAs可以增加卵巢癌细胞对阿霉素的化疗敏感性,同时还可以增加其对三氧化二砷的毒性反应,逆转细胞的原发性或获得性耐药[6-7]。因此我们提出假说,DHA和EPA能够逆转卵巢癌紫杉醇耐药细胞的耐药性。在前期研究中,我们建立了卵巢癌耐紫杉醇细胞株A2780/T,经测定,它的耐药指数为430.7[8]。MTT结果显示,EPA对A2780/T细胞的耐药逆转作用并不明显。DHA明显地增加了A2780/T细胞对紫杉醇的化疗敏感性,逆转倍数为2.96,而卵巢癌敏感细胞株A2780对紫杉醇的IC50,实验组和对照组差异不具有统计学意义,推测DHA可能只在卵巢癌耐药细胞中具有化疗增敏作用。
前期对敏感细胞耐药的细胞生物学行为研究显示,A2780/T与A2780细胞的细胞周期分布趋势并不相同[8]。本研究流式细胞术结果显示,DHA可以改变细胞周期的分布,增加非分裂期的细胞比率。
MDR的产生涉及多种作用机制,包括阻滞细胞周期、增加药物外排、改变细胞通路的状态等。本课题采用Rh123实验监测细胞外排的情况。耐药细胞由于P-gp的药物泵作用,胞内Rh123的聚集较少。实验结果表明DHA可以增加耐药细胞胞内Rh123即化疗药物的聚集,减少其外排作用,增加化疗药物对其的作用效果。蛋白质印迹试验中DHA作用后P-gp及其他MDR相关蛋白(MRP1、MRP2、BCRP、LRP)的表达下调又进一步验证了这个结果。证明了减少药物泵的外排是DHA耐药逆转作用的机制之一。据了解,目前已经开发出了多种人工合成的P-gp抑制剂,然而,除了耐药逆转的功效,他们同时还产生严重的毒副作用。相对而言天然产物DHA的无毒性作用在临床上的使用具有绝对优势。
MDR的产生与多种信号通路的异常激活相关,如MAPK和磷脂酰肌醇-3-激酶(PI3K)/Akt信号传导途径等[9-11]。有研究者发现葡萄籽的提取物通过抑制NF-κB和MAPK信号通路来逆转MDR。目前已有报道称,NF-κB含有MDR1基因的结合区域[12]。因此,NF-κB通路在MDR相关机制研究中被广泛关注[13-14]。同时,p38 MAPK又被认为是NF-κB通路上游的调节酶[15]。我们据此猜测DHA逆转A2780/T的耐药性是通过抑制NF-κB和p38 MAPK通路而作用的。实验的结果也证实了这个猜测:DHA显著下调NF-κB和pp38 MAPK,而p38 MAPK未出现改变。也就是说,DHA抑制了NF-κB和p38 MAPK通路的激活。
综上所述,DHA对卵巢癌耐药细胞具有耐药逆转作用,其机制与降低P-gp及其他MDR相关蛋白的功能和表达、抑制NF-κB通路的激活和p38 MAPK的磷酸化密切相关,然而更多的相关机制仍需进一步研究。我们相信,未来DHA可以作为辅助化疗制剂运用到肿瘤的临床治疗中。
[1] JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] DI M M,DELLA C A,CICCHILLITTI L,et al.A proteomic approach to paclitaxel chemoresistance in ovarian cancer cell lines[J].Biochim Biophys Acta,2009,1794(2):225-236.
[3] MOCELLIN M C,PASTORE S J A,CAMARGO C Q,et al.Fish oil decreases C-reactive protein/albumin ratio improving nutritional prognosis and plasma fatty acid profile in colorectal cancer patients[J].Lipids,2013,48(9):879-888.
[4] GLEISSMAN H,JOHNSEN J I,KOGNER P.Omega-3 fatty acids in cancer,the protectors of good and the killers of evil?[J].Exp Cell Res,2010,316(8):1365-1373.
[5] GERBER M.Omega-3 fatty acids and cancers:a systematic update review of epidemiological studies[J].Br J Nutr,2012,107(Suppl 2):S228-239.
[6] PLUMB J A,LUO W,KERR D J.Effect of polyunsaturated fatty acids on the drug sensitivity of human tumour cell lines resistant to either cisplatin or doxorubicin[J].Br J Cancer,1993,67(4):728-733.
[7] BAUMGARTNER M,STURLAN S,ROTH E,et al.Enhancement of arsenic trioxide-mediated apoptosis using docosahexaenoic acid in arsenic trioxide-resistant solid tumor cells[J].Int J Cancer,2004,112(4):707-712.
[8] WANG N N,ZHAO L J,WU L N,et al.Mechanistic analysis of taxol-induced multidrug resistance in an ovarian cancer cell line[J].Asian Pac J Cancer Prev,2013,14(9):4983-4988.
[9] KIM H,PARK G S,LEE J E,et al.A leukotriene B4 receptor-2 is associated with paclitaxel resistance in MCF-7/DOX breast cancer cells[J].Br J Cancer,2013,109(2):351-359.
[10] HISS D.Optimizing molecular-targeted therapies in ovarian cancer:the renewed surge of interest in ovarian cancer biomarkers and cell signaling pathways[J].J Oncol,2012,2012:737981.
[11] MACKAY H J,TWELVES C J.Protein kinase C:a target for anticancer drugs?[J].Endocr Relat Cancer,2003,10(3):389-396.
[12] BENTIRES-ALJ M,BARBU V,FILLET M,et al.NF-kappaB transcription factor induces drug resistance through MDR1 expression in cancer cells[J].Oncogene,2003,22(1):90-97.
[13] ZHAO B X,SUN Y B,WANG S Q,et al.Grape seed procyanidin reversal of p-glycoprotein associated multi-drug resistance via down-regulation of NF-kappaB and MAPK/ERK mediated YB-1 activity in A2780/T cells[J].PLoS One,2013,8(8):e71071.
[14] BARANCIK M,BOHACOVA V,KVACKAJOVA J,et al.SB203580,a specific inhibitor of p38-MAPK pathway,is a new reversal agent of P-glycoprotein-mediated multidrug resistance[J].Eur J Pharm Sci,2001,14(1):29-36.
[15] SAHA R N,JANA M,PAHAN K.MAPK p38 regulates transcriptional activity of NF-kappaB in primary human astrocytes via acetylation of p65[J].J Immunol,2007,179(10):7101-7109.
Reversal effect of docosahexaenoic acid on taxol resistance in human ovarian carcinoma A2780/T cells
WU Yi-nan1,WANG Su-li1,WANG Ying-chun1,ZHAO Li-jun1,LU Jin1,WANG Jin-hua1,2
(1.DepartmentofGynecologicalOncologySurgery,JiangsuCancerHospital,NanjingMedicalUniversity,Nanjing210009,China; 2.DepartmentofGeneralSurgery,NanjingGeneralHospitalofNanjingMilitaryCommand,PLA,Nanjing210002,China)
Objective: To study the reversal effect of DHA on reversing drug resistance of taxol resistant ovarian cancer cells and to explore the underlying mechanisms in ovarian cancer cells. Methods: Using the MTT assay,the change of A2780/T cells resistant to taxol was determined. Drug efflux capacity in A2780/T cells was examined by flow cytometry using Rhodamine123(Rh123) intracellular accumulation assay. Cell cycle distribution was analyzed by flow cytometry(FCM). Real-time PCR was used to detect expression of MDR1 mRNA. Expression of drug resistance related proteins and proteins involved in the mechanisms was examined by Western bloting. Results: DHA significantly reduced the values of IC50of A2780/T cells to taxol(P<0.05). Additionally, Rh123 intracellular accumulation assay demonstrated that DHA promoted the chemotherapeutic drug accumulation to exert the cytotoxic effect on A2780/T cells in a concentration dependent manner (P<0.05).Our results also showed that taxol combined with DHA could change the cell cycle distribution and prolong the cell cycle in G0/G1phase (P<0.05).Furthermore, we found that DHA down-regulated MDR related proteins, and suppressed the activation of NF-κB and phosphorylation of p38 MAPK. Conclusion: DHA reverses taxol resistance of A2780/T cells by changing the cell cycle distribution, inhibiting expression and function of P-gp and MDR related proteins, as well as blocking NF-κB and p38 MAPK pathways.
docosahexaenoic acid; ovarian carcinoma; taxol resistance; P-glycoprotein; nuclear factor-κ-gene binding; p38 mitogen-activated protein kinase
2015-05-14
2015-05-24
国家自然科学基金资助项目(81473636);江苏省医学重点人才项目(RC2011091)
吴翌楠(1989-),女,江苏南京人,在读硕士研究生。E-mail:wuyinan2909@sina.com
王金华 E-mail:wangjinhua588@163.com
吴翌楠,王苏立,王迎春,等.DHA逆转卵巢癌细胞A2780/T紫杉醇耐药的机制研究[J].东南大学学报:医学版,2015,34(5):689-695.
R737.31; R979.1
1671-6264(2015)05-0689-07
10.3969/j.issn.1671-6264.2015.05.003

