两种不同来源血小板进行基于光子晶体技术的血小板抗体检测的对比研究
凌云,孔欣,陈宝安
(1.东南大学附属中大医院 血液科,江苏 南京 210009; 2.苏州大学 附属第三医院,常州市第一人民医院,江苏 常州 313000)
·论 著·
两种不同来源血小板进行基于光子晶体技术的血小板抗体检测的对比研究
凌云1,2,孔欣2,陈宝安1
(1.东南大学附属中大医院 血液科,江苏 南京 210009; 2.苏州大学 附属第三医院,常州市第一人民医院,江苏 常州 313000)
目的:比较分别由浓缩血小板、新鲜血液分离血小板所得血小板裂解液,行光子晶体技术检测血小板抗体的效率。方法:检测样本为原发免疫性血小板减少症(ITP)患者32例和正常健康人对照31例。对来源于浓缩血小板和新鲜血液分离的血小板同时进行基于光子晶体技术的血小板特异性抗体检测及单克隆抗体特异性血小板抗原固定术(MAIPA)检测,以MAIPA检测结果作为光子晶体技术检测结果的参照。结果:两组不同来源的血小板行光子晶体的血小板抗体检测敏感性均高于MAIPA,且浓缩血小板组更高。新鲜血液分离组特异性高于MAIPA,浓缩血小板组低于MAIPA。结论:使用新鲜血液分离采集血小板行光子晶体技术检测血小板特异性抗体效率较高。
血小板来源; 血小板抗体; 液相芯片技术
原发免疫性血小板减少症(idiopathic thrombocytopenic,ITP)是由机体免疫系统功能紊乱引起血小板破坏增加而致数目减少的自身免疫性出血性疾病,主要系血小板特异性抗体介导血小板破坏引起的血小板数量减少所致。血小板抗体的产生是引起ITP病人血小板减少及巨核细胞成熟障碍的重要原因。血小板特异性抗体主要包括血小板膜糖蛋白(glycoprotein,GP)Ⅱb/Ⅲa抗体、Ⅰb/Ⅸ抗体,少数表现为GPⅠa/Ⅱa、GPⅣ等抗体[1]。同一患者体内可同时检测到多种抗体。本实验采用先进的光子晶体(photonic crystal)技术进行血小板特异性抗体检测的研究,对两种不同来源血小板的检测结果进行比较,探究何种方法可以获取最佳的检测效率。
1 材料与方法
1.1 研究对象
初治患者血清标本32例均取自苏州大学附属第三医院2011至2012年收治的患者,根据临床症状诊断为特发性血小板减少性紫癜,部分伴有感染发烧症状,血小板有不同程度的降低,没有输血史。正常对照血清标本31例取自2014年东南大学附属中大医院门诊健康体检者,无相关的血液系统疾病,其血小板计数均在正常范围。
1.2 主要试剂与仪器
4种包被单克隆抗体的光子晶体微载体[东南大学生物电子学国家重点实验室制备,由其独特的结构色进行编码,包被的4种单克隆抗体分别为抗GPⅨ单克隆抗体(SZ1)、GPⅠb mAb(SZ2)、GPⅡb mAb(SZ22)和GPⅢa mAb(SZ21)];异硫氰酸荧光素(FITC)标记的羊抗人IgG(FITC-goat-anti-human IgG,美国Jackson公司);牛血清白蛋白(BSA,美国Sigma公司);磷酸盐缓冲液(PBS,pH 7.4)、0.05% twain-20的磷酸盐缓冲液(PBST,pH 7.4)由东南大学生物电子学国家重点实验室配置;倒置荧光显微镜(Olympus,型号BX53);数字成像系统(Olympus,型号DP73)。
1.3 光子晶体检测血小板特异性抗体方法
1.3.1血小板采集 将血小板分为A、B两组:A组为浓缩血小板组,B组为新鲜血液分离组。A组血小板取自红细胞类型为“O”型健康成年人,乙二胺四乙酸(EDTA)抗凝,通过差速离心分离血小板;B组血小板取自输注浓缩血小板病人输注后输液管中残余的血小板。血小板用PBS/EDTA液洗涤, 3 000 r·min-1离心5 min,沉淀血小板用吸管吹匀,重复3次。最终用PBS/EDTA液重新悬浮血小板,测血小板浓度并调整血小板浓度为1×109个·ml-1。
1.3.2血小板裂解液的制备 方法同MAIPA,将浓度为1×109个·ml-1的血小板移至1.5 ml EP管中,每管100 μl,约含血小板1×108个。每管加入100 μl ITP患者待测血浆,混匀后室温孵育60 min。加0.6 ml PBS/EDTA,混匀后上离心机3 000 r·min-1离心2 min,弃去上清,再加0.6 ml PBS/EDTA,吹匀血小板,洗涤离心,再重复2次。第3次离心后扣干上清。每管加入TritonX-100裂解液100 μl溶解血小板,震荡混匀,置于4 ℃摇床孵育30 min。4 ℃下13 000 r·min-1离心40 min分离裂解液,以去除不溶解的物质。离心后取上清90 μl,用360 μl稀释缓冲液稀释,血小板裂解液即配置完成(图1)。
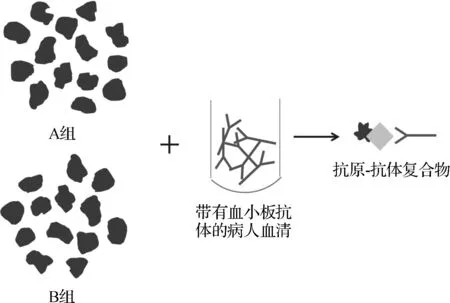
图1 血小板裂解原理图
Fig 1 Schematic diagram of platelet lysate
1.3.3光子晶体微载体检测血小板抗体 在EP管中加入4种包被单克隆抗体的光子晶体微载体各5个,加入裂解液200 μl,置于室温摇床上孵育30 min,PBST洗涤3次,PBS洗涤3次,抽干,加入浓度为0.1 mg·ml-1的FITC-羊抗人IgG 20 μl,室温摇床孵育30 min,PBST和PBS先后洗涤3次。
1.3.4荧光分析 将最终洗涤好的光子晶体微载体置于正置荧光显微镜观察,cellSens Standard软件测量并记录数据,由于此软件可测量灰度值,所以本实验以灰度值来代替荧光值作为实验数据。使用自然光源区分光子晶体结构色以确定其编码,关闭自然光源并遮挡周围多余光线,用蓝色荧光激发,检测并记录每个光子晶体的灰度值,每组同种类5个光子晶体求平均值作为最终实验结果。阳性取值为10个阴性取值的平均数加2倍标准差。
1.4 单克隆抗体特异性血小板抗原固定术(MAIPA)
根据国际生物标准基于Kiefel等[2]的方法,并依照1996年Stockelberg等[3]的方法对MAIPA进行了改良。使用病人血清与正常血小板的孵育裂解液代替病人血小板裂解液[4]。
1.5 统计学处理
使用SPSS 16.0软件进行统计分析。两组检测数据比较采用卡方检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 两组光子晶体血小板特异性抗体检测敏感性及特异性与MAIPA检测结果比较
将光子晶体微载体检测A、B两组血小板特异性抗体的结果与MAIPA检测患者及正常对照者血清的结果进行比较。A、B组敏感性均高于MAIPA,B组敏感性高于A组。A组特异性低于MAIPA,B组特异性高于MAIPA。敏感性、特异性计算结果见表1。B组测得灰度值阳性均值与阴性值之比值(6.9∶1)较A组(5.4∶1)大。
表1 光子晶体微载体检测A、B组与MAIPA检测4种血小板自身抗体的敏感性及特异性
Tab 1 Sensitivity and specificity of group A and B based on photonic crystal microcarriers and MAIPA

单抗敏感性特异性MAIPAA组B组MAIPAA组B组SZ146.9%50.0%50.0%90.3%87.0%90.3%SZ234.4%43.7%37.5%93.5%93.5%96.7%SZ2140.6%96.7%84.4%83.9%77.4%90.3%SZ2231.3%87.1%75.0%93.5%83.9%93.5%
2.2 批内变异和批间变异
将1例GPⅠb抗体阳性标本同时用两种方法重复检测3组,测定批内变异率。A组平均标准偏差(变异系数)为5.1%±4.7%,B组变异系数为4.77%±3.21%。将1例GPⅡb抗体阳性标本用于测定批间变异,该血清在3 d内用两种方法同时检测,测定批间变异率。A组批间变异系数为8.9%±6%,B组为8.3%±8.1%。
3 讨 论
血小板自身抗体的检测对ITP的诊断是至关重要的[5]。ITP患者血小板自身抗体水平的变化用于评估患者对治疗的反应也很重要[6]。国际上公认且推广的经典方法为MAIPA,1987年由Kiefel等[2]报道,1996年Stockelberg等[3]对MAIPA进行了改良。但该方法操作复杂、耗时久,不便于临床推广。Nguyen等[7]在2004年报道了联合检测血小板特异性抗体(SASPA),该方法使用3种带有不同荧光标记的聚苯乙烯微球,同时检测3种不同血小板特异性抗体。但这些方法因为技术上的繁复、耗时和低敏感性而未在医院广泛使用[8]。
光子晶体技术近年来受到越来越多生物学和生物化学领域研究者的关注[9-10]。多种新生物技术的开发,如酶活性的实时监测、细胞形态学研究等,都采用光子晶体技术,且该技术可进行多重肿瘤标志物的同时检测。光子晶体编码的微载体用于检测表现出良好的敏感性、稳定性及高通量的优点[11]。
本研究中,我们采用光子晶体技术探索进行血小板特异性抗体检测,比较何种血小板更适用于该检测。两组检测批内批间差异均在可接受范围内,两组试验均为有效实验。其中浓缩血小板较易获得,且浓度高、不易凝集,用于实验较为便捷;而新鲜血液采集需健康志愿者提供,需每天采集新鲜血液,在洗涤浓缩过程中发生凝集较浓缩血小板多。A组较易浓缩到实验浓度且血小板不易凝结,使得试验中有效血小板量较大,获得更高的阳性率,其中包括真阳性率及假阳性率都高于B组。A组虽然敏感性(43.7%~96.7%)高于B组(37.5%~84.4%),但因假阳性率的升高使得特异性下降(77.4%~93.5%),降低了检测效率;B组特异性(90.3%~93.5%)略低于MAIPA(93.5%~100%),而敏感性(37.5%~84.4%)高于MAIPA(31.2%~75.0%),较MAIPA有更高的检测效率。
综上,在确诊ITP患者时采用新鲜血液分离血小板进行光子晶体技术检测血小板特异性抗体的方法更可靠;采用浓缩血小板检测易于操作且更便捷,有更高的敏感性,可用于筛选是否存在血小板特异性抗体。
[1] HAYASHI T,AMAKISHI E,MATSUYAMA N,et al.Establishment of a cell line panel as an alternative source of platelet antigens for a screening assay of anti-human platelet antibodies[J].Transfus Med,2011,21:199-204.
[2] KIEFEL V,SANTOSO S,WEISHEIT M,et al.Monoclonal antibody-specific immobilization of platelet antigens(MAIPA):a new tool for the identification of platelet-reactive antibodies[J].Blood,1987,70(6):1722-1726.
[3] STOCKELBERG D,HOU M,JACOBSSON S,et al.Detection of platelet antibodies in chronic idiopathic thrombocytopenic purpura A comparative study using flowcytometry,a whole platelet ELISA,and an antigen capture ELISA[J].Eur J Haematol,1996,56:72-77.
[4] 阮敏,朱凌燕,曾庆曙,等.抗凝剂在改良MAIPA法中对ITP患者血小板特异性自身抗体(GPⅡbⅢa和GPⅠb)检测的影响[J].安徽医科大学学报,2013,48(7):832-834.
[5] CINES D B,BUSSEL J B,LIEBMAN H A,et al.The ITP syndrome:pathogenic and clinical diversity[J].Blood,2009,113:6511-6521.
[6] BERCHTOLD P,WENGER M,AUTOANTIBODIE S.against platelet glycoproteins in autoimmune thrombocytopenic purpura:their clinical significance and response to treatment[J].Blood,1993,81:1246-1250.
[7] NGUYEN XD,DUGRILLON A,BECK C,et al.A novel method for simultaneous analysis of specific platelet antibodies:Saspa[J].Br J Haematol,2004,127:552-560.
[8] ZHAO Y J,ZHAO X W,GU Z Z,et al.Photonic crystals in bioassays[J].Adv Funct Mater,2010,2:2970-2988.
[9] CUNNINGHAM B T,LAING L.Microplate-based,label-free detection of biomolecular interactions:applications in proteomics[J].Expert Rev Proteomics,2006,3(3):271-281.
[10] FAN X,WHITE I M,SHOPOVA S I,et al.Sensitive optical biosensors for unlabeled targets:a review[J].Anal Chim Acta,2008,14,620(1-2):8-26.
[11] MCMILLAN R.Antigen-specific assays in immune thrombocytopenia [J].Transfus Med Rev,1990,4:136-143.
Comparing the detections of platelet antibodies based on photonic crystal technology of platelets from two different sources
LING Yun1,2,KONG Xin2,CHEN Bao-an1
(1.DepartmentofHematology,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China; 2.3rdAffiliatedHospital,SoochowUniversity,ChangzhouFirstPeople’sHospital,Changzhou213000,China)
Objective: To compare the efficiencies of detections of platelet antibodies based on photonic crystal technology of platelets lysate solution obtained from concentrated platelet sample and platelets separated from fresh blood. Methods: The samples for detection came from 32 primary immune thrombocytopenia(ITP) patients and 31 healthy subjects as the control group. MAIPA was used to examine all samples,and the result was used as a reference for the results of photonic crystal detection. Result: The sensitivity of the two different sources of platelet to the detection based on photonic crystals were both higher than MAIPA, especially for the platelet concentration group.The specificity of freshly isolated blood group was higher than MAIPA, and that of the platelet concentration group was lower than MAIPA. Conclusion: It is most efficient for the specificity antibodies in platelets separated from fresh blood to be examined with photonic crystal-based technology.
sources of platelets; platelet antibody; liquid chip technology
2015-02-09
2015-04-06
中国博士后科学基金面上项目(2012M511181)
凌云(1970-),女,江苏常州人,主任医师,医学博士。E-mail:a110426007@hotmail.com
陈宝安 E-mail:cba8888@hotmail.com
凌云,孔欣,陈宝安.两种不同来源血小板进行基于光子晶体技术的血小板抗体检测的对比研究[J].东南大学学报:医学版,2015,34(5):758-761.
R446
A
1671-6264(2015)05-0758-04
10.3969/j.issn.1671-6264.2015.05.016

