let-7e嵌合小鼠模型的建立和表型分析
孙迪,夏菲,杨燚,陈火,张进平
(苏州大学 生物医学研究院,江苏 苏州 215123)
·论 著·
let-7e嵌合小鼠模型的建立和表型分析
孙迪,夏菲,杨燚,陈火,张进平
(苏州大学 生物医学研究院,江苏 苏州 215123)
目的:探讨微小RNA let-7e在淋巴细胞分化发育中的作用。方法:构建let-7e过表达嵌合小鼠模型,研究let-7e对淋巴组织中T细胞、B细胞、树突状细胞(DC)、髓系来源的抑制性细胞(MDSC)发育的影响;通过流式细胞仪检测MDSC的细胞增殖和细胞凋亡,初步探讨let-7e促使MDSC增多的机制。结果:嵌合小鼠模型检测结果显示:过表达let-7e后B细胞减少,浆细胞样DC(pDC)、经典DC(cDC)增多,而T细胞及亚群比例没有变化;同时,骨髓和脾脏中的MDSC比例升高,其凋亡水平明显降低,但其增殖没有改变。结论:let-7e参与了淋巴细胞的分化和发育;let-7e可以通过抑制细胞凋亡促进MDSC的增多。
骨髓嵌合模型; let-7e; 免疫表型; 髓系来源的抑制性细胞; 细胞凋亡
微小RNA(MicroRNAs,miR)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,在细胞发育和各种疾病中的作用和调控机制已经得到广泛而深入的研究[1-3]。在免疫系统中,已有的研究表明,microRNA在造血干细胞、T细胞、B细胞、树突状细胞(DC)、自然杀伤(NK)细胞、粒细胞和巨噬细胞的发育、分化、生存及功能中均发挥重要作用[4-7],从而参与了机体先天免疫和获得性免疫。众所周知,髓系来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)在肿瘤和感染性疾病中对免疫应答起着很重要的负性调控作用,而MDSCs扩增是其发挥作用的显著特征。2013年Li等研究发现miR-155和miR-21可以同时和分别调控功能性MDSCs的扩增[8],提示microRNA参与了MDSC的扩增。
let-7e是最早一批被发现的微小let-7家族成员之一。最先由Lagos-Quintana等[9]在果蝇胚胎裂解产物中分离并确定其基因序列,同时也证明了let-7e在人HeLa细胞系、鼠和成年鱼类中的表达。近年来一些研究表明,let-7e可以参与多个生物进程,包括胚胎发育、干细胞分化、肿瘤发生、炎症反应等过程。在胚胎干细胞分化和神经细胞的分化过程中,let-7e是细胞分裂和增殖的调节因子[10]。在实验性变态反应性脑脊髓炎模型中,体内沉默let-7e可导致Th1、Th17的减少以及炎症的减弱,同时let-7e通过靶向IL-10促进炎症的发生[11],但是let-7e是否参与淋巴细胞的发育,至今少有报道。
为了研究let-7e对淋巴细胞分化发育的影响,我们首先建立let-7e过表达嵌合小鼠模型,通过流式细胞仪分析各淋巴细胞比例的变化,初步分析let-7e影响了哪种免疫细胞的发育,并进一步研究过表达let-7e引起的MDSCs数量增多的可能机制。
1 材料与方法
1.1 实验材料
1.1.1分子生物学试剂、抗体及引物 总RNA提取试剂、逆转录酶M-MLV(RNAase H-)[宝生物工程(大连)有限公司],引物和Oligo dT(Invitrogen公司),dNTP和Taq酶(TaKaRa公司),Gr-1-PE/cy7、CD11b-FITC、B220-APC、CD4-APC、CD8-PE/cy7、CD11b-PE、CD11C-Percp/cy5.5、PDCA-1-APC、I-Ab-PE、CD11C-APC、Annexin Ⅴ-FITC等抗体(Biolegend公司),5-溴脱氧尿嘧啶核苷(Brdu)试剂盒(BD公司),荧光定量试剂盒[罗氏诊断产品(上海)有限公司]。
1.1.2细胞培养相关试剂及材料细胞培养基 RPMI 1640、DMEM、L-谷氨酰氨(南京生兴生物科技有限公司),双抗(氨卞青霉素钠、硫酸链霉素,上海第四制药厂),胎牛血清/FBS(Gibco公司),0.25%胰酶溶液+0.02% EDTA溶液(杭州吉诺生物医药技术有限公司),1.8 ml冻存管(外旋)、移液管[赛默飞世尔科技(中国)有限公司],细胞培养板[康宁生命科学(吴江)有限公司],PBS(1 L,NaCl 8 g、KCl 0.2 g、NaH2PO31.4 g、KH2PO30.27 g),Ack(1 L,KHCO31.001 g、NH4Cl 8.024 g、EDTA 0.01 mmol·L-1),5-氟尿嘧啶(5-FU)、氯喹、聚凝胺(Polybrene,Sigma公司)。
1.1.3细胞系、质粒及菌种 293T细胞系、宿主细菌stable-2、microRNA过表达质粒pMDH1-PGK-GFP以及病毒包装质粒Pcl-eco为本研究院保存;按照质粒抽提试剂盒提取DNA,制成1 mg·ml-1的水溶液,-20 ℃保存备用。
1.1.4实验仪器 流式细胞仪BD FACSCalibur、BD FACSCantoTMⅡ、BD FACSAriaⅢ(BD公司);实时定量PCR仪(艾本德公司)。
1.2 实验方法
1.2.1293T细胞培养和小鼠骨髓细胞培养 在DMEM完全培养基中(含体积分数10%胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素)放置体积分数5%CO2、37 ℃的细胞培养箱中。
1.2.2骨髓嵌合小鼠的建立及逆转录病毒的制备 在无菌EP管中准备Ca2+DNA混合物(30 μg pMDH1-PGK-GFP-let-7e,PCL-ECO 10 μg,2 mol·L-1CaCl294 μl,加水至终体积为750 μl),并与等体积的2倍HBS混匀,静置5 min。在静置时向细胞培养基中加入氯喹使终浓度为10 μmol·L-1。然后逐滴加入到预先铺好的293T细胞中,8 h后换液。72 h后收集培养基,用0.22 μm的滤器过滤以得到含有病毒粒子的上清,然后以10 μl·(10 ml)-1的比例加入聚凝胺(20 mg·ml-1,终浓度20 μg·ml-1)。加入到经5-FU处理后采集的骨髓细胞中,2 500 r·min-1离心,27 ℃、1.5 h。离心结束后弃上清,更换新鲜培养基,并加入IL-3(工作浓度20 ng·ml-1)、IL-6(工作浓度50 ng·ml-1)、干细胞生长因子(SCF,工作浓度50 ng·ml-1),继续培养。24 h后以同样的方式再次感染。收集感染过的骨髓细胞,并用PBS清洗两遍,然后将细胞通过眼静脉(200 μl·只-1)注射到辐照过的受体小鼠体内(以>8 Gy的剂量辐照受体小鼠)。
1.2.3实时定量PCR检测let-7e表达 收集被检测的细胞,用Trizol裂解细胞制备总RNA,用let-7e特异的逆转录引物(let-7e-RT)5′-CTC AAC TGG TGT CGT GGA GTC GGC AAT TCA GTT GAG ACT ATA CA-3′制备let-7e特异的cDNA。然后用let-7e特异性的定量PCR引物进行扩增:上游引物5′-CTC AAC TGG TGT CGT GGA GTC GGC AAT TCA GTT GAG ACT ATA CA-3′,下游引物5′-CTC AAC TGG TGT CGT GGA-3′。部分RNA用多聚胸腺嘧啶逆转后,用GAPDH引物做PCR作为内参对照。GAPDH上游引物5′-AGA AAC CTG CCA AGT ATG ATG ACA-3,下游引物5′-GGA AGA GTG GGA GTT GCT GTT G-3′。应用荧光定量试剂进行扩增,扩增条件:94℃ 5 min变性,94 ℃ 15 s、60 ℃ 30 s,40个循环。
1.2.4let-7e基因扩增 以B6小鼠基因组DNA为模板,以Pfx多聚酶(Invitrogen公司)进行PCR扩增,PCR产物长度为500 bp。let-7e基因扩增上游引物:5′-CTC GAG ACT GAA TTC CTG GGT TCC TTG-3′;下游引物:5′-GAA TTC TAG AGA CAT TGG CAT AAG AGA C-3′。
1.3 统计学处理
每个实验独立重复3次及以上,实验数据以均数±标准差表示,两组间比较采用t检验分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 let-7e过表达嵌合小鼠的构建
根据www.mirbase.org网站收录的小鼠mmu-let-7e的成熟片段和前体miRNA序列,我们将成熟片段的前后各150 bp左右的序列扩增到载体上。应用PubMed网站对比到其相应的DNA序列,设计PCR引物。将扩增的PCR产物用XhoⅠ/EcoRⅠ(NEB)进行双酶切,同时将载体pMDH1-PGK-GFP用同样的酶进行双酶切。连接、测序正确之后,应用配制的钙转染试剂将质粒pMDH1-PGK-GFP-let-7e转染到293T细胞中,8 h后换新鲜培养液,继续培养40 h后,收集293T细胞,并同时收集未转染的293T细胞作对照,用qRT-PCR检测let-7e。
首先用特异的RT引物(let-7e-RT)进行逆转录,然后用特异的引物(let-7e-F、let-7e-R)进行实时定量PCR扩增。所得结果如图1。

aP<0.01
图1 实时定量PCR检测pMDH-GFP-let-7e质粒中let-7e的表达Fig 1 Detection of let-7e in 293T cells transfected with pMDH-GFP-let-7e
在确定此质粒可以成功表达let-7e的前提下,我们开始建立骨髓嵌合小鼠模型。在骨髓嵌合模型建立6周后,取let-7e过表达嵌合小鼠的骨髓、脾脏、胸腺,制备单个细胞悬液,并进行FACS分析。GFP+细胞为let-7e过表达细胞,GFP-细胞为正常细胞。实验显示let-7e过表达细胞,即GFP+细胞比例大约占50%(图2),说明我们的模型是成功的。
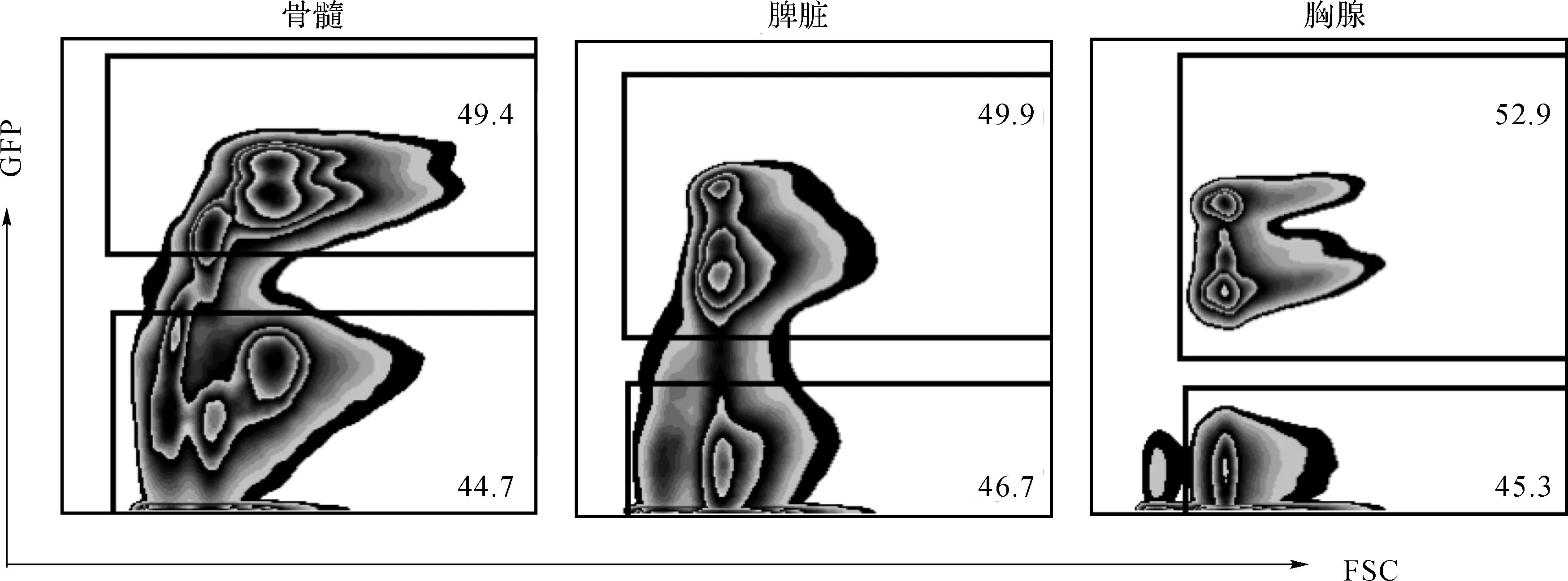
图2 通过检测GFP确定嵌合小鼠的嵌合效率
Fig 2 Detection of GFP in chimeric mouse model
2.2 淋巴细胞的表型分析
取let-7e过表达嵌合小鼠的骨髓、脾脏、胸腺,制备单个细胞悬液,用相应的抗体染色,并进行流式细胞术分析。结果显示,脾脏和胸腺中CD4+T、CD8+T细胞等各亚群的比例和GFP-组比较没有明显变化(图3A、B)。这说明let-7e对T细胞的发育分化没有影响;在骨髓和脾脏中,对B细胞分析的结果显示,GFP+细胞群中的B细胞总数(B220+)比例明显下降,通过B亚群比例分析发现B亚群明显减少(图4A~D),这说明了B细胞的发育受阻。
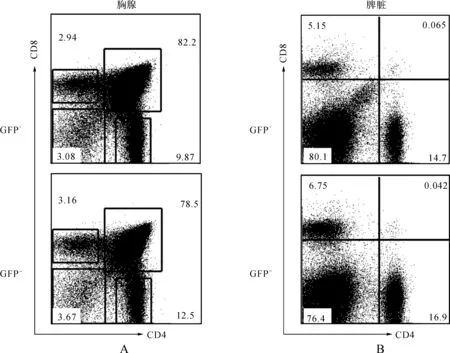
图3 let-7e嵌合小鼠中T细胞表型分析 A.胸腺中GFP+与GFP-的T细胞及亚群的比例; B.脾脏中GFP+与GFP-的T细胞及亚群的比例
Fig 3 Phenotype analysis of T cell subset in let-7e chimeric mice
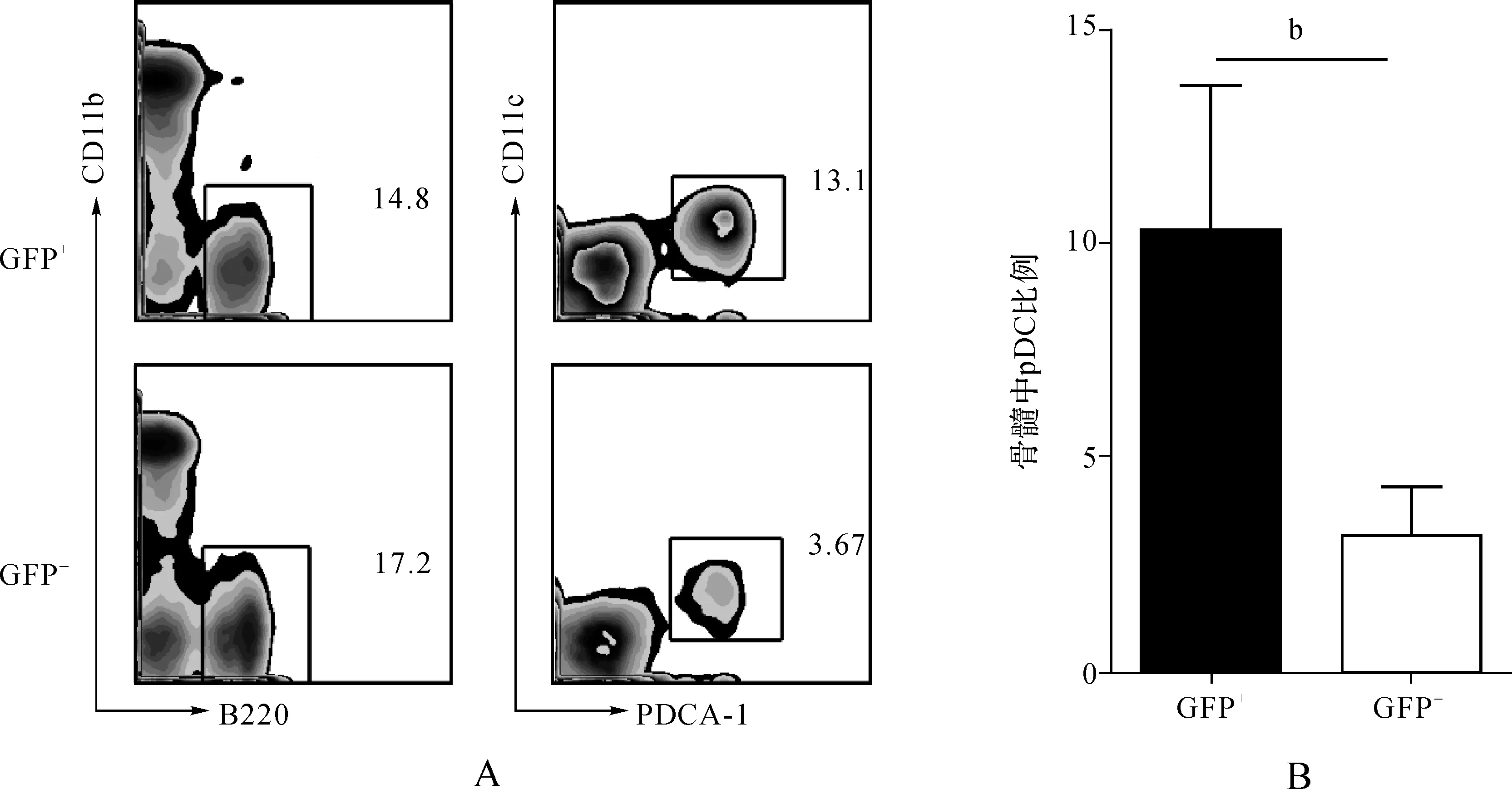
对DC的分析结果显示:脾脏中GFP+细胞群中浆细胞样DC(pDC)的比例与GFP-细胞群相比没有显著变化(图5A、B);骨髓中GFP+细胞群中pDC的比例与GFP-细胞群相比明显升高(图6A、B),从3%左右上升到10%。我们只检测了脾脏中经典DC(cDC)比例的变化,结果显示脾脏中GFP+细胞群中cDC比例较GFP-细胞群中有明显升高(图7A、B),达到2倍以上,这说明let-7e可能参与调控了DC的分化发育过程。
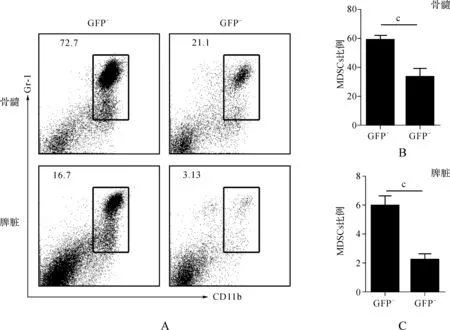
我们同时也检测了骨髓和脾脏中MDSCs的比例变化,结果发现GFP+细胞群中Gr-1+CD11b+MDSCs的比例明显高于GFP-细胞群的比例(图8A~C),根据统计结果MDSCs的比例升高了近2倍,结合MDSCs本身的作用,可能说明let-7e在MDSCs的增多和功能方面起着重要作用。
2.3 let-7e对MDSCs凋亡的抑制
为了说明骨髓和脾脏中GFP+细胞群中MDSCs的比例明显上升的原因(我们猜测let-7e可能是通过促进MDSCs的增殖或者是降低MDSCs自身的凋亡来实现这一结果的),我们首先在12 h向嵌合小鼠腹腔注射1 mg的Brdu,随后处死小鼠,取小鼠的骨髓和脾脏细胞制备单细胞悬浮液。对MDSCs的表面分子进行染色,然后对细胞进行胞内Brdu染色,流式细胞仪检测统计数据,结果发现GFP+和GFP-细胞群中MDSCs的增殖没有显著变化(图9)。同时,我们也对MDSCs的凋亡水平进行分析,流式细胞仪检测结果显示GFP+细胞群中MDSCs的凋亡跟GFP-相比明显降低(图10A、B)。
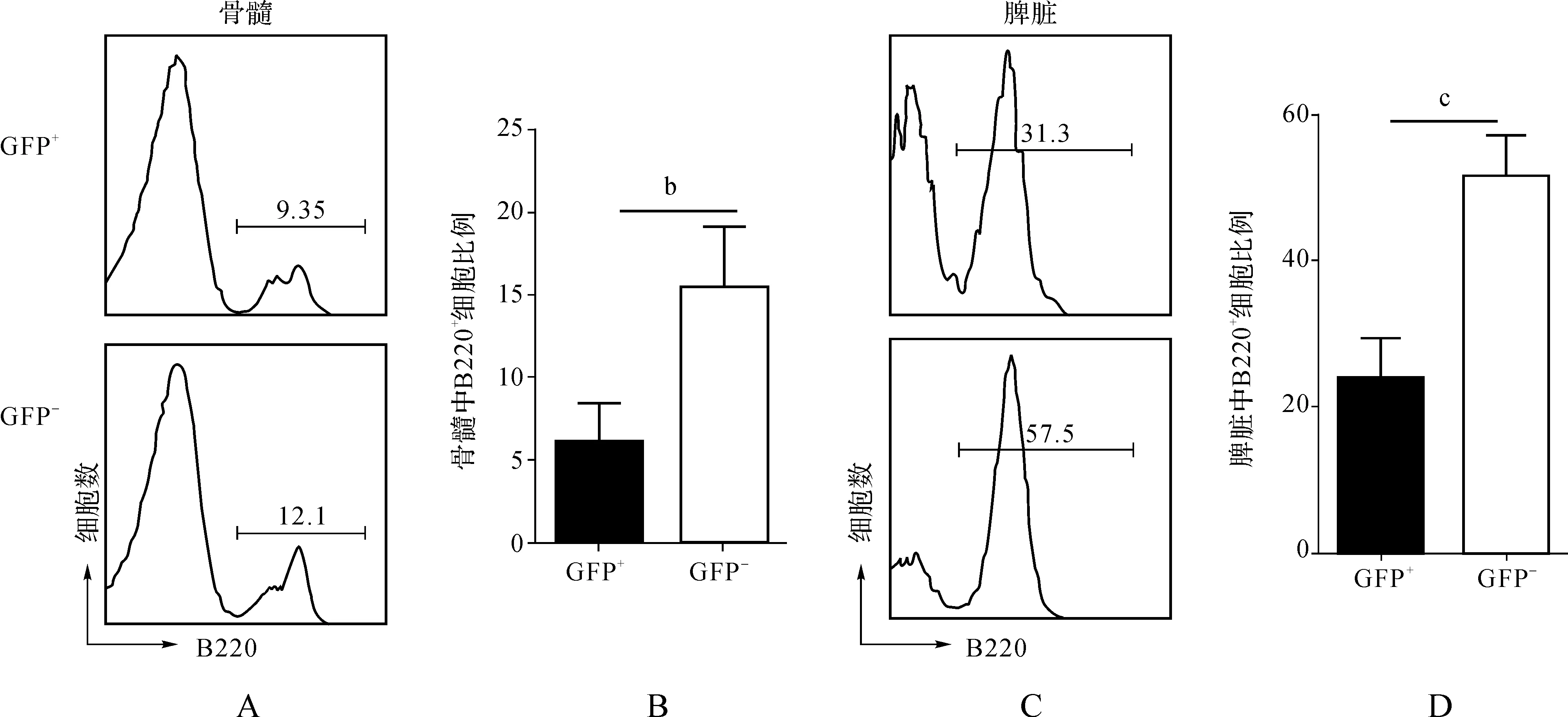
bP<0.05; cP<0.001
图4 let-7e嵌合小鼠中B细胞表型分析 A.骨髓中GFP+与GFP-的B220+B细胞的比例; B.骨髓中GFP+与GFP-中B220+B细胞的比例统计; C.脾脏中GFP+与GFP-的B220+B细胞的比例; D.脾脏中GFP+与GFP-中B220+B细胞比例统计(n>15)
Fig 4 Phenotype analysis of B cell in let-7e chimeric mice
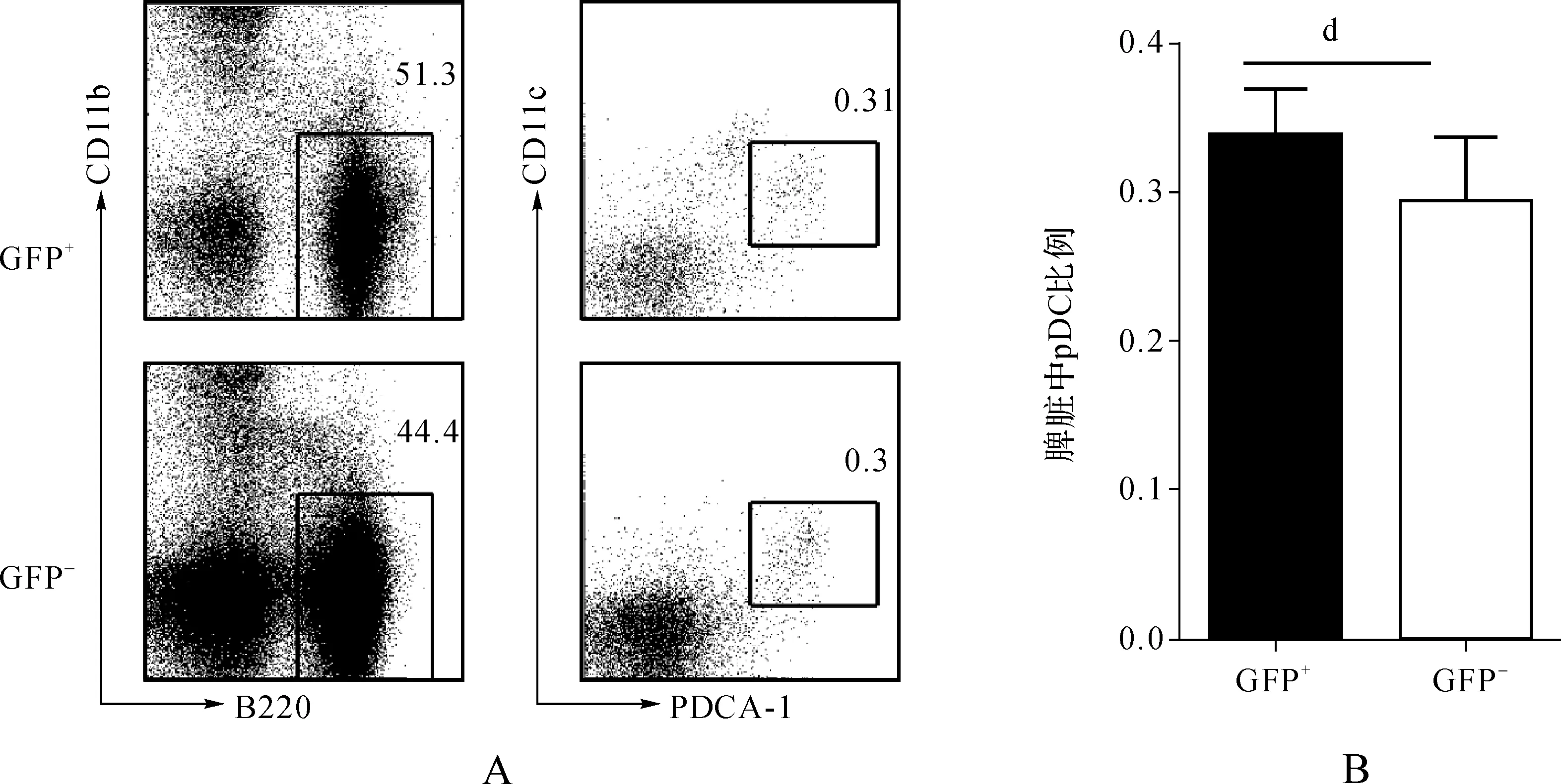
dP>0.05
图5 let-7e嵌合小鼠脾脏中pDC细胞表型分析 A.脾脏中GFP+与GFP-的pDC比例; B.脾脏中GFP+与GFP-中pDC比例统计(n>15)
Fig 5 Phenotype analysis of spleen pDCs in let-7e chimeric mice
3 讨 论
为了研究let-7e在淋巴细胞发育中的作用,我们构建了嵌合小鼠模型。首先,我们检测了骨髓、脾脏、胸腺中相应细胞群的比例变化,结果显示除了T细胞及其亚群没有发生变化外,其余类型细胞群都有变化。说明了let-7e在淋巴细胞发育中的重要性。本实验中
let-7e通过何种方式影响B细胞发育还有待进一步研究。我们同时发现了let-7e过表达后骨髓中pDC的增高和cDC的细胞群在脾脏中的增高,提示我们let-7e可能参与了促进DC分化的过程。在本研究中我们应用let-7e过表达嵌合小鼠模型研究发现,MDSC的比例明显升高,骨髓中MDSCs的比例可以升高3倍,脾脏中MDSCs的比例由3%可以升高5倍至16%,说
bP<0.05
图6 let-7e嵌合小鼠骨髓中pDC细胞表型分析 A.骨髓中GFP+与GFP-的pDC比例; B.骨髓中GFP+与GFP-中pDC比例统计(n>15)
Fig 6 Phenotype analysis of BM pDCs in let-7e chimeric mice

aP<0.01
图7 let-7e嵌合小鼠脾脏中cDC细胞表型分析 A.脾脏中GFP+与GFP-的cDC比例; B.脾脏中GFP+与GFP-中cDC比例统计(n>15)
Fig 7 Phenotype analysis of spleen cDCs in let-7e chimeric mice
明MDSCs增多较为明显,let-7e参与了MDSCs增多的过程。有很多报道说明microRNA与MDSCs相关,Mir-29a可以有效地促进髓样细胞的增殖,它可以有效地促进细胞周期中的细胞从G1期转向G2/S阶段,同时增加细胞存活能力[12];对研究最为广泛的mir-146,Baltimore等将其敲除后发现,骨髓和脾脏中MDSCs明显累积,并伴随着NF-κB的活化[13]。我们知道MDSCs不仅可以抑制T细胞的功能和增殖,而且还可以被炎症因子活化,启动下游JAK-STAT等信号通路,通过分泌抑制性功能因子达到调控炎症和肿瘤生长的作用。MDSCs的显著特点是在病理条件下显著扩增[14]。但究竟是何种因素导致MDSCs的扩增还不是很清楚。
cP<0.001
图8 let-7e嵌合小鼠中MDSCs细胞表型分析 A.骨髓和脾脏中GFP+与GFP-的MDSCs比例; B.骨髓中GFP+与GFP-的MDSCs比例统计; C.脾脏中GFP+与GFP-的MDSCs比例统计(n>15)
Fig 8 Phenotype analysis of MDSCs in let-7e chimeric mice

dP>0.05
图9 let-7e对嵌合小鼠MDSCs的增殖的影响Fig 9 Influence on MDSCs proliferation in let-7e chimeric mice
越来越多的报道表明不同条件下MDSCs扩增的机制不同。比如对造血干细胞和对前体细胞分化的调控,对成熟细胞分化的抑制,造成了MDSCs的自然增多;同时也可以通过调控MDSCs本身的状态来改变,比如通过促进增殖或者抑制凋亡使MDSCs比例升高,通过延长其细胞寿命,使MDSCs群体呈现增多的状态,甚至还可以通过表达更多的趋化受体,依据趋化因子的不同,转移到不同的地方或组织,从而显示MDSCs的增多。
事实上,以上MDSCs扩增过程中都有microRNA的参与。在本研究中,MDSCs在骨髓和脾脏中明显增多,这种增多是由于凋亡的减少实现的,而不是由于增殖能力的提高。仅从细胞凋亡的角度来说,let-7e是如何减少MDSCs的凋亡的还不得而知。根据之前在PC12细胞系中的报道[15],是否let-7e也调控了MDSCs细胞中凋亡下游效应分子如半胱氨酸蛋白酶家族(caspase),还需要在以后的实验中加以验证。总之,我们的实验解释了let-7e对淋巴细胞分化发育的影响,我们初步的实验结果证明,其中MDSC增多是由其凋亡减少造成的,给MDSCs扩增机制的研究提供了新的思路和方向。

aP<0.01; bP<0.05
图10 let-7e嵌合小鼠MDSCs的凋亡分析 A.骨髓和脾脏中GFP+细胞群及GFP-细胞群中MDSCs的凋亡表型分析; B.骨髓中GFP+与GFP-中MDSCs凋亡比例统计分析(n>15)
Fig 10 Analysis of MDSCs apoptosis in let-7e chimeric mice
在本研究中,过表达let-7e影响了不同细胞群,如B细胞、DC、MDSC的比例在中枢免疫器官以及外周中的变化。说明let-7e在固有免疫、适应性免疫、肿瘤免疫及炎症中应起着很重要的作用。本研究为进一步研究let-7e在相关细胞群中的作用提供了方向和基础。
[1] BALTIMORE D,BOLDIN M P,O’CONNELL R M,et al.MicroRNAs: new regulators of immune cell development and function[J].Nature Immunology,2008,9(8):839-845.
[2] 卢凯,许斌,陈恕求,等.mir-19a对于去势抵抗性前列腺癌细胞的增殖及凋亡的调控[J].现代医学,2013,41(9):613-616.
[3] LINDSAY M A.microRNAs and the immune response[J].Trends Immunol,2008,29(7):343-351.
[4] 李红英,王蓉,汪蕾.沉默microRNA-20a 对乳腺癌MCF7细胞表达NK细胞活化性受体MICA的研究[J].现代医学,2014,42(1):22-25.
[5] JINDRA P T,BAGLEY J,GODWIN J G,et al.Costimulation-dependent expression of microRNA-214 increases the ability of T cells to proliferate by targeting Pten[J].J Immunol,2010,185(2):990-997.
[6] RAO D S,O’CONNELL R M,CHAUDHURI A A,et al.MicroRNA-34a perturbs B lymphocyte development by repressing the forkhead box transcription factor Foxp1[J].Immunity,2010,33(1):48-59.
[7] KUIPERS H,SCHNORFEIL F M,BROCKER T.Differentially expressed microRNAs regulate plasmacytoidvsconventional dendritic cell development[J].Mol Immunol,2010,48(1-3):333-340.
[8] LI L,ZHANG J,DIAO W,et al.MicroRNA-155 and MicroRNA-21 promote the expansion of functional myeloid-derived suppressor cells[J].J Immunol,2014,192(3):1034-1043.
[9] LAGOS-QUINTANA M,RAUHUT R,LENDECKEL W,et al.Identification of novel genes coding for small expressed RNAs[J].Science,2001,294(5543):853-858.
[10] WULCZYN F G,SMIRNOVA L,RYBAK A,et al.Post-transcriptional regulation of the let-7 microRNA during neural cell specification[J].FASEB J,2007,21(2):415-426.
[11] GUAN H,FAN D,MRELASHVILI D,et al.MicroRNA let-7e is associated with the pathogenesis of experimental autoimmune encephalomyelitis[J].Eur J Immunol,2013,43(1):104-114.
[12] HAN Y C,PARK C Y,BHAGAT G,et al.microRNA-29a induces aberrant self-renewal capacity in hematopoietic progenitors,biased myeloid development,and acute myeloid leukemia[J].J Exp Med,2010,207(3):475-489.
[13] TAGANOV K D,BOLDIN M P,CHANG K J,et al.NF-kappaB-dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci U S A,2006,103(33):12481-12486.
[14] CONDAMINE T,GABRILOVICH D I.Molecular mechanisms regulating myeloid-derived suppressor cell differentiation and function[J].Trends Immunol,2011,32(1):19-25.
[15] PENG G,YUAN Y,HE Q,et al.MicroRNA let-7e regulates the expression of caspase-3 during apoptosis of PC12 cells following anoxia/reoxygenation injury[J].Brain Res Bull,2011,86(3-4):272-276.
Establishment of let-7e bone marrow chimeric mouse model and the analysis of immune phenotypes
SUN Di,XIA Fei,YANG Yi,CHEN Huo,ZHANG Jin-ping
(InstitutesofBiologyandMedicalSciences,SoochowUniversity,Suzhou215123,China)
Objective: To investigate the function of let-7e on the development of immunocytes. Methods: To study the function of let-7e on the development of immunocytes, the let-7e over-expression chimeric mouse were firstly established by retrovirus infection. Thereafter, the proliferation and apoptosis were evaluated by FACS. Results: Chimeric mouse model was successfully established and confirmed by FACS and qRT-PCR.FACS analysis showed that over-expressed let-7e decreased the percentage of B220+cells both in BM and spleen cells, increased the percentages of pDCs, cDCs,and MDSCs, but did not change the percentage of T cells and its subsets. Further experiments suggested that over-expressed let-7e increased the percentages of MDSCs by inhibiting the apoptosis of MDSCs, but did not alter their proliferation. Conclusion: let-7e is involved in lymphocyte differentiation and development; let-7e over-expression can increase the number of MDSCs by inhibiting apoptosis.
chimeric model; let-7e; immune phenotype; myeloid-derived suppressor cells; apoptosis
2015-05-03
2015-05-28
国家自然科学基金面上项目(31270939,81471526);组织器官区域免疫特性与疾病重大研究计划培育项目(91442110);江苏省自然科学基金面上项目(BK2012617);江苏省高校自然科学研究重大项目(13KJA310004)
孙迪(1988-),男,安徽阜阳人,在读硕士研究生。E-mail:adiok0903@126.com
张进平 E-mail:j_pzhang@suda.edu.cn
孙迪,夏菲,杨燚,等.let-7e嵌合小鼠模型的建立和表型分析[J].东南大学学报:医学版,2015,34(5):696-704.
R392.9; R-33
A
1671-6264(2015)05-0696-09
10.3969/j.issn.1671-6264.2015.05.004

