荔枝壳原花青素对脓毒症大鼠心肌细胞凋亡的作用及其机制研究
张晓晖,孙智达,李书艺,曾繁典,熊益群,徐超英,刘心亮,林 坚,穆桂萍,徐绍钢,刘文赫(.深圳市中医院中医药研究所,广东深圳 580;.华中农业大学食品科学技术学院,湖北武汉 0070; .武汉轻工大学食品科学与工程学院,湖北武汉 00;.华中科技大学同济医学院药理系,湖北武汉 000)
荔枝壳原花青素对脓毒症大鼠心肌细胞凋亡的作用及其机制研究
张晓晖1,孙智达2,李书艺3,曾繁典4,熊益群1,徐超英1,刘心亮1,林坚1,穆桂萍1,徐绍钢1,刘文赫1
(1.深圳市中医院中医药研究所,广东深圳518033;2.华中农业大学食品科学技术学院,湖北武汉430070; 3.武汉轻工大学食品科学与工程学院,湖北武汉430023;4.华中科技大学同济医学院药理系,湖北武汉430030)
中国图书分类号: R-332; R284.1; R322.11; R329.25; R631. 022
摘要:目的研究荔枝壳原花青素(Procyanidins extracted from the litchi pericarp,LPPC)对脓毒症大鼠心肌细胞凋亡的作用及其机制。方法实验大鼠随机分为5组,连续灌胃两周:空白对照组(control)和脓毒症模型组(LPS)每天给予蒸馏水灌胃1次; LPPC低、中、高剂量组分别每天给予新鲜配制的LPPC 50,100,200 mg·kg-1·d-1灌胃1次。给药结束后,建立脓毒症动物模型。即除空白对照组外所有大鼠腹腔内注射LPS(lipopolysacchride,10mg·kg-1,ip)诱导急性脓毒症模型。4 h后收集大鼠血清,检测血清同工酶(CKMB)、乳酸脱氢酶(LDH)和谷草转氨酶(AST/GOT)的活力。取大鼠心肌组织,测定心肌组织丙二醛(MDA)、总抗氧化能力(T-AOC)和还原型谷胱甘肽(GSH)含量。TUNEL染色观察大鼠心肌细胞凋亡情况。Western blot法检测凋亡相关蛋白Cleaved caspase-3及TNF-α水平。结果与正常对照组(control)比较,脓毒症模型组大鼠血清CK-MB、LDH、AST/GOT以及心肌组织MDA含量均明显升高(P<0. 01);同时,心肌组织T-AOC和GSH的活力明显降低(P<0. 01);凋亡心肌细胞数量明显增加(P<0. 01); Cleaved caspase-3及TNF-α表达水平明显下降(P<0. 01)。LPPC预处理明显降低了大鼠血清CK-MB、LDH、AST/GOT以及心肌组织MDA含量;增加了大鼠心肌组织T-AOC和GSH的活力;凋亡心肌细胞数量明显减少; Cleaved caspase-3及TNF-α表达水平明显下降。结论荔枝壳原花青素预处理能够明显减轻脓毒症大鼠心肌细胞凋亡,可能与其抗氧化性损伤作用有关。
关键词:荔枝壳原花青素;脓毒症;心肌细胞;凋亡;氧化应激;大鼠
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.009.html
原花青素是自然界来源丰富的多酚类植物化合物,由不同数量的儿茶素或表儿茶素结合而成。20世纪中叶法国科学家马斯·魁勒首次阐明松叶泡汁中的原花青素和维生素C都是防治坏血病的有效物质,从而为原花青素的应用指明了前景[1]。原花青素广泛存在于多种植物中,目前已发现其在葡萄籽、莲子壳、荔枝壳、松树皮、废弃油菜籽皮、蚕豆皮、沙棘籽、高粱种皮、黑豆等中含量均较丰富。除了抗氧化活性外,它还具有多种生物学活性,如抗炎[2]、抗肿瘤[3]、保护心血管[4]等,其中以抗氧化及清除自由基的功能最为突出。其抗氧化的效果远远优于维生素C、维生素E和β-胡萝卜素等传统抗氧化剂。
荔枝(Litchi chinesis Sonn.)是无患子科常绿植物所结果实,我国主要产于广东、福建、广西等地,是亚洲特产水果,深圳的“南山荔枝”更是享誉海内外。其营养丰富,味甜肉嫩,色泽鲜艳,素有“岭南果王”之称。荔枝壳重量占果实总重的16%左右,含有多种活性成分,其药用价值很高,早在明朝李时珍就曾在《本草纲目》中记载:果壳、果核可入药,治鼻衄、疗疝气、止血止痛。近代的一些研究也提示荔枝壳中富含类黄酮,如黄酮醇、花青素和原花青素等生物活性物质。荔枝壳原花青素(Procyanidins extracted from the litchi pericarp,LPPC)是华中农业大学食品科技学院天然作物实验室率先从荔枝果壳中提取出,并通过结构鉴定和功能分析,确定荔枝壳中的原花青素包括A型和B型两种,以A型为主,延伸单元和末端单元为表儿茶素,通过4→8,2→O→7 或4→6,4→8连接而成。目前研究发现,LPPC具有良好的抗氧化清除自由基[5]、体外抑菌活性[6]、抗动脉粥样硬化作用[7]及抗癌活性[8]。本课题旨在研究LPPC是否对脓毒症大鼠心肌细胞凋亡的具有保护作用,并寻找其作用机制,从而找到其新的作用靶点,为开发利用LPPC脓毒症心血管保护的功能提供理论依据,寻找LPPC的潜在利用价值。
1 材料与方法
1.1主要材料
1.1.1实验动物健康成年♂SD大鼠,体质量250~300 g,购自广东省实验动物中心。
1.1.2药品荔枝壳原花青素(LPPC)由华中农业大学食品科学技术学院孙智达教授提供。LPPC溶解性好,可直接溶解于蒸馏水制成溶液,灌胃给药。
1.1.3试剂cleaved caspase-3一抗、TNF-α一抗(Cell Signaling Technology),HRP标记二抗、ECL(Forevergen),TUNEL试剂盒(Roche),CK-MB ELISA试剂盒(武汉华美生物工程有限公司);乳酸脱氢酶(LDH)试剂盒、谷草转氨酶(AST/GOT)测试盒、丙二醛(MDA)含量、总抗氧化能力测定试剂盒、还原型谷胱甘肽(GSH)测定试剂盒(分光光度法)均为南京建成生物工程有限公司产品。
1.2分组与造模实验动物适应性喂养2周后,随机分为5组,连续灌胃两周:空白对照组(control,CON)和脓毒症对照组(LPS)每天给予蒸馏水灌胃1 次; LPPC低剂量组、中剂量组、高剂量组分别每天给予新鲜配制的LPPC 50、100、200 mg·kg-1·d-1灌胃1次。
给药结束后,建立脓毒症动物模型。即除空白对照组外所有大鼠腹腔内注射LPS(10 mg·kg-1,ip)诱导急性脓毒症模型。LPS处理4 h后,出现竖毛、淡漠、腹泻等脓毒症体征的清醒大鼠被用于实验。正常对照组动物注射生理盐水(1 ml·kg-1,ip)。
4 h后,以4%水合氯醛麻醉大鼠,打开腹腔,行腹主动脉取血。全血经室温静置2 h后4℃1 000× g离心30 min,收集上清液,分装于-80℃冻存。摘取心脏分为两部分,一部分用4℃预冷的多聚甲醛(PFA)固定;另一部分液氮冻存备用。
1.3检测指标
1.3.1血清心肌酶学指标检测血液离心后取上清,按照试剂盒说明制作标准曲线,测定血清同工酶(CK-MB)、乳酸脱氢酶(LDH)和谷草转氨酶(AST/GOT)的活力。
1.3.2心肌组织抗氧化能力检测取左心室心肌组织,制备组织匀浆,按照试剂盒说明制作标准曲线,测定心肌组织丙二醛(MDA)含量、总抗氧化能力(T-AOC)和还原型谷胱甘肽(GSH)含量。
1.3.3 TUNEL法检测心肌细胞凋亡心肌组织固定,制作蜡块切片,应用末端脱氧核糖核苷酸转移酶介导的dUTP缺口末端标记法(TUNEL)检测凋亡心肌细胞。按照TUNEL试剂盒说明书逐步添加试剂,光学显微镜下观察、拍照。每个心脏观察3张切片,每张切片随机选取5个非重叠的400×高倍镜视野,计算凋亡指数AI(凋亡心肌细胞数/心肌细胞总数×100%),求其均值。
1.3.4 Western blot法检测凋亡相关蛋白水平采用预冷的PBS冲洗心室肌组织,冰上剪碎,充分匀浆,以5 000 r·min-1离心10 min,弃上清后加入裂解液,12 000 r·min-1离心10 min,取上清于低温冰箱保存。采用BCA法检测蛋白浓度。将蛋白与上样缓冲液混匀后煮沸10 min。每孔取30μg蛋白质上样,行15%SDS-PAGE聚丙烯酰胺凝胶电泳,采用半干转法转膜,加入5%脱脂奶粉室温封闭2 h,分别加入Cleaved caspase-3(1∶1 000)及TNF-α(1∶1 000)的一抗,4℃孵育过夜,同时以GAPDH作为内参(1∶5 000),加入二抗(1∶3 000)室温孵育1 h。采用化学发光法进行胶片显影,采用Image J进行目的条带的光密度分析,最终结果以目的条带的光密度与内参的比值作为最终结果。
1.4统计学分析采用SPSS 11. 5软件进行统计分析,计量资料以±s表示,组间均数比较采用方差分析。
2 结果
2.1 LPPC对脓毒症大鼠血清CK-MB、LDH以及AST的影响CK-MB、LDH和AST是一系列心肌损伤血清标记物。如Tab 1所示,脓毒症模型组大鼠血清CK-MB、LDH和AST各项指标相比正常对照组都有明显的提高(P<0. 01),说明脓毒症能明显提高大鼠血清心肌酶谱指标水平。经LPPC预处理后,LPPC各剂量组均不同程度降低脓毒症大鼠血清CK-MB水平(P<0. 05)。LPPC中、高剂量组能明显降低脓毒症大鼠血清LDH水平(P<0. 05)。LPPC高剂量组能明显降低脓毒症大鼠血清AST水平(P <0. 01)。说明应用LPPC后,可在一定程度上改善LPS诱导的大鼠心肌细胞损伤。
Tab 1 Effect of LPPC on serum CK-MB,LDH and AST of septic rat(±s,n =10)

Tab 1 Effect of LPPC on serum CK-MB,LDH and AST of septic rat(±s,n =10)
Group CK-MB/U·L-1 LDH/U·L-1 AST/U·L-1Control 197.21±26.92 350.96±22.84 197.19±32.22 LPS 257.67±29.88**775.70±38.28**402.62±26.82**LPPC 50 mg·kg-1·d-1 230.34±21.76△ 746.12±30.69 377.22±40.23 LPPC 100 mg·kg-1·d-1 227.40±33.69△ 726.64±42.87△ 353.68±50.57 LPPC 200 mg·kg-1·d-1 218.76±38.00△ 677.06±59.59△ 331.66±54.15△△**P<0. 01 vs control group;△P<0. 05,△△P<0. 01 vs LPS group
2.2 LPPC对脓毒症大鼠心肌组织MDA、GSH以及T-AOC的影响如Tab 2所示,脓毒症模型组大鼠心肌组织MDA含量明显高于正常组(P<0. 01),而GSH和T-AOC的水平明显低于正常组(P<0. 01),说明脓毒症模型动物氧化应激水平高于正常。经LPPC预处理后,LPPC各剂量组均不同程度降低脓毒症大鼠心肌组织MDA含量(P<0. 05或P <0. 01),并具有剂量依赖性。LPPC高剂量组能明显降低脓毒症大鼠心肌组织GSH含量(P<0. 05)。LPPC中、高剂量组能明显降低脓毒症大鼠心肌组织T-AOC水平(P<0. 05或P<0. 01)。说明应用LPPC后,可在一定程度上改善LPS诱导的大鼠心肌细胞氧化应激水平。
Tab 2 Effect of LPPC on cardiac tissue MDA,GSH and T-AOC of septic rat(±s,n =10)

Tab 2 Effect of LPPC on cardiac tissue MDA,GSH and T-AOC of septic rat(±s,n =10)
**P<0. 01 vs control group;△P<0. 05,△△P<0. 01 vs LPS group
Group MDA/μmol·g-1Pro GSH/kU·g-1Pro T-AOC/kU·g-1Pro Control 3.63±0.44 22.24±2.93 4.30±0.48 LPS 7.97±0.53** 14.85±2.50** 2.12±0.69**LPPC 50 mg·kg-1·d-1 7.10±0.66△△ 14.53±3.31 2.33±0.50 LPPC 100 mg·kg-1·d-1 5.98±0.73△△ 17.36±3.77 2.68±0.47△LPPC 200 mg·kg-1·d-1 5.38±0.70△△ 17.55±2.40△ 3.98±0.88△△**P<0. 01 vs control group;△P<0. 05,△△P<0. 01 vs LPS group
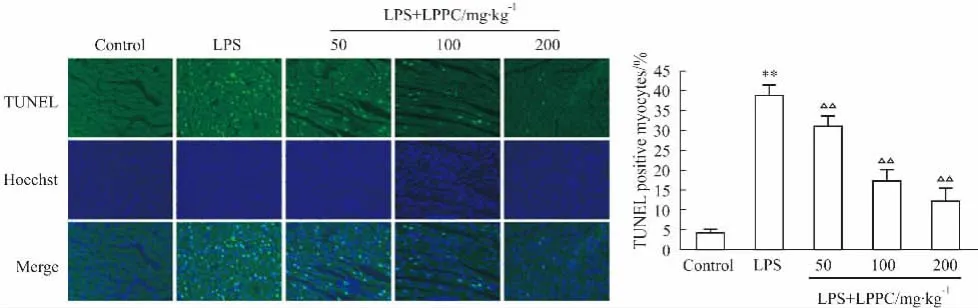
Fig 1 Level of rat cardiac myocytes apoptosis detected by TUNEL staining(±s)**P<0. 01 vs control group;△△P<0. 01 vs LPS group
2.3 LPPC对脓毒症大鼠心肌细胞凋亡的影响
TUNEL法染色检测心肌细胞凋亡的情况见Fig 1。与Control组相比,单纯LPS处理组大鼠心肌细胞AI值明显上升(P<0. 01),说明脓毒症大鼠心肌中有大量心肌细胞凋亡。LPS + LPPC各处理组与单纯LPS处理组相比,AI值均不同程度下降(P<0. 01),且具有剂量依赖性。说明应用LPPC后,可有效抑制LPS诱导的大鼠心肌细胞凋亡。
2.4 LPPC对脓毒症大鼠心肌组织Cleaved caspase-3和TNF-α蛋白表达的影响Cleaved caspase-3和TNF-α蛋白在正常对照组(Control组)的大鼠心肌组织中几乎不表达。单纯LPS处理组与Control组相比,Cleaved caspase-3和TNF-α蛋白表达水平明显升高(P<0. 01)。LPS + LPPC各处理组与单纯LPS处理组相比,Cleaved caspase-3和TNF-α蛋白表达水平均不同程度下降(P<0. 05或P<0. 01),且具有剂量依赖性。
3 讨论
脓毒症(sepsis)是由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),是创伤、烧伤、休克、感染、大手术等临床急危重患者的严重并发症之一,也是诱发脓毒性休克(septic shock)、多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的重要原因。脓毒症合并心功能衰竭,死亡率高达70%~90%[9],临床救治相当困难。近来的研究发现,脓毒症心功能不全与细胞凋亡[10]有关。凋亡是细胞在一定的生理或病理条件下,受内在机制的控制主动结束生命的过程,并伴随有典型的形态学改变,常涉及半胱氨酸蛋白酶(caspases)或TNF-α等促凋亡介质的活化。
我们的研究结果发现,与正常对照组大鼠比较,脓毒症模型组大鼠凋亡心肌细胞数量明显增加,caspase-3及TNF-α表达水平明显下降(P<0. 01)。LPPC预处理能减少凋亡心肌细胞数量以及caspase-3和TNF-α的表达。可能与其抗氧化性损伤有关。
最近的研究表明,氧化应激在脓毒症心肌细胞凋亡的发生、发展过程中发挥了重要作用[11]。脓毒症心肌可产生大量的活性氧(ROS),后者可导致心肌细胞膜的脂质双分子层发生过氧化反应,使其功能和活性降低,造成心肌细胞损伤;同时ROS也可损害线粒体膜,引起caspase-3活化,继而启动凋亡程序,导致心肌细胞损伤。MDA是一种重要的细胞膜脂质过氧化反应产物,其在组织中的含量可直接反应机体脂质过氧化的强度;而体内的抗氧化系统,如GSH等则能减少氧自由基对细胞的损伤,可用来评价机体清除氧自由基的能力。本研究结果发现,脓毒症大鼠心肌组织MDA含量明显增高,而GSH,T-AOC水平明显下降,提示脓毒症大鼠体内氧化应激明显增强。经LPPC预处理的脓毒症大鼠MDA含量明显减少,GSH,T-AOC水平明显恢复,说明LPPC用于预防脓毒症心肌细胞凋亡可能与其抗氧化应激作用有关。

Fig 2 Expression level of rat cardiac tissue caspase-3 and TNF-α by Western blot analysis(n =4,±s)**P<0. 01 vs control group;△P<0. 05,△△P<0. 01 vs LPS group
TNF-α是参与脓毒症全身炎性反应的重要炎症介质之一,心肌细胞是TNF-α的靶细胞,其自身也可分泌TNF-α,心肌组织中TNF-α的含量可用来反映脓毒症心肌组织炎症的程度。本实验观察到,脓毒症大鼠中TNF-α水平明显升高(P<0. 01),而LPPC预处理可以抑制脓毒症大鼠心肌组织中TNF-α水平的升高(P<0. 01),提示其可以通过减少心肌组织中炎症因子TNF-α的浸润发挥抗炎作用,达到保护心脏的目的。
Caspase-3是一类天冬氨酸特异性的半胱氨酸蛋白酶,其激活在心肌细胞凋亡的发生中起重要的作用。Caspase-3是凋亡的最终执行者,在凋亡级联激活中处于核心地位[12]。我们的研究发现,在脓毒症大鼠心肌组织中,caspase-3蛋白表达水平升高(P<0. 01),而LPPC干预可以使其表达水平部分恢复,说明LPPC正是通过抑制具有生物活性功能的caspase-3的产生,从而降低脓毒症大鼠心肌细胞凋亡率,减轻心肌损害。LPPC干预确有抗脓毒症大鼠心肌组织细胞凋亡的作用。
本实验结果显示,脓毒症大鼠血清CK-MB、LDH、AST/GOT以及心肌组织MDA含量均明显升高,同时,心肌组织T-AOC和GSH的活力明显降低,提示心肌损伤明显。心肌组织中凋亡细胞数量明显增多,且心肌组织中Cleaved caspase-3及TNF-α含量明显增高,提示脓毒症大鼠心肌损伤的发生与TNF-α以及细胞凋亡有关。在给予不同剂量的LPPC预处理后,明显降低了大鼠血清CK-MB、LDH、AST/GOT以及心肌组织MDA含量;增加了大鼠心肌组织T-AOC和GSH的活力;凋亡心肌细胞数量明显减少; Cleaved caspase-3及TNF-α表达水平明显下降。说明荔枝壳原花青素预处理能够明显减轻脓毒症大鼠心肌细胞凋亡,可能与其减轻炎症介质的产生以及抗氧化应激性损伤作用有关。
致谢:本文实验在深圳市中医院国家中医药科研三级实验室(No: TCM-2009-289)完成,在此表示衷心感谢。
参考文献:
[1]凌智群,张晓晖,谢笔钧,曾繁典.原花青素的药理学研究进展[J].中国药理学通报,2002,18(1):9-12.
[1]Ling Z Q,Zhang X H,Xie B J,Zeng F D.Review on the pharmacological research of procyanidins[J].Chin Pharmacol Bull,2002,18(1): 9~12.
[2]Chacón M R,Ceperuelo-Mallafré V,Maymó-Masip E,et al.Grape-seed procyanidins modulate inflammation on human differentiated adipocytes in vitro[J].Cytokine,2009,47(2): 137-42.
[3]Hsu C P,Lin Y H,Chou C C,et al.Mechanisms of grape seed procyanidin induced apoptosis in colorectal carcinoma cells[J].Anticancer Res,2009,29(1): 283-9.
[4]张晓晖.葡萄籽原花青素体外抗血小板聚集的机制研究[J].中国病理生理杂志,2012,28(4): 714-7.
[4]Zhang X H.In vitro anti-platelet aggregative effect of procyanidins isolated from grape seeds[J].Chin J Pathophys,2012,28(4): 714-7.
[5]周玮婧.荔枝皮原花青素的提取、纯化以及抗氧化活性研究[D].2010,华中农业大学.
[5]Zhou W J.Ph.D.Thesis: Extraction,purification and antioxida-tion of procyanidins from Litchi chinensis pericarp[D].2010,Huazhong agriclulture university.
[6]周玮婧,侣国涵,孙智达,等.荔枝皮黄酮抑菌性能及其作用机理研究[J].天然产物研究与开发,2011,23(2):332-6.
[6]Zhou W J,Lv G H,Sun Z D,et al.Antimicrobial activity and mechanism of flavonoids from litchi pericarp[J].Nat Prod Res Dev,2011,23(2): 332-6.
[7]荣爽.荔枝壳原花青素对动脉粥样硬化的保护作用及其机制研究[D].华中科技大学,2012.
[7]Rong S.Study on the protective effects and the mechanisms of procyanidins extracted from the litchi pericarp on atherosclerosis in ApoE knockout mice[D].Huazhong university of science and technology,2012.
[8]王修杰.荔枝果皮提取物的抗癌活性及作用机理[D].四川大学,2004.
[8]Wang X J.Anticancer activities of extract from litchi fruit pericarp and mechanism of its action[D].Sichuang university,2004.
[9]Merx M W,Weber C.Sepsis and the heart[J].Circulation,2007,116(7): 793-802.
[10]Lancel S,Joulin O,Favory R,et al.Ventricular Myocyte Caspases Are Directly Responsible for Endotoxin-Induced Cardiac Dysfunction[J].Circulation,2005,111(20): 2596-604.
[11]Balija T M,Lowry S F.Lipopolysaccharide and sepsis-associated myocardial dysfunction[J].Curr Opin Infect Dis,2011,24(3): 248-53.
[12]Yuste V J,Sánchez-López I,Solé C,et al.The contribution of apoptosis-inducing factor,caspase-activated DNase,and inhibitor of caspase-activated DNase to the nuclear phenotype and DNA degradation during apoptosis[J].J Biol Chem,2005,280(42): 35670-83.
Protective effects of LPPC on cardiomyocyte apoptosis in septic rats
ZHANG Xiao-hui1,SUN Zhi-da2,LI Shu-yi3,ZENG Fan-dian4,XIONG Yi-qun1,XU Chao-ying1,LIU Xin-liang1,LIN Jian1,MU Gui-ping1,XU Shao-gang1,LIU Wen-he1
(1.Chinese Medicine Institute of Shenzhen TCM Hospital,Shenzhen Guangdong 518033,China;
2.College of Food Science and Technology of Huazhong Agriclultual University,Wuhan 430070,China;
3.College of Food Science and Engineering of Wuhan Polytechnic University,Wuhan 430023,China;
4.Tongji Medical College of Huazhong University of Science and Technology,Wuhan 430030,China)
Abstract:Aim To explore the protective effects of LPPC(procyanidins extracted from the litchi pericarp)on cardiomyocyte apoptosis in septic rats and its mechanisms.Methods The rats were randomly divided into 5 groups,and were given orally the drug for two weeks continuously.The control group(control)and sepsis model group(LPS)were given distilled water once a day.LPPC low,medium and high dose groups were given LPPC 50,100,200 mg·kg-1·d-1respectively which were prepared freshly every day.After the treatment,sepsis animal models were established.Except for the control group,other groups were injected LPS(lipopolysacchride,10mg·kg-1)intraperitoneally to induce acute sepsis model.4hrs later,rat serum was collected,isoenzyme(CK-MB),lactate dehydrogenase(LDH)and activity of aspertate aminotransferase(AST/GOT)were detected.Then rat cardiac tissue was obtained and cardiac tissue malondialdehyde(MDA),total antioxidant capacity(T-AOC)and reduced glutathione(GSH)content were determined.TUNEL staining was performed to analyze the apoptosis of myocardial cells.Cleaved caspase-3 and TNF alpha protein expressions were analyzed by Western blot.Results Compared with the control group(control),serum of sepsis model group rats CK-MB,LDH,AST/GOT and cardiac tissue MDA content were significantly increased(P<0. 01).At the same time,the activity of cardiac tissue T-AOC and GSH decreased obviously(P<0. 01).The apoptotic myocardial cells increased significantly(P<0. 01),and the expression level of cleaved caspase-3 and TNF alpha decreased obviously(P<0. 01).LPPC pretreatment significantly decreased the serum CK-MB,LDH,AST/GOT and tissue MDA content,increased tissue T AOC and GSH activity,attenuated apoptosis of rat myocardial cells significantly,and decreased expression level of cleaved caspase-3 and TNF alpha.Conclusion LPPC pretreatment can significantly attenuate rat myocardial cell apoptosis induced by sepsis,and the underlying mechanisms may be related to its anti-oxidative effects.
Key words:LPPC; sepsis; cardiomyocyte; apoptosis; oxidative stress; rat
作者简介:张晓晖(1975-),女,博士,副主任药师;研究方向:心血管药理学、中药药理学,通讯作者,Tel: 0755-88359666,E-mail:767682665@ qq.com
基金项目:国家自然科学基金资助项目(No 81101450);深圳市科技研发资金知识创新计划资助项目(No JCYJ20130329 155553734)
收稿日期:2015-03-09,修回日期:2015-03-27
文献标志码:A
文章编号:1001-1978(2015)07-0931-05
doi:10.3969/j.issn.1001-1978.2015.07.009