应用简便的逆转录环介导等温扩增方法检测腮腺炎病毒核酸
应用简便的逆转录环介导等温扩增方法检测腮腺炎病毒核酸
李宏宇1,王爽2,周剑惠2,陈超2,季尚玮3*
(1.吉林省肿瘤医院,吉林 长春130012;2.吉林省疾病预防控制中心;3.吉林大学中日联谊医院)
流行性腮腺炎(简称腮腺炎)是由腮腺炎病毒(Mumps Virus,MuV)感染引起的急性呼吸道传染病,经空气飞沫传播,全年均可发病,以冬春季高发,人类是该病毒的惟一宿主,好发于儿童和青少年,传染性仅次于麻疹和水痘,是一种在全球流行的急性传染病,临床以腮腺非化脓性肿胀、疼痛伴发热为主要症状。2004-2006年我国的腮腺炎爆发占公共卫生事件的20%左右[1,2]。目前对腮腺炎病毒的检测分为病原学、血清学和分子生物学[3-6]。传统的病原学和血清学诊断技术以及目前广泛应用的核酸诊断技术都有不同程度的欠缺。随着分子生物学技术的不断发展,逆转录环介导等温扩增方法RT-LAMP技术的问世[7],使核酸检测更加快速、便捷、特异。国内已报道将该方法应用于麻疹病毒及风疹病毒核酸检测[8,9],本文应用该方法进行腮腺炎病毒的核酸检测[10],获得满意结果,现报告如下。
1材料与方法
1.1 腮腺炎病毒株
咽拭子经组织培养后获得腮腺炎病毒株。
1.2 试剂及仪器
RNA提取采用罗氏公司的自动核酸提取仪及配套试剂盒进行提取。RT-PCR: RNA酶抑制剂、AMV逆转录酶、DTT、BSA、TaqDNA聚合酶等RT-PCR所需试剂由日本TAKARA公司生产,PCR仪为ABI公司型号为9700。LAMP: Bst DNA polymerase以及AMV逆转录酶由New England Biolabs公司生产。
1.3 方法
1.3.1病毒分离咽拭子标本接种在Vero/SLAM细胞(淋巴信号激活因子转染的非洲绿猴肾细胞)上,36.5℃培养,当CPE≥75%时收集细胞和培养液。如为阴性,连续观察3代,每代7-9 d。
1.3.2核酸提取按操作程序及说明书操作,提取后的RNA若不立即使用,可于-80℃保存备用。
参考文献1.3.3RT-PCR引物序列、操作程序见[11]。
1.3.4LAMP的反应体系和条件
(1)配置2倍浓度反应液(1.0 ml)dNTP(10 mmol/L)0.28 ml,10×Bst Buffer 0.2 ml,MgSO4(0.1 mol/l)0.12 ml,Betain(4 mol/L)0.4 ml。
(2)配置引物混合液(120 μl)BIP(100 μmol/L)8 μl,FIP(100 μmol/L)8 μl,B3(100 μmol/L)1 μl,F3(100 μmol/L)1 μl,Bloop(100 μmol/L)4 μl,Floop(100 μmol/L)4 μl,DDW94 μl。
(3)反应体系(25 μl)反应混合液12.5 μl,引物混合液6 μl,BST(8 000 U/ml)1 μl,AMV(5 U/μl)0.1 μl,RNA5 μl,DDW0.4 μl。
(4)反应条件将反应体系于水浴锅中63℃(±0.5℃)水浴1 h,得到LAMP产物。
1.4 LAMP引物序列及酶切位点
在LAMP反应产物中,每形成一个哑铃状茎环结构,都有腮腺炎病毒特异性酶切位点GTGCAC,因此使用内切酶对LAMP产物进行特异性酶切,电泳后根据是否获得酶切后的单一条带来证实腮腺炎病毒核酸。
1.5 LAMP产物酶切鉴定及电泳
酶切按10.5 μl体系进行鉴定。取LAMP产物0.5 μl、ALw44 I 内切酶1.0 μl、10×Buffer 1.0 μl以及DDW8 μl。对照管取LAMP产物0.5 μl、DDW 10 μl。37℃(±0.5℃)水浴1 h。使用1.7%的琼脂糖凝胶进行电泳,观察结果。
2结果
2.1 病毒分离结果
对23份咽拭子进行病毒分离,均未观察到CPE,需进行病毒核酸检测。
2.2 腮腺炎病毒LAMP扩增产物及其酶切鉴定结果
图1所显示的标记为“1、2”的是腮腺炎病毒株,经RT-PCR证实腮腺炎病毒核酸阳性,经LAMP方法扩增、酶切、电泳后出现典型的LAMP梯状条带(图1 A道 ),但经特异的限制性内切酶ALw44 I酶切后只呈现出单一的条带(图1 B道)。
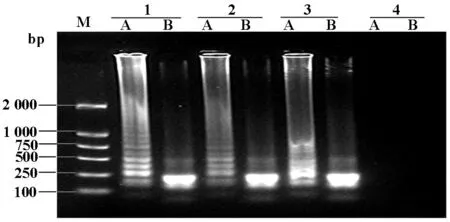
M:DL-2000 DNA分子量对照;1~2:腮腺炎病毒株;3:腮腺炎疫苗株;4:阴性对照A: LAMP 产物梯形图谱; B:酶切后的LAMP单一条带
图1LAMP电泳条带
2.3 腮腺炎病毒核酸RT-PCR与RT-LAMP检测比较
因23份标本的病毒分离均为阴性,故分别利用RT-LAMP和RT-PCR两种方法进行腮腺炎病毒核酸检测,检测结果一致,阳性率均为30.4%(7/23)。
3讨论
腮腺炎病毒感染的诊断主要依靠临床诊断和实验室诊断。临床诊断依据以是否观察到腮腺肿大,而对于不典型腮腺炎患者仍需要进行实验室诊断。实验室诊断通常采用病毒分离和血清学检测的方法,病毒分离的时效性依毒株效价的强弱,且并非全部观察到CPE,故需进行进一步核酸鉴定;血清学通常以间隔28 d采集前后两份血清,血清IgG抗体呈4倍(或4倍以上)增高的方法进行鉴定,其耗时长、且28 d后第二份标本难采集;急性期腮腺炎患者亦可采用酶联免疫吸附试验检测血清中IgM,但即使腮腺肿大,3 d内采集的血清IgM检测仍存在阴性的可能[5]。目前RT-PCR 方法被广泛应用于腮腺炎病毒核酸检测[3,5,6],其灵敏度高、特异性强,但该方法须使用PCR仪。Nakayama等建立了腮腺炎病毒核酸的LAMP检测方法[10],结合Mori等[12]研制出的专门用于LAMP产物检测的实时监控浊度仪对该方法进行了敏感性和特异性证明。由于该浊度仪目前尚无法在国内购得,故本实验对LAMP产物采用酶切加电泳的方法,先用特异的限制性内切酶对LAMP产物进行酶切,后根据酶切后的电泳条带是否单一进行鉴定,结果令人满意。
RT-LAMP方法易操作,且敏感、特异,特别适用于基层单位进行首发病例的快速诊断,该方法为腮腺炎病毒的快速检测提供了一种新的手段。
[1]殷大鹏,樊春祥,曹玲生,等.中国2004-2006年流行性腮腺炎流行病学简析[J].疾病监测,2007,22(5):310.
[2]金奇.医学分子病毒学[M].北京:科学出版社,2001:449-460.
[3]吴宏伟,崔爱丽,许松涛,等.一起流行性腮腺炎爆发的血清学诊断和基因型别鉴定[J].中国计划免疫,2006,12(5):399.
[4]卜丽薇,周景林,唐一清.流行性腮腺炎病毒微生物检验方法的建立[J].中国卫生检验杂志,2009,19(10):2322.
[5]严菊英,卢亦愚,姚亚萍.RT-PCR快速检测腮腺炎病毒[J].中国公共卫生,2003,19(3):347.
[6]冯燕,卢亦愚,严菊英,等.流行性腮腺炎病毒荧光定量逆转录-聚合酶链反应快速检测方法的建立[J].中国计划免疫,2006,12(5):394.
[7] Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):e63.
[8]周剑惠,侯祥,陈超,等.应用简便逆转录环介导等温扩增方法检测麻疹病毒核酸[J].中华实验和临床病毒学杂志,2008,22(6):403.
[9]王爽,周剑惠,侯祥,等.应用简便的逆转录环介导等温扩增方法检测风疹病毒核酸[J].中国疫苗和免疫,2009,15(6):518.
[10]Takao Okafuji,Naoko Yoshida,Motoko Fujino,et al.Rapid Diagnostic Method for Detection of Mumps Virus Genome by Loop-Mediated Isothermal Amplification[J].Journal of Clinical Microbiology,2005,43(4):1625.
[11]王爽,常新,周剑惠,等.吉林省首次分离的流行性腮腺炎野病毒及基因型鉴定[J].中国疫苗与免疫,2009,15(5):432.
[12]Mori Y,Kitao M,Tomita N,et al.Real-time turbidimetry of LAMP reaction for quantifying template DNA[J].J Biochem Biophys Methods,2004,59(1):145.
收稿日期:(2013-12-25)
文章编号:1007-4287(2015)04-0555-02
通讯作者*

