白假丝酵母荧光定量PCR鉴定方法的建立
许凡凡,贺 丹,孙晓红,3,王 丽,高 嵩,盛 辉*
(1.吉林大学第一医院 呼吸科,吉林 长春130021;2.吉林大学基础医学院病原生物学系,吉林大学真菌研究中心·
教育部人兽共患病重点实验室,吉林 长春130021;3.北华大学基础医学院,吉林 吉林132013)
白假丝酵母荧光定量PCR鉴定方法的建立
许凡凡1,贺丹2,孙晓红2,3,王丽2,高嵩2,盛辉1*
(1.吉林大学第一医院 呼吸科,吉林 长春130021;2.吉林大学基础医学院病原生物学系,吉林大学真菌研究中心·
教育部人兽共患病重点实验室,吉林 长春130021;3.北华大学基础医学院,吉林 吉林132013)
(ChinJLabDiagn,2015,19:0528)
近年来,免疫功能低下人群增多,导致真菌感染的发生率不断增高,感染的病原菌种类不断增多,且该病缺乏特异的症状和体征,使得早期诊断困难。由于临床上抗真菌药物种类较少、毒副作用大,且真菌的耐药现象日益严重,导致该病的治疗困难、死亡率高[1-5]。因此,建立主要病原真菌快速、敏感、特异的鉴定诊断方法,对于感染的早期诊断和及时有效治疗至关重要。
目前,吉林省真菌感染的流行病学调查结果显示,白假丝酵母仍是感染率最高的病原菌,多分离自呼吸科患者,且痰标本分离率最高[6,7]。为了能快速、特异性鉴定该菌,本研究以线粒体细胞色素C氧化酶亚基Ⅱ(mitochondrial cytochrome C oxidase subunitⅡ,COⅡ)基因为靶标设计了种特异性引物,建立了荧光定量PCR检测方法,分析了该方法的灵敏度、特异性及重复性,为临床白假丝酵母感染的早期诊治及核酸快速检测试剂盒的研发奠定了实验基础。
1材料与方法
1.1 实验菌株
实验菌株共9属、16种、20株,包括白假丝酵母5株,光滑假丝酵母、近平滑假丝酵母、热带假丝酵母、克柔假丝酵母、烟曲霉、黄曲霉、黒曲霉、土曲霉、茄病镰刀菌、产黄青霉、淡紫拟青霉、枝顶孢霉、红色毛癣菌、申克孢子丝菌及卷枝毛霉各1株。由吉林大学真菌研究中心菌种保藏中心(Culture Collection of Jilin University Mycology Research Center,JLCC)提供。
1.2 主要试剂和仪器
Gene TLETM酵母菌DNA提取试剂盒、Taq PCR扩增试剂盒、SYBR○RPremix Ex TaqTMKit、pMD 18-T Vector、X-Gal、IPTG购于大连宝生物工程有限公司,琼脂糖凝胶DNA回收试剂盒购于北京天根生化科技有限公司,引物合成和序列测定由大连宝生物工程有限公司完成。应用的主要仪器有荧光定量PCR仪(美国ABI公司)、PCR扩增仪(德国Biometra)、凝胶成像分析仪、(美国KoDaK)、核酸蛋白分析仪(日本Hitachi)。
1.3 引物设计
检索GenBank中的真菌线粒体COⅡ基因序列,包括白假丝酵母、光滑假丝酵母、近平滑假丝酵母、黑曲霉、马内菲青霉、巴西白僵菌、红色毛癣菌、絮状表皮癣菌及尖孢镰刀菌等7种酵母菌和8种丝状真菌,利用生物信息学分析选择白假丝酵母特异位点,设计该菌Real-time PCR特异引物f COⅡ1和r COⅡ2。
1.4 荧光定量PCR扩增
利用Gene TLETM酵母菌DNA提取试剂盒提取基因组DNA用于PCR扩增[8]。荧光定量PCR扩增体系为25 μl,包括12.5 μl 2×SYBR Premix ExTaq、0.5 μl 10 μmol/L f COⅡ1、0.5 μl 10 μmol/L r COⅡ2及1 μl模板DNA。扩增条件为95℃ 30 s后,95℃ 5 s、60℃ 10 s、72℃ 30 s 共40个循环,最后72℃收集荧光信号,建立荧光定量PCR特异性检测方法。
1.5 标准曲线绘制和灵敏度检测
参照文献构建重组质粒[9],选取阳性克隆抽提质粒DNA,进行PCR扩增。PCR体系为25 μl,包括2.5 μl 10×buffer、1.0 μl dNTP、1.0 μl 10 μmol/L f COⅡ1、1.0 μl 10 μmol/L r COⅡ2、1.0 μl rTaq酶及1.0 μl模板DNA。扩增条件为94 ℃ 预变性2 min后,94 ℃变性30 s、60℃退火30 s、72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min。将测序正确的重组质粒作为标准品,检测其质粒DNA浓度为307 ng/μl(拷贝数为9.67×1010copies/μl),进行倍比稀释,浓度依次为1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101copies/μl。以不同浓度的质粒作为模板DNA,进行荧光定量PCR,确定COⅡ基因引物的检测限,并绘制标准曲线。
1.6 特异性和重复性检测
利用建立的荧光定量PCR体系扩增白假丝酵母、光滑假丝酵母、烟曲霉、茄病镰刀菌、卷枝毛霉等20株实验菌株DNA,验证COⅡ基因引物的特异性。
选取浓度分别为1×106、1×105、1×103copies/μl的质粒标准品,每个浓度3个平行样本,实施3次荧光定量PCR扩增,根据Ct平均值、标准差及变异系数,验证建立检测方法的重复性。
2结果
2.1 标准曲线及灵敏度检测结果
对不同浓度质粒标准品实施荧光定量PCR,结果显示当浓度低于1×102copies/μl时不能出现扩增曲线。表明该体系检测灵敏度为1×102copies/μl(对应DNA 浓度为3.17×10-7ng/μl)。且质粒浓度介于1×106~1×102copies/μl时,与Ct值具有良好的线性关系,回归方程为y=-2.882 5x+22.142 3,相关系数R2=0.999 5(图1)。
2.2 特异性验证结果
对9属、16种、20株实验菌株进行荧光定量PCR检测,结果表明仅白假丝酵母可获得扩增曲线,其他种、属真菌均未见扩增。且熔解曲线在85.7℃具有单一峰,无引物二聚体等非特异扩增现象,表明设计的白假丝酵母COⅡ基因引物具有较好的特异性(图2)。

1~5:质粒浓度依次为1×106、1×105、1×104、1×103、1×102copies/μL
图1白假丝酵母标准品的荧光定量PCR扩增曲线

1:白假丝酵母JLCC31956;2:白假丝酵母JLCC31963;3:白假丝酵母JLCC33787;4:白假丝酵母JLCC33799;5:白假丝酵母JLCC33806
图2白假丝酵母的荧光定量PCR特异性扩增曲线
2.3 重复性检测结果
荧光定量PCR重复性检测结果显示,单一浓度的3个平行样本的Ct值接近(图3),不同浓度的3个平行样本的变异系数分别为1.49 %、1.33%、0.99%(表1),不同浓度的3次实验的变异系数分别为2.07%、1.48 %、1.80%(表2),均小于3%,表明建立的方法具有较好的重复性和稳定性。
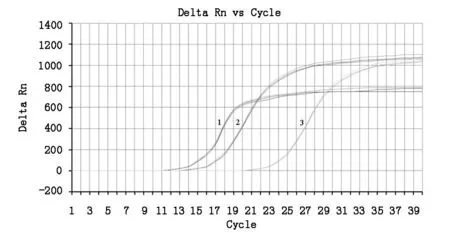
1~3:质粒浓度分别为1×106、1×105、1×103copies/μL

质粒浓度(copies/μl)Ct值样本1样本2样本3平均值标准差变异系数(%)10610510313.67416.87422.32413.38016.43922.76413.76816.58222.48013.60716.63222.5230.2020.2220.2231.491.330.99

表2 不同浓度白假丝酵母的3次荧光定量PCR扩增结果
3讨论
近年来,由于抗生素、免疫抑制剂的广泛应用,移植、介入等诊治技术的开展,艾滋病、恶性肿瘤等疾病增多,导致免疫功能低下人群不断增加,真菌感染的发生率日益升高,且临床诊治困难,死亡率较高[1-5]。有研究表明假丝酵母已成为院内血行感染的第四大病原菌,其中白假丝酵母是最常见的病原菌[2,10,11]。
目前,用于检测病原真菌的方法主要是培养法,但该方法主观性较强,且需要时间较长。研究者将目光集中于非培养法,包括血清学、代谢组学、组织病理学等方法。但这些方法存在取材困难、交叉反应、易受环境影响等问题[12-14]。随着分子生物学技术的发展,因其在鉴定病原菌方面具有快速、灵敏、特异性高等优点,已广泛被应用于临床感染的诊断中。实时定量PCR技术敏感性和特异性强、自动化程度高,有效解决了PCR技术中的污染问题,且实现了从定性到定量的飞跃,已被用于细菌、真菌及病毒的检测中[15-17]。
在微生物鉴定、分类的分子生物学方法研究中,靶基因的选择至关重要。由于真菌线粒体DNA具有独立复制的能力,严格的遵循母系遗传,为多拷贝。线粒体DNA变异较迅速,且不同区段进化速率不同,适于属、种不同水平的鉴定。
线粒体COⅡ基因在昆虫的系统发育研究中,已成为首选的分子标记,可用于昆虫属、种及种以下水平的分类和系统发育研究。亦有研究者尝试将其用于酵母型真菌的系统发育研究。Belloch C等人利用COⅡ基因研究克鲁维酵母(Kluyveromyces)的系统发育关系,发现该基因可代替rDNA序列,能够较好地推断酵母菌的谱系关系[18]。Young-Joon C等人利用ITS和COⅡ基因序列,研究了来自不同宿主的白锈菌(Albugo candida)的系统发育,表明两者均可很好的反映种间系统发育关系[19]。目前,利用COⅡ基因进行曲霉鉴定、分类及系统发育分析的研究尚未见报道。
本研究,基于真菌线粒体COⅡ基因序列,设计了白假丝酵母的特异性引物,建立了荧光定量PCR鉴定体系,对其灵敏度、特异性及重复性进行了分析。结果显示该体系检测的灵敏度可达1×102copies/μl(相当于10-7ng/μl),与利用SYBRGreen I染料进行荧光定量PCR检测的灵敏度(0.1 fg,相当于10-7ng/μl)基本一致[20]。熔解曲线显示反应具有单一峰,且仅有白假丝酵母出现扩增曲线,其他种、属真菌均未见扩增,表明所设计的引物具有较高的特异性,适合该菌种的特异性鉴定。重复性验证实验结果表明,建立的检测方法具有良好的重复性和稳定性。上述结果表明建立的基于真菌线粒体COⅡ基因鉴定白假丝酵母的荧光定量PCR方法,具有灵敏度高、特异性强、重复性和稳定性好的特点,适于临床真菌感染微量标本的快速检测。该研究为真菌感染的早期诊治和真菌核酸快速检测试剂盒的开发奠定了实验基础。
参考文献:
[1]Lass-Fl rl C.The changing face of epidemiology of invasive fungal disease in Europe[J].Mycoses,2009,52(3):197.
[2]Ortega M,Marco F,Soriano A,et al.Candida species bloodstream infection:epidemiology and outcome in a single institution from 1991 to 2008[J].J Hosp Infect,2011,77(2):157.
[3]廖万清,陈敏.侵袭性真菌病的诊断:现状与展望[J].菌物学报,2011,30(1):5.
[4] Warnock DW.Trends in the epidemiology of invasive fungal infections[J].Jpn J Med Mycol,2007,48(1):1.
[5]廖万清,顾菊林.深部真菌感染治疗的现状与对策[J].中国感染与化疗杂志,2007,7(2):101.
[6]王长嘉,隋达伟,贺丹,等.132例临床真菌感染的病原学及流行病学分析[J].中国实验诊断学,201103,15(03):418.
[7]孙晓红,贺丹,高嵩,等.临床白假丝酵母感染状况分析及药物敏感性[J].中国老年学杂志,201012,30(24):3677.
[8]Wang L,Yokoyama K,Miyaji M,et al.Mitochondrial cytochrome b gene analysis of Aspergillus fumigatus and related species[J].J Clin Microbiol,2000,38(4):1352.
[9]刘攀.草甘膦对土壤微生态的影响及其抗性和降解真菌的研究[D].吉林:吉林大学,2009.
[10]Wisplinghoff H,Bischoff T,Tallent SM,et al.Nosocomial bloodstream infections in US hospitals:analysis of 24,179 cases from a prospective nationwide surveillance study[J].Clin Infect Dis,2004,39(3):309.
[11]Horn DL,Neofytos D,Anaissie EJ,et al.Epidemiology and outcomes of candidemia in 2019 patients:data from the prospective antifungal therapy alliance registry [J].Clin Infect Dis,2009,48(12):1695.
[12]钱琴芳,KIRBY JE,周南.真菌感染的实验室诊断研究进展[J].微生物与感染,2010,5(001):19.
[13] Ostrosky-Zeichner L.Invasive mycoses:diagnostic challenges[J].AM J Med,2012,125(1):S14.
[14]Cuenca-Estrella M,Bassetti M,Lass-Fl rl C,et al.Detection and investigation of invasive mould disease[J].J Antimicrob Chemoth,2011,66(suppl 1):i15.
[15]Goebes MD,Hildemann LM,Kujundzic E,et al.Real-time PCR for detection of Aspergillus genus [J].J Environ Monit,2007,9(6):599.
[16]Spackman E.Avian influenza virus detection and quantitation by real-time rt- PCR[J].Methods Mol Biol. 2014,1161:105.
[17]Gosiewski T,Jurkiewicz-Badacz D,Sroka A,et al.A novel,nested,multiplex,real-time PCR for detection of bacteria and fungi in blood[J].BMC Microbiol.2014,14(1):144.
[18]Belloch C,Querol A,Garca MD,et al.Phylogeny of the genus Kluyveromyces inferred from the mitochondrial cytochrome-c oxidase II gene[J].Int J Syst Evol Microbiol,2000,50 (Pt 1):405.
[19]Young-Joon C,Seung-Beom H,Hyeon-Dong S.Genetic diversity within the Albugo candida complex (Peronosporales,Oomycota) inferred from phylogenetic analysis of ITS rDNA and COX2 mtDNA sequences[J].Mol Phylogenet Evol,2006,40(2):400.
[20]年四季,袁青,殷幼平,等.实时荧光定量PCR鉴定小麦矮腥黑穗菌技术研究[J].中国农业科学,2009,42(12):4403.
摘要:目的真菌感染发病率和死亡率逐年增高,亟需建立主要病原真菌快速、敏感、特异的鉴定方法,对感染的早期诊治至关重要。方法以真菌线粒体COⅡ基因为靶标,设计白假丝酵母的特异性引物,建立荧光定量PCR鉴定方法,分析其灵敏度、特异性及重复性。结果该方法检测的灵敏度可达1×102copies/μl(相当于10-7ng/μl),熔解曲线显示具有单一峰,且仅有白假丝酵母出现扩增曲线,其他种、属真菌均未见扩增。且具有较好的重复性和稳定性。结论建立的白假丝酵母荧光定量PCR鉴定方法灵敏度高、特异性强、重复性和稳定性好,适于临床真菌感染微量标本的快速检测。该研究为真菌核酸快速检测试剂盒的开发奠定了基础。
关键词:白假丝酵母;荧光定量PCR;鉴定;COⅡ基因
Establish a real-time PCR method to rapid identify Candida albicansXUFan-fan,HEDan,SUNXiao-hong,etal.(DepartmentofRespiratory,FirstHospitalofJilinUniversity,Changchun130021,China)
Abstract:ObjectiveThe morbidity and mortality of fungal infections increased these years.It is necessary to establish a rapid,sensitive and specific identification method which is essential for early diagnosis and treatment of the infections.MethodsSpecific primers of Candida albicans were designed according to the sequences of fungal mitochondrial COⅡ gene.And a real-time PCR method was established to identify Candida albicans.The sensitivity,specificity and repeatability of this identification method were analyzed.ResultsSensitivity of the method was up to 1×102copies/μl (equivalent 10-7ng/μl).There was a single peak of dissociation curve.Only Candida albicans was amplified,other genus and speciesof fungi were not amplified.The method had good repeatability and stability.ConclusionThe established real-time PCR method of Candida albicans has higher sensitivity and specificity,good repeatability and stability,which is suitable for rapid diagnosis with trace specimens of fungal infections in clinic.This study will lay the foundation for the development of rapid diagnostic kit of fungi.
Key words:Candida albicans; real-time PCR; identification; COⅡ gene
收稿日期:(2014-03-20)
文献标识码:A
中图分类号:R379
文章编号:1007-4287(2015)04-0528-04
通讯作者*
基金项目:吉林省科技发展计划项目(20110453,20130522014JH)

