华蟾素对肾癌细胞增殖的影响
兰 勇, 程 帆
(武汉大学人民医院 泌尿外科, 湖北 武汉, 430060)
华蟾素对肾癌细胞增殖的影响
兰勇, 程帆
(武汉大学人民医院 泌尿外科, 湖北 武汉, 430060)
摘要:目的探讨华蟾素对人肾癌786-0细胞的影响及机制。方法用不同浓度的华蟾素(浓度分别为1、10、100、1 000 μg/mL)作用于人肾癌786-0细胞株,采用CCK-8法检测华蟾素对肾癌786-0细胞增殖效应的影响,采用流式细胞术(FCM)检测华蟾素对肾癌786-0细胞周期的影响,采用蛋白印迹法检测华蟾素对Survivin蛋白表达水平的影响。结果CCK-8法结果提示,不同浓度的华蟾素均可显著抑制肾癌786-0细胞的增殖,且抑制率呈时间、剂量依赖关系。FCM检测发现华蟾素可使肾癌786-0细胞周期中的G0/G1期比例增加,S期缩短。蛋白印迹法显示,华蟾素可使肾癌786-0细胞中Survivin蛋白表达水平降低。结论华蟾素能够抑制人肾癌786-0细胞的增殖,并阻滞细胞周期在G0/G1期,其机制可能与影响蛋白Survivin的表达相关。
关键词:华蟾素; 人肾癌786-0细胞; 细胞增殖; Survivin
肾细胞癌是泌尿系统3大常见肿瘤之一,严重危害人类的生命以及健康。近年来,肾癌的发病率、死亡率呈逐渐上升的趋势,而治疗手段主要采取手术切除治疗,以及辅以内分泌等治疗,均取得较好的疗效。对于晚期肾癌、转移肾癌的治疗效果仍然不是很满意,故寻求新的抗肿瘤途径极为重要[1]。随着对中国传统医药的研究发现,中药在抗肿瘤方面显示出独特的作用,中药抗肿瘤的研究亦越来越受到重视,其中华蟾素[2-3]是研究较多的传统中药之一,其具有止痛、消炎作用。最近研究发现其还具有抗肿瘤作用,且动物相关实验显示未见明显的毒副作用。本研究探讨华蟾素在体外对肾癌细胞生物学行为的影响,现报告如下。
1材料与试剂
1.1 材料与设备
人肾癌786-0细胞购自武汉大学细胞保藏中心。细胞用含10%小牛血清、100 μ/mL青霉素、100 μg/mL链霉素的RPMI 1640培养液,于37 ℃、5% CO2饱和湿度孵育箱内常规培养。华蟾素购自安徽淮北金蟾药业公司,于-4 ℃保存,使用前用RPMI 1640培养液稀释成实验所需浓度。
RPMI 1640干粉培养基、优级小牛血清均为GIBCO公司产品; CCK-8、DMSO为美国Sigma公司产品;倒置荧光显微镜NIKON TE2000为上海衡桥仪器有限公司产品;全波长酶标仪为Thermo公司产品, 流式细胞仪为美国贝克曼公司产品。胰蛋白酶冻干粉,购于美国Sigma公司,超净工作台购买自上海博讯实业有限公司,细胞培养箱购自美国Nuaire公司,微量移液器购自法国Gilson公司,高速冷冻离心机购自日本日立公司,干燥箱购自上海市实验仪器总,冰箱购自西门子公司,细胞培养板购买自IWAKI公司。
1.2 实验方法
1.2.1CCK-8法检测华蟾素对786-0细胞增殖的影响:取处于对数生长期的肾癌786-0细胞,调整其细胞密度后接种于96孔培养板中,200 μL/孔,其分组为:凋零孔组(只含RPMI 1640培养液,无细胞)、对照组(含RPMI 1640培养液、细胞)、华蟾素组(华蟾素浓度分别为1、10、100、1 000 μg/mL), 接种待细胞贴壁后加药,对照组加入等体积的培养液,各组均设6个复孔,置于细胞箱内继续培养24、48、72 h后弃上清,加入CCK-8(5 mg/mL) 20 μL/孔,继续培育4 h, 加入 DMSO 200 μL/孔,振荡使其溶解。用酶标仪检测波长为570 nm处各孔的吸光度(OD)值,按以下公式计算细胞的增殖抑制率:抑制率=(1-实验组平均OD值/对照组平均OD值)×100%。
1.2.2流式细胞术检测华蟾素对786-0细胞周期的影响:取生长良好的肾癌786-0细胞,用胰酶消化细胞后,用PBS液清洗、离心后,重新接种细胞于培养瓶中, 对照组中加入等体积培养液,药物组中加入华蟾素,使其浓度分别为1、10、100、1000 μg/mL, 于细胞培养箱中培养48 h后,收集细胞,用固定液固定细胞过夜后,离心5 min弃上清,用PBS洗涤,用含0.1% Triton X-100和50 μg/mL RNAse的PBS混合液重悬细胞,加入90 μL PI(0.5 mg/mL)避光孵育0.5 h, 经尼龙网过滤,用流式细胞仪进行检测分析。
1.2.3蛋白印迹实验检测华蟾素对Survivin蛋白的影响:实验分组为对照组、华蟾素药物组(其浓度分别为100、1 000 μg/mL); 待传代细胞贴壁后加入药物,对照组种加入相应体积的细胞培养液,置37 ℃、5%CO2饱和湿度细胞培养箱内进行培养,于48 h收集细胞,用PBS缓冲液洗涤细胞3次,加入100 μL细胞裂解液,于冰上裂解40 min, 用细胞刷子刮下各组细胞,分别收集于细胞试管中并贴上标签,于4 ℃进行12 000 r/min离心5 min后取上清液,并测定蛋白浓度,计算样本上样量,进行12% SDS-PAGE凝胶电泳,然后转至PVDF膜,膜用含5%脱脂奶粉的TBST于4 ℃恒温冰柜中摇床、封闭过夜,第2天去封闭液,用TBST洗膜3~4次,每次5 min, 加入鼠抗人Survivin抗体(1∶2 000),室温下摇床孵育2 h, TBST洗膜3次,每次5 min, 然后加入辣根过氧化物酶(HRP)标记的山羊抗鼠IgG(1∶2 000),继续摇床孵育2 h,TBST洗膜3次后(5 min/次)加入化学底物发光液A、B液,于暗室中进行显影、定影、扫描。
1.3 统计学方法
应用SPSS 17.0软件进行统计分析,数据用均数±标准差表示,不同时间、不同浓度行重复测量方差分析,组间比较采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1 华蟾素抑制肾癌786-0细胞的增殖
通过CCK-8法实验结果发现,浓度为1、10、100、1 000 μg/mL的华蟾素作用于肾癌786-0细胞24、48、72 h后,肾癌786-0细胞的增殖显著变缓,且随着华蟾素药物浓度的增加、处理时间的延长,这种抑制作用具有增强趋势,具有时间、剂量依赖关系,药物组对肾癌细胞的抑制率与对照组比较,差异具有统计学意义(P<0.01)。见表1。
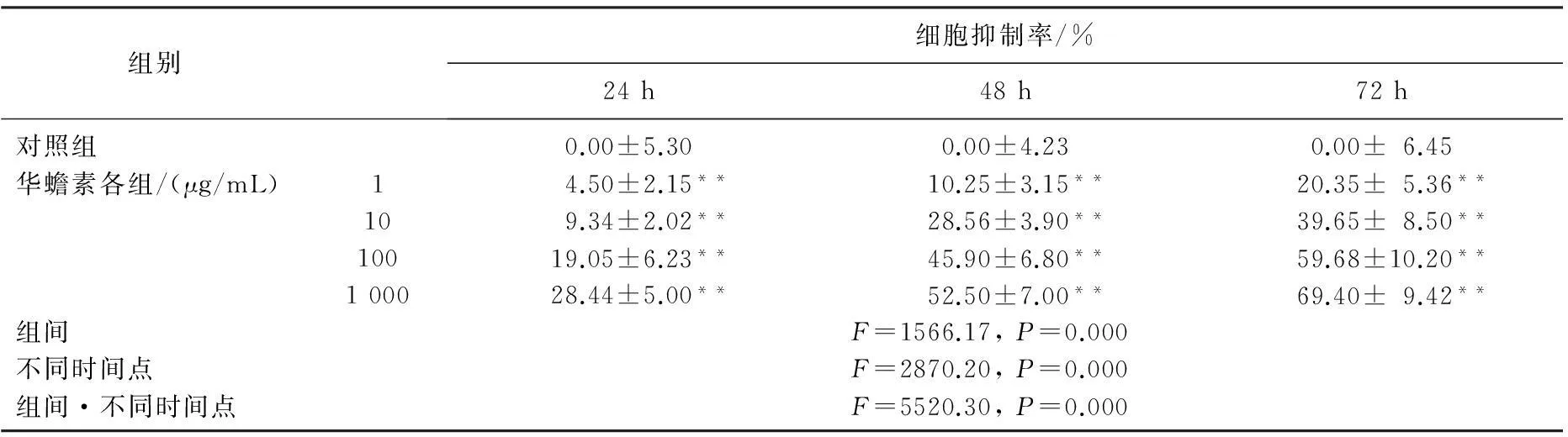
表1 不同浓度的华蟾素对786-0细胞增殖的影响(n=9)
与对照组比较,**P<0.01。
2.2 华蟾素对肾癌786-0细胞周期的影响
通过流式细胞术实验显示,当浓度为1、10、100、1 000 μg/mL的华蟾素作用于肾癌786-0细胞48 h后,与对照组相比较,华蟾素各浓度组G0/G1期所占比例较对照组增加,而S期细胞比例较对照组减少,而G2/M期无显著变化,提示华蟾素能够使肾癌786-0细胞生长周期主要阻滞在G0/G1期,从而抑制肾癌细胞的增殖,各浓度药物组与对照组比较,差异具有统计学意义(P<0.05)。见表2,图1。
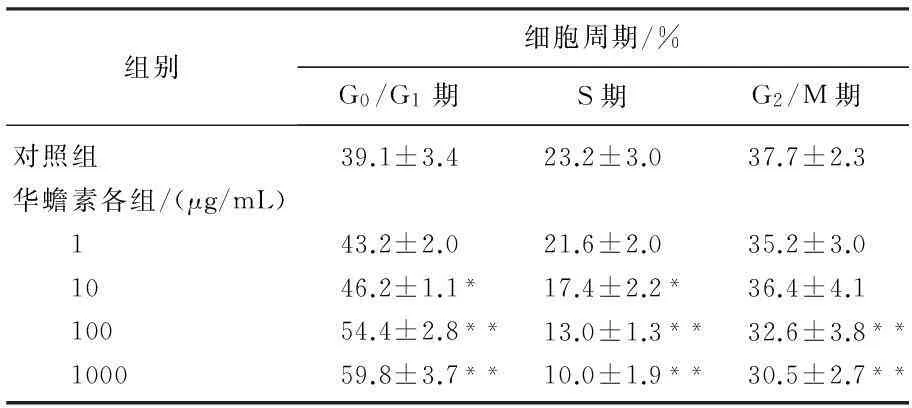
表2 华蟾素对786-0细胞周期的影响(n=3)
与对照组比较,*P<0.05, **P<0.01。
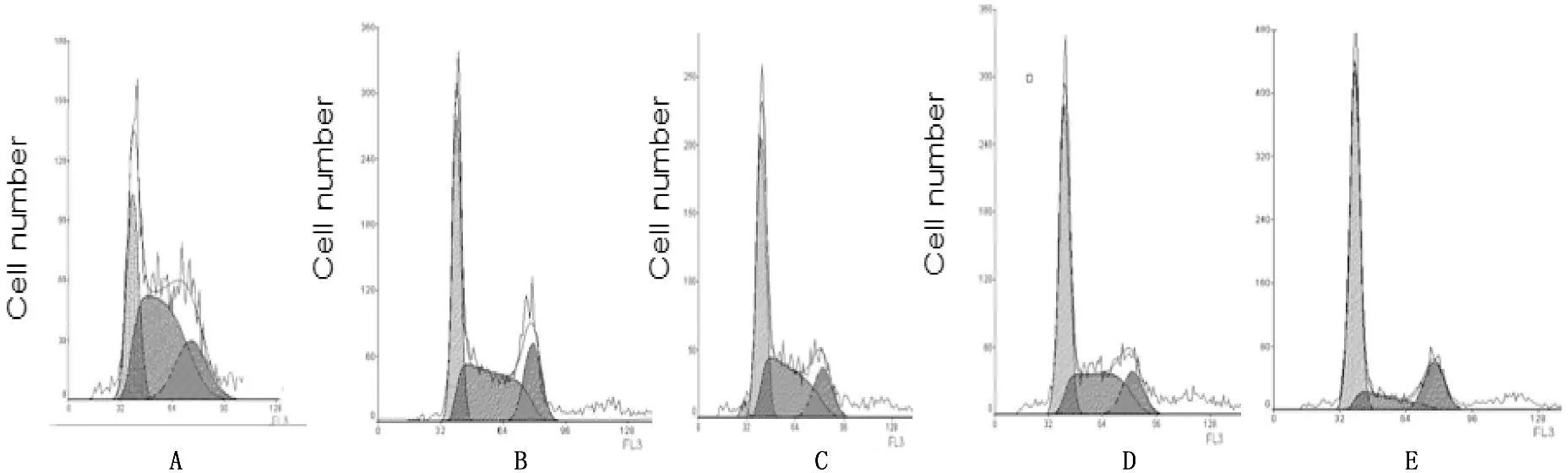
A. 对照组; B. 华蟾素浓度为1 μg/mL; C. 华蟾素浓度为10 μg/mL; D. 华蟾素浓度为100 μg/mL; E. 华蟾素浓度为1 000 μg/mL。
图1华蟾素对肾癌细胞786-0细胞周期的影响
2.3 华蟾素抑制Survivin蛋白的表达
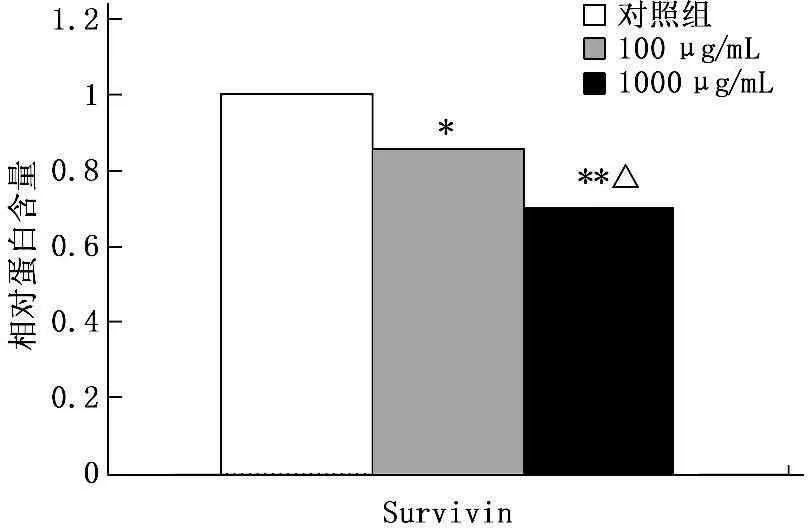
通过Western印迹法实验显示,浓度为100、1 000 μg/mL的华蟾素作用于肾癌细胞48 h后,药物组中Survivin蛋白的表达水平与对照组比较逐渐下降,进行灰度分析,发现药物组与对照组比较差异有统计学意义(P<0.05)。见图2-3。
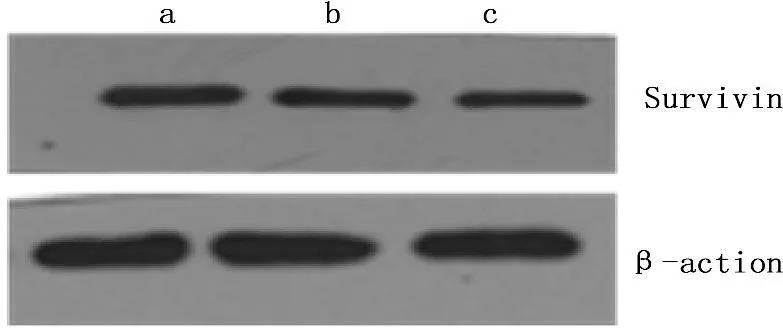
a. 对照组; b. 华蟾素100 μg/mL; c. 华蟾素1 000 μg/mL
与对照组比较,*P<0.05, **P<0.01;
与100 μg/mL华蟾素组比较,△P<0.05
图3灰度分析华蟾素对肾癌细胞中Survivin蛋白
表达水平的影响
3讨论
肾癌是泌尿系统常见的肿瘤之一,近年来其发病率以及死亡率均有一定的提升,其发病原因未明,而其治疗方案仍然以手术为主,但对于晚期肿瘤、转移肿瘤目前仍然无有效的治疗手段。因此,医学专家仍然为肾癌的进一步治疗寻找着新的治疗策略。
随着医学技术的发展,传统中医药材逐渐成为当今治疗肿瘤的重要手段以及新的策略之一,中药材的优势主要在于其不仅对肿瘤具有显著的抑制作用,不易产生耐药性,而且对机体的损伤以及副作用小。因此,研究中药材抗肿瘤效应具有广阔的临床应用价值。
华蟾素系传统中药中华大蟾蜍皮的水制剂,其主要成分是蟾毒灵及吲哚生物碱等,具有消炎、止痛、抗肿瘤以及提高宿主免疫力等多种作用[4],已列为国家级中药保护品种。近年来有研究[5-7]表明,华蟾素对多种肿瘤如乳腺癌、骨肉瘤、前列腺癌、胃癌和肝癌等多种肿瘤细胞具有抑制作用并可诱导其凋亡。且动物实验[8]显示华蟾素具有升白细胞的作用,具有安全有效、毒副作用小的优点,已被广泛应用于多种肿瘤的辅助治疗。
本研究结果发现,不同浓度的华蟾素作用于肾癌786-0细胞后,通过CCK-8法观察发现,华蟾素可显著抑制肾癌细胞的生长,且对细胞的抑制作用随着药物浓度的增加及作用时间的延长而逐渐增强,这说明华蟾素对786-0细胞的抑制效应具有一定的量效、时效性,表明华蟾素可显著抑制786-0细胞的增殖。流式细胞术结果发现,不同浓度的华蟾素作用于肾癌786-0细胞48 h后,华蟾素各浓度组将细胞周期主要阻滞在G0/G1期,使细胞S期所占比例明显减少,提示华蟾素可通过将786-0细胞阻滞在G0/G1期,从而抑制肾癌786-0细胞的增殖[9-11]。
细胞凋亡与许多生物学过程以及疾病的发生、发展等密切相关,是维持机体生长发育、自身组织稳定的重要生命现象。当衰老细胞不能通过凋亡机制予以清除时,便可能导致肿瘤发生[12-14]。Survivin基因也是IAPs家族的重要成员,Survivin基因通过抑制凋亡核心半胱氨酰天冬氨酸特异性蛋白酶(Caspase)-3和Caspase-7, 影响后者在细胞内微管的聚合、解聚,阻断细胞周期G2/M期,抑制细胞凋亡,它还参与肿瘤血管形成。因此,Survivin基因也参与了肿瘤的发生与演变。本课题用不同浓度的华蟾素作用于肾癌细胞发现,Survivin蛋白的表达随着药物浓度的增加而下降。
参考文献
[1]Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9.
[2]Meng Z, Garrett C R, Shen Y, et al. Prospective randomised evaluation of traditional Chinese medicine combined with chemotherapy: a randomised phase Ⅱ study of wild toad extract plus gemcitabine in patients with advanced pancreatic adenocarcinomas[J]. Br J Cancer, 2012, 107(3): 411.
[3]Cui X, Inaggki Y, Xu H, et al. Anti-hepatitis B virus activities of cinobufacini and its active components bufalin and cinobufagin in HepG2.2.15 cells[J]. Biol Pharm Bull, 2010, 33(10): 1728.
[4]Qi F, Li A, Zhao L, et al. Cinobufacini,an aqueous extract from Bufo bufo gargarizans Cantor, induces apoptosis through a mitochondria- mediated pathway in human hepatocellular carcinoma cells[J]. J Ethnopharmacol, 2010, 128(3): 654.
[5]薛瑞, 张青松, 张玉洁, 等. 华蟾素对乳腺癌MCF-7抑制瘤鼠的抗肿瘤作用及机制研究[J]. 实用药物与临床, 2014, 17(7): 815.
[6]Zhou R P, Chen G, Shen Z L, et al. Cinobufacin suppresses cell proliferation via miR-494 in BGC- 823 gastric cancer cells[J]. Asian Pac J Cancer Prev, 2014, 15(3): 1241.
[7]Ma L, Song B, Jin H, et al. Cinobufacini induced MDA-MB-231 cell apoptosis-associated cell cycle arrest and cytoskeleton function[J]. Bioorg Med Chem Lett, 2012, 122(3): 1459.
[8]Huang T, Gong W H, Li X C, et al. Efficient killing effect of osteosarcoma cells by cinobufacini and Cisplatin in combination[J]. Asian Pac J Cancer Prev, 2012, 13(6): 2847.
[9]Qi F, Li A, Zhao L,et al. Induction of apoptosis by cinobufacini preparation through mitochondria- and Fas-mediated caspase-dependent pathways in human hepatocellular carcinoma cells[J]. Food Chem Toxicol, 2012, 50(2): 295.
[10]Wang D, Bi Z. Bufalin inhibited the growth of human osteosarcoma MG-63 cells via down-regulation of Bcl-2/Bax and triggering of the mitochondrial pathway[J]. Tumour Biol, 2014, 35(5): 4885.
[11]Lau C B, Ho C Y, Kim C F, et al. Cytotoxic activities of Coriolus versicolor(Yunzhi) extract on human leukemia and lymphoma cells by induction of apoptosis[J]. Life Sci, 2004, 75(7): 797.
[12]Yeh J Y, Huang W J, Kan S F, et al. Effects of bufalin and cinobufagin on the proliferation of androgen dependent and independent prostate cancer cells[J]. Prostate, 2003, 54(2): 112.
[13]陈小刚, 罗鹏程, 张青汉, 等. 小干扰RNA联合介导Livin和Survivin基因沉默对人肾抑制及凋亡的影癌细胞786—0增殖响[J]. 中华实验外科杂志, 2014, 31(6): 1199.
[14]辛军, 周金, 欧阳永娥, 等. Survivin和Ki-67在肾癌中的表达及其临床意义[J]. 现代泌尿生殖肿瘤杂志, 2014, 6(2): 98.
Influence of cinobufotalin on proliferation of renal cancer cells
LAN Yong, CHENG Fan
(DepartmentofUrinarySurgery,ThePeople′sHospitalofWuhanUniversity,Wuhan,Hubei, 430060)
ABSTRACT:ObjectiveTo explore the influence and mechanism of cinobufotalin on the proliferation of human renal cancer cell lines 786-0. MethodsHuman renal cancer cell lines 786-0 were processed with different concentrations of cinobufotalin (concentrations were 1, 10, 100, 1 000 μg/mL). Influence of cinobufotalin on cell proliferation of renal cancer cell lines 786-0 was examined by CCK-8, and influence on cell cycle was detected by flow cytometry (FCM). Influence of cinobufotalin on expression level of Survivin protein was detected by Western blotting.ResultsThe CCK-8 showed that different concentrations of cinobufotalin significantly inhibited proliferation of renal cancer cell lines 786-0, and the inhibitory rate was correlated with time and dose. FCM test showed that cinobufotalin was able to increase the proportion of the cell cycle in the G0/G1phase and shorten S phase in renal cancer cell lines 786-0. Western blotting showed that cinobufotalin was able to reduce expression level of Survivin protein in renal cancer cell lines 786-0. ConclusionCinobufotalin can inhibit proliferation of cells and block the cell cycle in the G0/G1phase in renal cancer cell lines 786-0, and its mechanism is probably correlated with the influence of expression of Survivin protein.
KEYWORDS:cinobufotalin; renal cancer cell lines 786-0; cell proliferation; Survivin
通信作者:程帆, E-mail:415827@qq.com
收稿日期:2015-01-20
中图分类号:R 692
文献标志码:A
文章编号:1672-2353(2015)07-083-04DOI: 10.7619/jcmp.201507024

