Faecalibacterium prausnitzii基因组DNA上调外周血单个核细胞Th1型免疫应答增强对人结肠癌LoVo细胞的杀伤活性
Faecalibacteriumprausnitzii基因组DNA上调外周血单个核细胞Th1型免疫应答增强对人结肠癌LoVo细胞的杀伤活性
张涛1#张敏1汤爱荣1曹萍2谢丽娟1于成功1,3&
南京大学医学院附属鼓楼医院消化科1(210008)
南京医科大学鼓楼临床医学院消化科2南京鼓楼医院集团仪征医院消化科3

*基金项目:国家自然科学基金(81470819)
#Email: zhangtao203@126.com
背景:Faecalibacteriumprausnitzii(Fp)是一种具有抗炎和免疫调节作用的肠道共生菌,研究发现结直肠癌患者肠道内Fp数量明显减少,可能与肿瘤发生有关。目的:探讨Fp及其基因组DNA(fDNA)干预对外周血单个核细胞(PBMCs)对人结肠癌LoVo细胞杀伤活性的影响及其免疫学机制。方法:将Fp、fDNA或酶解fDNA(d-fDNA)与分离自健康成人的PBMCs体外共培养,MTT实验检测PBMCs对LoVo细胞的杀伤活性,ELISA法检测PBMCs培养上清液中的Th1、Th2型细胞因子干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)含量,real-time PCR检测PBMCs Th1、Th2特异性转录因子T-bet、GATA3表达。结果:与未予干预的PBMCs相比,fDNA干预能显著增强PBMCs对LoVo细胞的杀伤活性(P<0.05),同时促进PBMCs的IFN-γ分泌和T-bet mRNA表达(P<0.05),抑制IL-4分泌和GATA3 mRNA表达(P<0.05)。Fp和d-fDNA均未显示出上述作用。结论:fDNA能增强PBMCs对人结肠癌细胞的杀伤活性,其机制可能与上调Th1型免疫应答有关。
关键词Faecalibacterium prausnitzii;干扰素γ;白细胞介素4;Th1-Th2平衡;结肠肿瘤;LoVo细胞
Colonic Neoplasms;LoVo Cells
结直肠癌为常见消化系统恶性肿瘤,发病率和死亡率在我国呈上升趋势。结直肠癌的病因尚未明确,近年来,肠道细菌与结直肠癌发病的关系日益受到关注,部分学者认为肠道细菌及其代谢产物通过多种机制参与了结直肠癌的发生、发展[1]。
在机体免疫系统中,干扰素-γ(IFN-γ)主要由Th1细胞分泌,主要介导细胞免疫;而白细胞介素-4(IL-4)主要由Th2细胞分泌,主要介导体液免疫。有研究[2]表明,结直肠癌患者以Th2型免疫应答占优势,Th1细胞功能减弱,提示Th1/Th2失衡可能参与了结直肠癌的发生和进展。
对结直肠癌患者肠道菌群的定量分析显示,患者肠道内产丁酸细菌Faecalibacteriumprausnitzii(F.prausnitzii, Fp)和直肠真杆菌(Eubacteriumrectale)数量明显减少,可能与肿瘤发生有关[3]。体内外研究[4-5]显示,Fp及其培养上清液具有抗炎和免疫调节作用。本研究以Fp及其基因组DNA(fDNA)干预人外周血单个核细胞(PBMCs),观察其对PBMCs对人结肠癌LoVo细胞杀伤活性的影响以及PBMCs IFN-γ、IL-4分泌和Th1、Th2特异性转录因子T-bet、GATA3的表达变化,旨在为Fp用于结直肠癌的治疗提供实验依据。
材料与方法
一、标本来源
随机收集2014年6月-2014年10月南京市鼓楼医院体检中心健康体检者20名,其中男10名,女10名,年龄21~53岁,平均(32.3±12.0)岁。入选者遵循自愿原则完成实验。
二、菌株、细胞株和主要试剂
Fp菌种(ATCC 27766,美国模式菌种保藏中心),人结肠癌LoVo细胞(南京市鼓楼医院消化科实验室保存),细菌基因组DNA提取试剂盒、DNAse Ⅰ、引物合成(上海捷瑞生物工程有限公司),淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司),MTT、DMSO、植物血凝素(PHA)[生工生物工程(上海)股份有限公司],人IFN-γ、IL-4 ELISA试剂盒(Abcam plc.),RNAiso Plus总RNA提取试剂、PrimeScriptTM逆转录试剂盒(Perfect Real Time)、SYBR®Premix Ex TaqTM(Tli RNaseH Plus)(TAKARA BIO INC.)。
三、方法
1. Fp培养:参照文献方法配制培养基[5],将Fp置于厌氧箱(37 ℃, 97% CO2, 2% H2)内培养,根据600 nm处吸光度值(A值)结合平板菌落计数计算细菌浓度。取对数生长末期菌液离心,收集细菌,以PBS重悬并调整浓度至1×109CFU/mL,-20 ℃冰箱保存。
2. fDNA和酶解fDNA(d-fDNA)的制备:以细菌基因组DNA提取试剂盒提取fDNA,经紫外分光光度计测定A260/A280为1.8~1.9。DNAseⅠ 37 ℃水浴4 h以完全酶解细菌DNA,作为fDNA的对照。收集fDNA和d-fDNA,-20 ℃冰箱保存。
3. PBMCs的分离和培养:抽取20名健康成人外周血,Ficoll密度梯度离心法分离 PBMCs,以RPMI 1640培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)重悬并调整浓度至1×106/mL。
4. MTT实验检测PBMCs杀伤活性:以PBMCs为效应细胞,以LoVo细胞为靶细胞。将源自10名健康成人的PBMCs以1×105/孔(0.1 mL)接种于24孔板,分别加入40 μL Fp(1×109CFU/mL)、fDNA(25 μg/mL)或d-fDNA(25 μg/mL)并补足完全培养基至1 mL,共培养24 h,以未予干预的PBMCs作为对照,离心,弃上清,以完全培养基悬浮细胞沉淀。每组1×105个效应细胞与2×103个靶细胞共培养于96孔板(效靶比50∶1),另设单独培养的PBMCs和LoVo细胞作为效应细胞对照组和靶细胞对照组,每组设3个复孔。37 ℃、5% CO2条件下培养72 h,弃上清,PBS重悬2次,加入MTT孵育4 h,弃上清,加入DMSO,以酶标仪测定490 nm处A值。效应细胞对靶细胞的杀伤率={1-[(实验组A值-效应细胞对照组A值)/靶细胞对照组A值]}×100%。
5. ELISA法检测PBMCs培养上清液IFN-γ、IL-4含量:将源自另10名健康成人的PBMCs以1×106/孔(1 mL)接种于24孔板,加入IFN诱生剂PHA(100 μg/mL)培养24 h,分别加入40 μL Fp(1×109CFU/mL)、fDNA(25 μg/mL)或d-fDNA(25 μg/mL),另设只加PHA的对照组,继续培养24 h,离心,收集上清,-20 ℃冰箱保存。按相应ELISA试剂盒说明书操作,检测IFN-γ、IL-4含量。
6. Real-time PCR检测PBMCs T-bet、GATA3 mRNA表达:实验步骤5培养的各组细胞离心后收集细胞沉淀,以RNAiso Plus试剂提取总RNA,逆转录合成cDNA,行real-time PCR扩增目的片段。引物序列:T-bet F 5’-TGA CAT GAT GAA AGG AAC AGA AAC A-3’, R 5’-CCC CAA CCA ACT ACT AAA CAG AGA A-3’; GATA3 F 5’-CCT CCT CTC TGC TCT TGG CTA C-3’, R 5’-AGA ATA AAA CGG GAC CAG GTT GTA A-3’; 内参β-actin F 5’-GTT GCG TTA CAC CCT TTC TTG AC-3’, R 5’-CTC GGC CAC ATT GTG AAC TTT G-3’。PCR反应体系:SYBR®Premix Ex TaqTM10 μL,上、下游引物各0.4 μL,ROX Reference Dye Ⅱ 0.4 μL,cDNA 2 μL,去离子水6.8 μL,共20 μL。反应条件: 95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 30 s,40个循环。2-△△Ct法计算目的基因相对表达量。
四、统计学分析
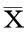
结果
一、PBMCs对LoVo细胞的杀伤活性
经Fp、fDNA或d-fDNA干预24 h的PBMCs,以效靶比50∶1与LoVo细胞共培养72 h后,fDNA组PBMCs对LoVo细胞的杀伤率为(49.43±6.77)%,显著高于未予干预PBMCs组的(26.50±6.72)%(P<0.05);Fp组和d-fDNA组PBMCs杀伤率分别为(35.73±1.97)%和(28.80±5.45)%,均低于fDNA组,但差异无统计学意义(P>0.05),两组杀伤活性与未予干预PBMCs组相比均无明显差异(P>0.05)(图1)。

*两组间比较,P<0.05
图1Fp、fDNA和d-fDNA干预对PBMCs对LoVo细胞杀伤活性的影响
二、PBMCs IFN-γ、IL-4分泌
经PHA刺激以及Fp、fDNA或d-fDNA干预 24 h 的PBMCs,fDNA组IFN-γ分泌量为(529.4±36.3) pg/mL,显著高于Fp组[(288.6±31.0) pg/mL]、d-fDNA 组[(220.3±20.7) pg/mL]和对照组[(203.2±23.6) pg/mL](P<0.001);fDNA组IL-4分泌量为(14.35±2.10) pg/mL,显著低于d-fDNA组[(29.57±4.92) pg/mL]和对照组[(30.91±3.35) pg/mL](P<0.05),与Fp组[(20.23±3.76) pg/mL]相比无明显差异(P>0.05)。Fp组、d-fDNA组IFN-γ、IL-4分泌量与对照组相比差异均无统计学意义(P>0.05)(图2)。
三、PBMCs T-bet、GATA3 mRNA表达
经PHA刺激以及Fp、fDNA或d-fDNA干预 24 h 的PBMCs,fDNA组T-bet mRNA相对表达量为1.699±0.082,显著高于d-fDNA组(1.066±0.201)和对照组(P<0.05),与Fp组(1.144±0.204)相比无明显差异(P>0.05);fDNA组GATA3 mRNA相对表达量为(0.511±0.077),显著低于d-fDNA组(1.066±0.101)和对照组(P<0.05),与Fp组(0.799±0.143)相比无明显差异(P>0.05)。Fp组、d-fDNA组T-bet、GATA3 mRNA相对表达量与对照组相比差异均无统计学意义(P>0.05)(图3)。
讨论
Fp是一种具有抗炎和免疫调节作用的肠道共生菌,占健康成人肠道菌群总量的5%以上, 是肠道内代谢最为活跃的细菌之一,对维持肠道健康具有重要作用[6]。研究[3,7]发现结直肠癌患者肠腔内和附着于肠黏膜的Fp数量较健康成人明显减少,且癌组织Fp数量少于正常黏膜组织,提示Fp减少可能参与了结直肠癌的发生。

两组间比较,*P<0.05,***P<0.001

两组间比较,*P<0.05,**P<0.01
Fp能分解糖类产生丁酸,是肠道内主要的产丁酸细菌之一。体外实验发现丁酸具有抑制人结肠癌细胞增殖并诱导细胞凋亡的作用[8],据此推测,Fp可能通过产丁酸发挥抗癌作用。本课题组前期研究结果表明,Fp与人结肠癌细胞共培养能直接抑制癌细胞增殖并促进细胞凋亡,本实验将Fp与PBMCs共培养,却发现其并不能提高PBMCs对肿瘤细胞的杀伤活性,其原因可能为Fp具有促进初始T细胞向调节性T细胞(Treg细胞)分化的作用[5],而Treg细胞是机体抗肿瘤免疫的负性调节因子,可促进肿瘤免疫逃逸。此外,闵军等[9]的研究发现丁酸诱导的未成熟树突细胞可通过高表达吲哚胺2,3双加氧酶、低表达IL-12等抑制T细胞增殖,诱导机体免疫耐受。上述结果表明,Fp虽然具有直接抗肿瘤作用,但在抗肿瘤免疫中可能起负性调节作用。
一些细菌基因组DNA存在非甲基化胞嘧啶-磷酸-鸟嘌呤二核苷酸结构(CpG序列),文献报道CpG序列可通过调节机体免疫,如增强巨噬细胞对肿瘤细胞的吞噬作用、增加抗肿瘤细胞因子分泌等途径发挥抗肿瘤效应,一些人工合成的CpG寡脱氧核苷酸(ODN)已被作为有效佐剂用于免疫调节和肿瘤的免疫治疗[10-11]。CpG序列根据结构差异可分为CpG-A、CpG-B和CpG-C,三者可能通过不同路径发挥免疫调节功能[10]。Fp的基因组DNA同样存在非甲基化CpG序列,但其结构不明。目前研究显示,免疫细胞表面的模式识别受体Toll样受体9(TLR9)可特异性识别并结合细菌非甲基化CpG序列和人工合成的CpG序列,TLR9活化后可激活多种免疫细胞,导致有效的Th1型免疫应答和抗肿瘤效应[11]。本实验表明fDNA与PBMCs共培养能增强其对人结肠癌LoVo细胞的杀伤活性,从而抑制肿瘤细胞增殖,结合上述研究结果,推测fDNA可能是通过激活TLR9,调节PBMCs向Th1亚群分化而发挥抗肿瘤效应。
在肿瘤免疫应答中,活化的初始CD4+T细胞分化为不同T细胞亚群,发挥不同免疫调节作用:Th1型免疫应答分泌IL-2或IFN-γ等细胞因子,促进抗肿瘤免疫应答,Th2型免疫应答则通过分泌IL-4、IL-13等,促进肿瘤生长[12],Th1、Th2型细胞因子表达间接反映了相应T细胞亚群的功能,IFN-γ和IL-4分别为典型的Th1和Th2型细胞因子[13]。T-bet为Th1特异性转录因子,通过作用于IFN-γ等基因位点,促进相应基因转录,正向调控T细胞向Th1方向分化,而GATA3通过作用于IL-4等Th2型细胞因子基因位点,正向调控T细胞向Th2方向分化,为Th2特异性转录因子[14]。有研究[2,15]表明结直肠癌患者存在Th1/Th2失衡,主要表现为Th2型免疫应答上调,Th1型免疫应答下调,Th1/Th2失衡与结直肠癌的发生、进展、转移和预后相关,纠正Th1/Th2失衡可能为结直肠癌的治疗提供了一个新途径。本研究将Fp、fDNA和d-fDNA与源自健康成人的PBMCs共培养,观察了此种干预对PBMCs杀伤活性及其Th1/Th2分化、应答的影响,发现fDNA能显著增强PBMCs对LoVo细胞的杀伤活性,同时促进IFN-γ分泌和T-bet mRNA表达,抑制IL-4分泌和GATA3 mRNA表达,Fp和d-fDNA的作用则不明显,表明Fp可通过其基因组DNA影响PBMCs的分化方向、纠正Th1/Th2失衡,从而发挥抗肿瘤作用。
综上所述,本实验发现fDNA能增强PBMCs对人结肠癌细胞的杀伤活性,其机制可能与上调Th1型免疫应答有关。以fDNA作为生物反应调节剂为结直肠癌的治疗研究提供了新的尝试途径,相关研究有待深入开展。
参考文献
1 Keku TO, Dulal S, Deveaux A, et al. The gastrointestinal microbiota and colorectal cancer[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 308 (5): G351-G363.
2 Pellegrini P, Berghella AM, Del Beato T, et al. Disregulation in TH1 and TH2 subsets of CD4+ T cells in peripheral blood of colorectal cancer patients and involvement in cancer establishment and progression[J]. Cancer Immunol Immunother, 1996, 42 (1): 1-8.
3 Balamurugan R, Rajendiran E, George S, et al. Real-time polymerase chain reaction quantification of specific butyrate-producing bacteria,DesulfovibrioandEnterococcusfaecalisin the feces of patients with colorectal cancer[J]. J Gastroenterol Hepatol, 2008, 23 (8 Pt 1): 1298-1303.
4 Sokol H, Pigneur B, Watterlot L, et al.Faecalibacteriumprausnitziiis an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients[J]. Proc Natl Acad Sci U S A, 2008, 105 (43): 16731-16736.
5 Qiu X, Zhang M, Yang X, et al.Faecalibacteriumprausnitziiupregulates regulatory T cells and anti-inflammatory cytokines in treating TNBS-induced colitis[J]. J Crohns Colitis, 2013, 7 (11): e558-e568.
6 Miquel S, Martín R, Rossi O, et al.Faecalibacteriumprausnitziiand human intestinal health[J]. Curr Opin Microbiol, 2013, 16 (3): 255-261.
7 Chen W, Liu F, Ling Z, et al. Human intestinal lumen and mucosa-associated microbiota in patients with colorectal cancer[J]. PLoS One, 2012, 7 (6): e39743.
8 章颖,于成功. 丁酸钠和1,25-(OH)2D3对人结肠癌细胞增殖和hTERT表达的影响[J]. 胃肠病学, 2011, 16 (5): 277-280.
9 闵军,刘璐,商昌珍,等. 丁酸钠增强未成熟树突状细胞表达吲哚胺2,3双加氧酶抑制T细胞增殖[J]. 中华实验外科杂志, 2009, 26 (2): 169-171.
10Kerkmann M, Rothenfusser S, Hornung V, et al. Activation with CpG-A and CpG-B oligonucleotides reveals two distinct regulatory pathways of type Ⅰ IFN synthesis in human plasmacytoid dendritic cells[J]. J Immunol, 2003, 170 (9): 4465-4474.
11Murad YM, Clay TM. CpG oligodeoxynucleotides as TLR9 agonists: therapeutic applications in cancer[J]. BioDrugs, 2009, 23 (6): 361-375.
12Pernot S, Terme M, Voron T, et al. Colorectal cancer and immunity: what we know and perspectives[J]. World J Gastroenterol, 2014, 20 (14): 3738-3750.
13Berger A. Th1 and Th2 responses: what are they?[J]. BMJ, 2000, 321 (7258): 424.
14Li-Weber M, Krammer PH. Regulation of IL4 gene expression by T cells and therapeutic perspectives[J]. Nat Rev Immunol, 2003, 3 (7): 534-543.
15Chen J, Chen Z. The effect of immune microenvironment on the progression and prognosis of colorectal cancer[J]. Med Oncol, 2014, 31 (8): 82.
·论著·
FaecalibacteriumprausnitziiGenomic DNA Enhances the Killing Activity of Peripheral Blood Mononuclear Cells against Human Colon Cancer LoVo Cells by Upregulating Th1 Immune ResponseZHANGTao1,ZHANGMin1,TANGAirong1,CAOPing2,XIELijuan1,YUChenggong1,3.1DepartmentofGastroenterology,theAffiliatedDrumTowerHospitalofNanjingUniversityMedicalSchool,Nanjing(210008);2DepartmentofGastroenterology,theDrumTowerClinicalMedicalCollegeofNanjingMedicalUniversity,Nanjing;3DepartmentofGastroenterology,YizhengHospital,DrumTowerHospitalGroupofNanjing,Nanjing
Correspondence to: YU Chenggong, Email: chenggong_yu@nju.edu.cn
Background:Faecalibacteriumprausnitzii(Fp) is a commensal intestinal bacterium that exhibits anti-inflammatory and immunomodulatory capacityinvivoandinvitro. It has been reported that Fp in intestinal lumen was reduced in patients with colorectal cancer, which might be a factor associated with cancer development. Aims: To investigate the effect and immunological mechanism of Fp and its genomic DNA (fDNA) on the killing activity of peripheral blood mononuclear cells (PBMCs) against human colon cancer LoVo cells. Methods: PBMCs derived from healthy adults were co-culturedinvitrowith Fp, fDNA, or the digested fDNA (d-fDNA), respectively. Killing activity of PBMCs against LoVo cells was measured by MTT assay; concentrations of interferon-gamma (INF-γ), a Th1-type cytokine and interleukin-4 (IL-4), a Th2-type cytokine in culture supernatant of PBMCs were determined by ELISA; and expressions of T-bet and GATA3, the transcription factors specific for Th1 and Th2 cells, were measured by real-time PCR. Results: Compared with the PBMCs not treated, fDNA could significantly enhance the killing activity of PBMCs against LoVo cells (P<0.05); meanwhile, it promoted IFN-γ secretion, up-regulated T-bet mRNA expression and inhibited IL-4 secretion and GATA3 mRNA expression in PBMCs (P<0.05). Similar effects were not observed in PBMCs treated with Fp and d-fDNA. Conclusions: fDNA enhances the killing activity of PBMCs against human colon cancer cells by up-regulating Th1 immune response.
Key wordsFaecalibacterium prausnitzii;Interferon-gamma;Interleukin-4;Th1-Th2 Balance;
通信作者&本文,Email: chenggongyu@nju.edu.cn
DOI:10.3969/j.issn.1008-7125.2015.08.002

