乌梅丸对结肠炎大鼠δ阿片受体、β-抑制蛋白1、Bcl-2表达的影响
乌梅丸对结肠炎大鼠δ阿片受体、β-抑制蛋白1、Bcl-2表达的影响
张丽娟1陈小艳2范恒1#段雪云3
华中科技大学同济医学院附属协和医院中西医结合科1(430022)
湖北省襄阳市中心医院(北区)消化科2湖北中医药大学附属医院药剂科3

*基金项目:国家自然科学基金(30772878,81072944)
背景:溃疡性结肠炎(UC)是慢性非特异性肠道炎症性疾病,发病机制尚未明确,肠黏膜免疫功能紊乱可能起有关键作用。目的:探讨乌梅丸对结肠炎模型大鼠δ阿片受体(DOR)、β-抑制蛋白1(β-arrestin1)、Bcl-2表达的影响。方法:56只Sprague-Dawley大鼠随机分为模型组、乌梅丸组、美沙拉秦组和空白组,模型组、乌梅丸组和美沙拉秦组采用5% TNBS和50%乙醇灌肠诱导结肠炎。造模成功后,乌梅丸组、美沙拉秦组分别予乌梅丸药液和美沙拉秦悬浊液灌胃,模型组和空白组予0.9% NaCl溶液灌胃,连续15 d,第16 d处死大鼠,取结肠标本。分别采用免疫组化法和real-time PCR检测结肠组织DOR、β-arrestin1、Bcl-2蛋白和mRNA表达。结果:乌梅丸能明显改善模型大鼠的结肠炎症损伤。模型组结肠组织DOR、β-arrestin1、Bcl-2蛋白和mRNA表达水平较空白组显著升高(P<0.05);乌梅丸组和美沙拉秦组DOR、β-arrestin1、Bcl-2蛋白和mRNA表达水平较模型组显著降低(P<0.05),但两组间差异无统计学意义(P>0.05)。结论:DOR-β-arrestin1-Bcl-2信号转导通路参与了UC发病过程,乌梅丸可能通过干预该通路发挥对UC的治疗效应。
关键词结肠炎, 溃疡性;受体, 阿片样, δ;抑制蛋白;基因,bcl-2;乌梅丸
溃疡性结肠炎(ulcerative colitis, UC)是慢性非特异性肠道炎症性疾病,发病机制尚未明确。目前细胞因子介导的诸多信号转导通路在UC发病中的作用备受关注。炎性细胞因子诱导T淋巴细胞在肠道内大量聚集,导致肠黏膜免疫功能紊乱,此为UC发病过程中的关键环节[1-3]。Itoh等[4]对克罗恩病(Crohn’s disease, CD)患者的研究发现,抗凋亡蛋白Bcl-2与促凋亡蛋白Bax比例失衡可导致肠黏膜T细胞凋亡缺陷,可能与肠道慢性炎症的发生有关。β-抑制蛋白1(β-arrestin1)作为细胞内信号转导分子,可将δ阿片受体(δ-opioid receptor, DOR)刺激信号转运至细胞核,促进Bcl-2基因转录,使CD4+T细胞凋亡抵抗增加,诱导自身免疫性疾病发生[5-6]。目前,临床治疗炎症性肠病(IBD)以5-氨基水杨酸类、糖皮质激素、免疫抑制剂以及生物制剂为主。有研究[7]表明乌梅丸治疗UC的疗效与5-氨基水杨酸相当。本研究通过探讨乌梅丸对结肠炎模型大鼠结肠组织DOR、β-arrestin1、Bcl-2表达的影响,分析乌梅丸治疗UC的潜在分子机制。
材料与方法
一、实验动物和主要试剂
健康雄性清洁级Sprague-Dawley(SD)大鼠56只,8周龄,体质量200~250 g,由华中科技大学同济医学院动物中心提供,SPF级环境下饲养。2,4,6-三硝基苯磺酸(TNBS)购自Sigma公司;乌梅丸药液组方中各味生药购自武汉协和医院;美沙拉秦购自Ethypharm公司;兔抗大鼠DOR多克隆抗体购自Millipore公司,兔抗大鼠β-arrestin1单克隆抗体购自CST公司,兔抗大鼠Bcl-2多克隆抗体购自武汉博士德生物工程有限公司,兔/鼠通用型免疫组化试剂盒购自Takara公司;TRIzol®试剂、逆转录试剂盒购自Invitrogen公司,real-time PCR试剂盒购自Toyoko公司。
二、方法
1. 模型制备和分组:56只SD大鼠随机分为模型组、乌梅丸组、美沙拉秦组和空白组,每组14只,禁食不禁水,24 h后采用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉。模型组、乌梅丸组和美沙拉秦组采用5% TNBS 0.6 mL+50%乙醇0.25 mL灌肠诱导结肠炎,具体步骤参照Morris等[8]的研究,空白组给予等体积0.9% NaCl溶液。因造模过程中有大鼠死亡,各组大鼠数量不均,故每组取10只大鼠用于后续实验。造模成功后,乌梅丸组予乌梅丸药液(0.51 g/mL)、美沙拉秦组予美沙拉秦悬浊液(0.5 g/L)、模型组和空白组予0.9% NaCl溶液空腹灌胃,3 mL/只,1次/d,连续15 d。第16 d禁食不禁水24 h后处死大鼠,采集距肛门8 cm病变明显处结肠标本。
2. 组织病理学检查:取大鼠结肠标本置于4%甲醛溶液中固定,常规脱水、石蜡包埋、切片,行HE染色,观察大鼠结肠黏膜组织病理学改变。
3. 免疫组化法检测DOR、β-arrestin1、Bcl-2蛋白表达:采用兔/鼠通用型免疫组化试剂盒进行检测。各组大鼠结肠标本石蜡包埋、切片、脱蜡、水化,微波高压修复抗原,以3% H2O2阻断内源性过氧化物酶,分别加入兔抗大鼠DOR多克隆抗体(1∶400)、兔抗大鼠β-arrestin1单克隆抗体(1∶200)、兔抗大鼠Bcl-2多克隆抗体(1∶500),4 ℃过夜,加入聚合酶增强剂,室温孵育30 min,加入酶标羊抗兔二抗,室温孵育30 min,DAB显色,苏木精复染,常规脱水,中性树胶封片,光学显微镜下观察。采用Image-Pro Plus 6.0图像分析软件,分析目的蛋白免疫组化染色阳性物质累积光密度(IOD)值。
4. Real-time PCR检测DOR、β-arrestin1、Bcl-2 mRNA表达:取各组大鼠结肠标本,以TRIzol®试剂提取总RNA,逆转录合成cDNA,具体步骤参照逆转录试剂盒说明书。采用Primer 6.0软件设计DOR、β-arrestin1、Bcl-2、β-actin引物。DOR引物上游:5’-GCA TCT GGG TCT TGG CTT CA-3’,下游:5’-GCG AAG AGG AAC ACG CAG AT-3’;β-arrestin1引物上游:5’-GCT GTG GAA CTG CCC TTT ACC-3’,下游:5’-CCA TCA TCC TCT TCG TCC TTG-3’;Bcl-2引物上游:5’-TTT GAT TTC TCC TGG CTG TCT-3’,下游:5’-CTG ATT TGA CCA TTT GCC TG-3’;内参β-actin引物上游:5’-CGT TGA CAT CCG TAA AGA CCT C-3’,下游:5’-TAG GAG CCA GGG CAG TAA TCT-3’。上述引物均由上海英骏生物技术有限公司合成。按试剂盒说明书进行操作,行real-time PCR扩增。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,4 ℃终止反应。采用2-△△Ct法计算目的基因相对表达量。
三、统计学分析
结果
一、结肠组织病理学改变
空白组结肠黏膜组织结构完整,腺体排列整齐;模型组结肠黏膜组织腺体排列紊乱,杯状细胞减少,黏膜层和固有层可见弥漫性淋巴细胞、中性粒细胞以及浆细胞浸润;乌梅丸组和美沙拉秦组结肠黏膜组织结构完整,与模型组相比,黏膜层和固有层炎性细胞浸润减轻,杯状细胞增多,腺体排列较整齐(图1)。

A:空白组;B:模型组;C:乌梅丸组;D:美沙拉秦组
二、结肠组织DOR、β-arrestin1、Bcl-2蛋白表达
DOR、β-arrestin1、Bcl-2免疫组化染色阳性物质定位于细胞质,呈棕色。与空白组相比,模型组结肠组织DOR、β-arrestin1和Bcl-2蛋白表达水平显著升高(P<0.05)。与模型组相比,乌梅丸组和美沙拉秦组结肠组织DOR、β-arrestin1和Bcl-2蛋白表达水平显著降低(P<0.05),但两组间差异无统计学意义(P>0.05)(表1,图2-4)。

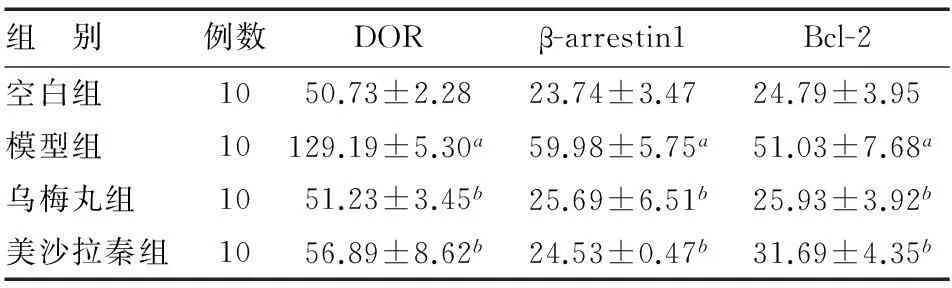
组 别例数DORβ-arrestin1Bcl-2空白组1050.73±2.2823.74±3.4724.79±3.95模型组10129.19±5.30a59.98±5.75a51.03±7.68a乌梅丸组1051.23±3.45b25.69±6.51b25.93±3.92b美沙拉秦组1056.89±8.62b24.53±0.47b31.69±4.35b
a与空白组比较,P<0.05;b与模型组比较,P<0.05
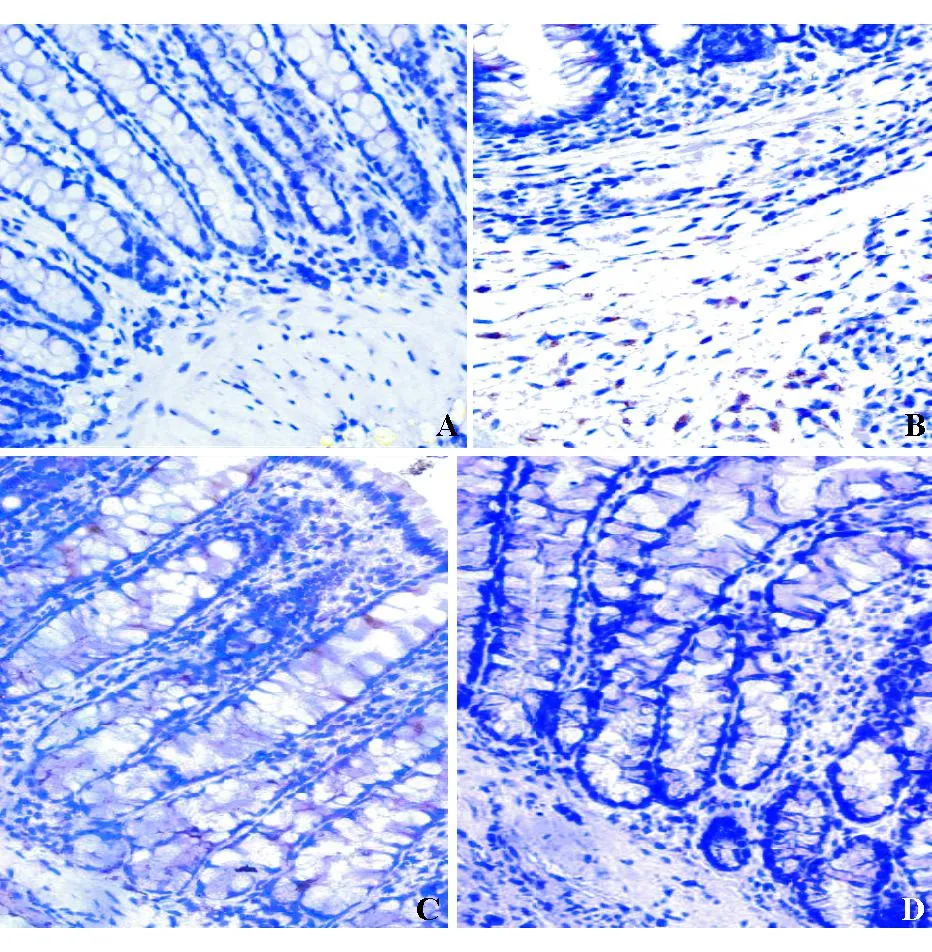
A:空白组;B:模型组;C:乌梅丸组;D:美沙拉秦组
图2各组大鼠结肠组织DOR蛋白表达(免疫组化ABC法,×400)

A:空白组;B:模型组;C:乌梅丸组;D:美沙拉秦组
图3各组大鼠结肠组织β-arrestin1蛋白表达(免疫组化ABC法,×400)

A:空白组;B:模型组;C:乌梅丸组;D:美沙拉秦组
图4各组大鼠结肠组织Bcl-2蛋白表达(免疫组化ABC法,×400)
三、结肠组织DOR、β-arrestin1、Bcl-2 mRNA表达
与空白组相比,模型组结肠组织DOR、β-arrestin1和Bcl-2 mRNA表达水平显著升高(P<0.05)。与模型组相比,乌梅丸组和美沙拉秦组结肠组织DOR、β-arrestin1和Bcl-2 mRNA表达水平显著降低(P<0.05),但两组间差异无统计学意义(P>0.05)(表2)。


组 别例数DORβ-arrestin1Bcl-2空白组101.11±0.191.12±0.200.99±0.04模型组109.92±2.40a9.96±2.39a2.03±0.44a乌梅丸组103.81±0.66b3.80±0.67b1.21±0.11b美沙拉秦组104.29±1.32b4.30±1.31b1.11±0.16b
a与空白组比较,P<0.05;b与模型组比较,P<0.05
讨论
IBD患者肠黏膜T淋巴细胞凋亡调控缺陷导致细胞凋亡抵抗增加,可能是IBD发病机制的中心环节[4,9-11]。细胞凋亡由多种细胞内、外信号分子共同调节,其中抗凋亡蛋白Bcl-2与促凋亡蛋白Bax比例平衡是调节CD4+T细胞凋亡的重要途径。研究[12-13]发现,与Bcl-2-/-小鼠相比,Bcl-2转基因小鼠的CD4+T细胞生存期明显延长。本研究结果显示,模型组大鼠结肠组织Bcl-2蛋白和mRNA表达水平较空白组显著升高,提示Bcl-2在UC发病机制中发挥重要作用,可能与其调节CD4+T细胞凋亡有关。Shi等[14]的研究以β-arrestin1 siRNA干扰Jurkat细胞,发现Bcl-2蛋白和mRNA表达下调,推测β-arrestin1可能是调节Bcl-2表达的上游信号分子,两者共同调控CD4+T细胞生理功能。
研究[15-16]指出,β-arrestin1可介导G蛋白偶联受体(GPCR)的生物信号传递,从而调节细胞凋亡。Pol等[17]的研究指出,β-arrestin1激活后可将DOR转运至细胞核,聚集于p27和c-fos基因启动子序列区域,促使Bcl-2启动子转录活性增强。该团队进一步的研究发现,结肠炎模型小鼠肠黏膜DOR mRNA和蛋白表达显著增加,推测可能机制为白细胞介素-1(IL-1)与肠道神经源性核转录因子核因子-κB(NF-κB)位点结合,促进DOR基因转录和翻译。
本研究结果表明,模型组大鼠结肠组织DOR、β-arrestin1、Bcl-2蛋白和mRNA表达水平均较空白组显著升高,其可能机制为:β-arrestin1将DOR膜受体信号转运至细胞核,促进抗凋亡蛋白Bcl-2表达,从而抑制炎症受损肠黏膜CD4+T细胞凋亡,使CD4+T细胞在肠黏膜内持续过度聚集,最终导致肠道炎症慢性反复发作。由此推测,DOR-β-arrestin1-Bcl-2信号转导通路在UC发病过程中起重要作用。
乌梅丸组方由乌梅、细辛、干姜、黄连、黄柏、当归、附子、蜀椒、桂枝、人参10味药组成。纵观全方,集酸苦甘辛于一体,辛开苦降,寒热并用,温清敛补,攻补兼施,药性刚柔相济,有利于脏腑气血阴阳恢复,促进阴平阳秘。UC属于中医“大瘕泻”范畴,是以脾胃虚弱为本、湿热内蕴为标的本虚标实病症,急性期主要以标实为主,通过辨证论治,乌梅丸功效与UC病因病机一致,因此以乌梅丸治疗UC能取得较好的临床疗效。
在现代医学中,诸多研究[18-21]探讨了乌梅丸用于治疗UC的分子机制,发现乌梅丸可上调结肠炎模型大鼠结肠组织中的抗炎细胞因子IL-10表达,下调促炎细胞因子肿瘤坏死因子(TNF)-α、IL-6、IL-8表达,抑制NF-κBp65活性。本研究结果表明,乌梅丸能改善结肠炎模型大鼠的结肠黏膜组织病理学改变,显著降低结肠组织DOR、β-arrestin1、Bcl-2蛋白和mRNA表达,与美沙拉秦疗效相当,推测其可能通过干预DOR-β-arrestin1-Bcl-2信号转导通路,发挥对UC的治疗效应。
综上所述,本研究结果显示,DOR-β-arrestin1-Bcl-2信号转导通路参与了UC发病过程;乌梅丸对UC具有一定治疗作用,其可能通过干预DOR-β-arrestin1-Bcl-2信号转导通路,使结肠组织CD4+T细胞的凋亡敏感性增加,炎性细胞因子分泌减少,恢复肠道免疫系统稳态,从而缓解UC症状。上述结果为乌梅丸治疗UC的分子机制研究开辟了新的途径。
参考文献
1 Monteleone G, Caprioli F. T-cell-directed therapies in inflammatory bowel diseases[J]. Clin Sci (Lond), 2010, 118 (12): 707-715.
2 Atreya R, Neurath MF. New therapeutic strategies for treatment of inflammatory bowel disease[J]. Mucosal Immunol, 2008, 1 (3): 175-182.
3 Sturm A, de Souza HS, Fiocchi C. Mucosal T cell proliferation and apoptosis in inflammatory bowel disease[J]. Curr Drug Targets, 2008, 9 (5): 381-387.
4 Itoh J, de La Motte C, Strong SA, et al. Decreased Bax expression by mucosal T cells favours resistance to apoptosis in Crohn’s disease[J]. Gut, 2001, 49 (1): 35-41.
5 Bidère N, Su HC, Lenardo MJ. Genetic disorders of programmed cell death in the immune system[J]. Ann Rev Immunol, 2006, 24: 321-352.
6 Hughes P, Bouillet P, Strasser A. Role of Bim and other Bcl-2 family members in autoimmune and degenerative diseases[J]. Curr Dir Autoimmun, 2006, 9: 74-94.
7 Fan H, Qiu MY, Mei JJ, et al. Effects of four regulating-intestine prescriptions on pathology and ultrastructure of colon tissue in rats with ulcerative colitis[J]. World J Gastroenterol, 2005, 11 (31): 4800-4806.
8 Morris GP, Beck PL, Herridge MS, et al. Hapten-induced model of chronic inflammation and ulceration in the rat colon[J]. Gastroenterology, 1989, 96 (3): 795-803.
9 Doering J, Begue B, Lentze MJ, et al. Induction of T lymphocyte apoptosis by sulphasalazine in patients with Crohn’s disease[J]. Gut, 2004, 53 (11): 1632-1638.
10Sturm A, Leite AZ, Danese S, et al. Divergent cell cycle kinetics underlie the distinct functional capacity of mucosal T cells in Crohn’s disease and ulcerative colitis[J]. Gut, 2004, 53 (11): 1624-1631.
11Peppelenbosch MP, van Deventer SJ. T cell apoptosis and inflammatory bowel disease[J]. Gut, 2004, 53 (11): 1556-1558.
12Hildeman DA, Zhu Y, Mitchell TC, et al. Activated T cell deathinvivomediated by proapoptotic Bcl-2 family member Bim[J]. Immunity, 2002, 16 (6): 759-767.
13Veis DJ, Sorenson CM, Shutter JR, et al. Bcl-2-deficient mice demonstrate fulminant lymphoid apoptosis, polycystic kidneys, and hypopigmented hair[J]. Cell, 1993, 75 (2): 229-240.
14Shi Y, Feng Y, Kang J, et al. Critical regulation of CD4+ T cell survival and autoimmunity by beta-arrestin 1[J]. Nat Immunol, 2007, 8 (8): 817-824.
15Shenoy SK, Lefkowitz RJ. Multifaceted roles of beta-arrestins in the regulation of seven-membrane-spanning receptor trafficking and signaling[J]. Biochem J, 2003, 375 (Pt 3): 503-515.
16Revankar CM, Vines CM, Cimino DF, et al. Arrestins block G protein-coupled receptor-mediated apoptosis[J]. J Biol Chem, 2004, 279 (23): 24578-24584.
17Pol O, Palacio JR, Puig MM. The expression of δ-and κ-opioid receptor is enhanced during intestinal inflammation in mice[J]. J Pharmacol Exp Ther, 2003, 306 (2): 455-462.
18Fan H, Shen L, Tang Q, et al. Effect of Wumeiwan on cytokines TNF-alpha, IL-6, IL-8, IL-10 and expression of NF-kappaBp65 in rats with ulcerative colitis[J]. J Huazhong Univ Sci Technolog Med Sci, 2009, 29 (5): 650-654.
19梁丽,范恒,段雪云,等. β2AR、β-arrestin2、NF-κBp65在溃疡性结肠炎大鼠中的表达及乌梅丸的干预作用[J]. 世界华人消化杂志, 2010, 18 (16): 1650-1655.
20范恒,邱明义,梅家俊,等. 乌梅丸对溃疡性结肠炎大鼠组织细胞因子的干预效应[J]. 中国临床康复, 2006, 10 (7): 87-89.
21范恒,段雪云,庄雄,等. 乌梅丸对溃疡性结肠炎大鼠结肠组织NF-κB P65的影响[J]. 世界华人消化杂志, 2008, 16 (8): 896-899.
(2015-04-12收稿;2015-06-18修回)
Effects of Wumeiwan on δ-Opioid Receptor, β-Arrestin1 and Bcl-2 Expressions in Rats with ColitisZHANGLijuan1,CHENXiaoyan2,FANHeng1,DUANXueyun3.1DepartmentofIntegratedChineseandWesternMedicine,UnionHospitalAffiliatedtoTongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan(430022);2DepartmentofGastroenterology,XiangyangCentralHospital,Xiangyang,HubeiProvince;3DepartmentofPharmacy,theAffiliatedHospitalofHubeiUniversityofChineseMedicine,Wuhan
Correspondence to: FAN Heng, Email: fanheng009@aliyun.com
Background: Ulcerative colitis (UC) is a chronic and nonspecific intestinal inflammatory disease and its pathogenic mechanism has not yet been clarified. Intestinal mucosal immune function disorder may play a key role in the pathogenesis of UC. Aims: To investigate the effects of Wumeiwan on expressions of δ-opioid receptor (DOR), β-arrestin1 and Bcl-2 in rats with colitis. Methods: Fifty-six Sprague-Dawley rats were randomly divided into model group, Wumeiwan group, mesalazine group and blank group. Rats in model group, Wumeiwan group and mesalazine group were administered intrarectally with 5% TNBS and 50% ethanol to induce experimental colitis. After colitis models were established, rats in Wumeiwan group and mesalazine group were administered intragastrically with Wumeiwan and mesalazine suspension, respectively, and rats in model group and blank group were given intragastrically with 0.9% NaCl solution, all for 15 days. On day 16, all the rats were sacrificed and colon samples were obtained. Protein and mRNA expressions of DOR, β-arrestin1 and Bcl-2 in colonic tissue were determined by immunohistochemistry and real-time PCR, respectively. Results: The inflammatory injury in colonic tissue of rats with experimental colitis was significantly attenuated when treated with Wumeiwan, Protein and mRNA expressions of DOR, β-arrestin1 and Bcl-2 in colonic tissue of model group were significantly higher than those of blank group (P<0.05). Protein and mRNA expressions of DOR, β-arrestin1 and Bcl-2 in colonic tissue of Wumeiwan group and mesalazine group were significantly lower than those of model group (P<0.05), however, no significant differences were found between the two groups (P>0.05). Conclusions: DOR-β-arrestin1-Bcl-2 signal transduction pathway may play a central role in the pathogenesis of UC. Intervening this signaling pathway may be one of the mechanisms of attenuating UC by Wumeiwan.
Key wordsColitis, Ulcerative;Receptors, Opioid, delta;Arrestin;Genes, bcl-2;WUMEI PILL
通信作者#本文, Email: fanheng009@aliyun.com
DOI:10.3969/j.issn.1008-7125.2015.08.005

