TricineSDSPAGE分析抑肽酶相对分子质量的方法初探
周 伟、易荣大、彭 文、孙 磊、亓振国、江立新
(合肥天麦生物科技发展有限公司,合肥 230601)
周 伟、易荣大、彭 文、孙 磊、亓振国、江立新*
(合肥天麦生物科技发展有限公司,合肥 230601)
目的:分析小分子多肽抑肽酶的相对分子质量。方法:用Tricine-SDS-PAGE法,采用三羟甲基氨基甘氨酸(Tricine)代替甘氨酸作为尾随离子,用来检测小分子多肽的相对分子质量。结果:根据标准曲线测算抑肽酶分子量分别为6 487.5 Da(1 μg)、6 677.6 Da(2 μg),接近真实值。结论:本方法能够消除由于多肽分子与标准蛋白质空间构象的不同带来的误差,并克服了普通SDS-PAGE小分子蛋白条带带型弥散的缺点。
Tricine-SDS-PAGE,小分子多肽,抑肽酶,相对分子质量
抑肽酶(aprotinin) 是一种Kunitz型蛋白酶抑制剂,由58个氨基酸组成,分子量6 512 Da,等电点为pH 10.5,通过3对链内二硫键形成稳定的三级结构。天然抑肽酶的第15位赖氨酸是其活性中心, 参与和多种丝氨酸蛋白酶催化中心的特异结合,是一种广谱的丝氨酸蛋白酶抑制剂,能够抑制如胰蛋白酶、糜乳蛋白酶、纤溶酶、凝血酶、组织激肽释放酶等多种酶的活性,用途十分广泛[1-3]。需要控制这些酶活性或适时终止这些酶切反应时,可以选择抑肽酶。因而,有必要建立简单快速定性或定量检测抑肽酶的方法。
国内对小分子量蛋白的分子量检测长期采用凝胶色谱法[4,5],但该方法对标准蛋白质与待测蛋白质的分子空间构象的一致性要求较高[6],操作较复杂,测定所需时间较长。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),简称 SDS电泳,主要用于测定蛋白质亚基分子量。与层析方法(凝胶过滤)相比,其不需要昂贵的仪器设备,操作简便,能在几个小时内得到结果,有较高的重复性,且不需要非常纯的样品(取决于样品的组成和对结果的要求),是目前所接受的用于测定亚基分子量的一种最好的方法。常规甘氨酸(Glycine)-SDS-PAGE能分离10~200 kDa的蛋白大分子,而对10 kDa以下的抑肽酶(6 512 Da)分辨率低,且极易扩散丢失,无着色带。本试验拟建立一套分析小分子多肽抑肽酶的Tricine-SDS-PAGE方法。Tricine-SDS-PAGE采用Tricine (三羟甲基氨基甘氨酸)代替甘氨酸作为尾随离子,用来检测小分子多肽分子量,消除由于多肽分子与标准蛋白质空间构象的不同带来的误差,克服了普通SDS-PAGE小分子蛋白条带带型弥散的缺点[7],定量准确;通过试验摸索,确定采用两层不连续SDS-PAGE,与通行Tricine-SDS-PAGE相比无需灌注夹层胶,操作简单,有一定推广应用价值。
1 材料与方法
1.1 仪器与试药 PowerPac Basic电泳电源、Gel Doc XR+凝胶成像系统、Criterion Cell垂直电泳槽(BIO-RAD公司);POS-300平板摇床(Grant-Bio公司);Mili-Q超纯水机(密理博公司)。丙烯酰胺(上海生工,批号LY0320B0213J),甲叉双丙烯酰胺(国药集团,批号20111012),十二烷基磺酸钠(SDS,sigma,批号BCBH3065V),四甲基乙二胺(TEMED,合肥博美,批号HFBII15012010528),考马斯亮蓝R-250(国药集团,批号W20110926),过硫酸铵(APS,国药集团,批号F20111213),三羟甲基氨基甲烷(Tris,国药集团,批号20120327),三羟甲基甲基甘氨酸(Tricine)、2×Tricine Loading Buffer(上海生工生物工程有限责任公司);甲醇为分析纯,乙酸为优级纯;低分子量蛋白质标准品P0032-1(6 200~66 200 Da,兰旭生物科技有限公司)。
1.2 方法
1.2.1 电泳贮存液的制备 按表1和表2配制阳极缓冲液、阴极缓冲液、凝胶缓冲液以及不同浓度的丙烯酰胺贮存液备用。
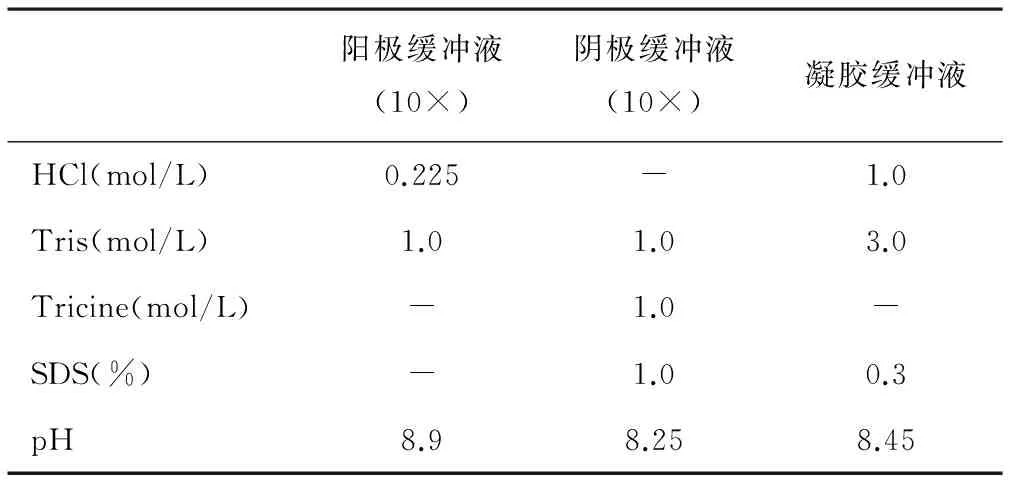
表1 电泳缓冲液

表2 丙烯酰胺储存液
1.2.2 凝胶配制 依照表3给出的数据分别配制分离胶和浓缩胶。

表3 凝胶配方
1.2.3 样品制备 称取抑肽酶冻干粉适量,加入超纯水分别配制成0.2和0.1 mg/ml的溶液,各取10 μl,分别加入等体积的2×Tricine Loading Buffer,中速涡旋混匀后室温静置15 min。
1.2.4 电泳条件及凝胶染色脱色处理 采用不连续缓冲系统,上、下层储液槽分别装入阴、阳极缓冲液。用微量移液器小心吸取20 μl处理好的抑肽酶样品及标准分子量多肽,加入点样孔。恒流10 mA电泳约30 min,待样品进入分离胶后,将电流调节至40 mA,运行约2 h,停止电泳。使用0.125%的考马斯亮蓝染色液,室温震荡染色约1 h,弃去染色液,加入纯化水约200 ml,微波炉高火加热3 min脱色,重复5次。
2 结果
Tricine-SDS-PAGE系统中,使用16% T、6% C的分离胶能使各条带带型紧致无扩散。用标准蛋白分子量对其在分离胶中迁移的距离进行直线回归分析,回归方程为Y=-1.31X+4.79(R2=0.975 6),线性范围为6 200~66 200 Da。根据标准曲线测算抑肽酶分子量分别为6 487.5 Da(1 μg)和6 677.6 Da(2 μg),接近真实值,见图1。

图1 16% TricineSDSPAGE电泳照片
3 讨论
Tricine-SDS-PAGE电泳方法重复性好,条件稳定,可有效分离分子量小于10 kDa的抑肽酶,为小分子量多肽研究作参考。然而不同的实验样本需要考虑到不同的浓缩胶和分离胶的浓度。
SDS-PAGE对蛋白质的有效分离范围取决于聚丙烯酰胺的浓度和交联度,其孔径随着双丙烯酰胺与丙烯酰胺比率的增加而减小,比率接近于 1∶20时,孔径达到最小值。分子量低于10 kD的小分子肽类,即使用较高浓度的聚丙烯酰胺凝胶的SDS-PAGE也得不到很好的分离。在含SDS缓冲液的样品中,小分子多肽的浓缩是较困难的,这是因为小分子多肽与SDS形成的复合体具有和SDS本身类似的电荷和大小,因此浓缩对于小分子多肽的SDS-PAGE来说就成了一个突出的问题。上述方法中Tricine以阳离子形式存在可以作为拖尾离子,使小分子多肽能够在浓缩胶中形成尽可能窄的带。
此外,快速的固定、染色和脱色对于小分子多肽电泳是必要的。这主要是由于小分子多肽对染料的结合力较弱,易扩散冲洗掉而着色较差[7],另外分离胶中添加尿素更会导致这一现象的加剧。采用纯化水高温脱色,可以避免银染的烦琐,及高浓度考染耗时长的缺点[8],短时间内高质量地完成凝胶脱色。
1 Robert S, Wagner B K, Boulanger M,etal.Aprotinin[J]. The Annals of Pharmacotherapy,1996, 30(4) : 372-380
2 Grzesiak A, Krokoszynska I, Krowarsch D,etal.Inhibition of six serine proteinases of the human coagulation system by mutants of bovine pancreatic trypsin inhibitor[J]. The Journal of Bio logical Chemistry, 2000, 275(43) : 33346-33352
3 孔毅,乔德水. 重组人胰岛素生产工艺监控方法研究进展[J]. 药物生物技术, 2003,10(2):121-124
4 迟玉杰.实用蛋白质制备技术[M].哈尔滨:哈尔滨理工大学出版社,1999:91-106
5 侯洋, 靳晓霞, 孙继,等. 凝胶色谱测定水处理用聚合物分子量及其分布的方法研究[A]. 2013中国水处理技术研讨会暨第33届年会论文集.2013:386-392
6 Sehagger H,von Jagow G.Trieine-sodium dodeeyl sulfate-polyaerylamidgelelectroporesis for the separation of proteins in the range from 1 to 100 KDa[J].Analytical Biochemistry,1987,166:368-379
7 石继红,赵永同,王俊樱.SDS-聚丙烯酰胺凝胶电泳分析小分子多肽[J]. 第四军医大学学报, 2000,21(6):761-763
8 杨联萍,孔祥平,易学瑞. SDS-PAGE电泳对小分子多肽的分析[J].生物工程进展,1998,18(6):49-51
2015-02-05
R927.11
A
1006-5687(2015)03-0011-03
*通讯作者:江立新,E-mail:jianglixin@htbt.com.cn。

