胃癌组织及外周血中CDX2基因甲基化的关系及其临床意义*
蒋 伟,张健锋,毛振彪
(南通大学附属医院1急诊内科;2消化内科,江苏226001)
胃癌组织及外周血中CDX2基因甲基化的关系及其临床意义*
蒋 伟1**,张健锋2,毛振彪2
(南通大学附属医院1急诊内科;2消化内科,江苏226001)
目的:探讨胃癌患者癌组织及其外周血中CDX2基因启动子CpG岛甲基化的关系及其临床意义。方法:收集40例胃癌患者外周血和术后胃癌组织标本、12例胃良性病变旁正常胃组织以及20例健康体检者外周血标本,应用甲基化特异性PCR(MSP)检测组织及外周血中CDX2基因启动子CpG岛甲基化状态。结果:胃癌组织中CDX2基因启动子CpG岛甲基化率为72.5%,外周血中CDX2基因启动子CpG岛甲基化率为62.5%,差异无统计学意义(P>0.05);胃癌组织及外周血中的CDX2基因启动子CpG岛甲基化呈正相关(r=0.5913,P=0.0012)。结论:胃癌组织及外周血中CDX2基因启动子CpG岛甲基化水平一致,检测患者外周血CDX2基因启动子CpG岛甲基化可为胃癌的临床诊治提供了一个简便、快捷的途径。
CDX2;DNA甲基化;胃癌
1 资料与方法
1.1 一般资料 收集南通大学附属医院普外科2011年8月至2013年05月胃癌手术切除标本40例,胃良性病变旁正常胃组织12例作为对照,标本均于术后30min内予液氮速冻后转至-80℃冰箱保存备用。40例胃癌患者年龄35~80岁,其中男23例,女17例,术前均未接受放化疗,无长期服用非甾体类抗炎及糖皮质激素史,均有详细的临床资料和手术记录,均为术后病理确诊。所有患者均于术前抽取外周血,分离所得血清-80℃冻存。20例正常对照血清来源于南通大学附属医院体检中心的健康志愿者。本研究经过南通大学附属医院医学伦理委员会批准及患者知情同意。
1.2 方法 MSP检测:-80℃冰箱中取出组织及外周血样本,其中组织剪取50mg,外周血300μL,按Dneasy Blood&Tissue Kit分别抽提DNA,紫外分光光度计检测DNA纯度及含量。取2μgDNA,参照EpiTectRBisulfite Handbook对基因组DNA进行亚硫酸氢盐修饰。以亚硫酸氢盐修饰后DNA为模板,按照EpiTectRMSP Handbook说明分别用甲基化引物和非甲基化引物进行PCR扩增。CDX2甲基化引物:5’-CGT CGG TTT GGG GTT TCG TAC-3’(上游),5’-GAT ACT CCG CTA ACT CCT CGC G-3’(下游),扩增产物169bp;非甲基化引物:5’-GAA GTT GTT GGT TTG GGG TTT TGT AT-3’(上游),5’-CCC ACA ATA CTC CAC TAA CTC CTC ACA-3’(下游),扩增产物180bp。PCR反应条件:预变性95℃10min;94℃15s、58℃30s、72℃30s,共35个循环;最后72℃延伸10min。取5μL PCR扩增产物于2.5%琼脂糖凝胶电泳,在凝胶图像成像仪上观察结果。
1.3 统计学处理 应用Stata 11.0统计软件,率的比较采用χ2检验,胃癌组织和外周血中CDX2基因启动子CpG岛甲基化的相关性分析采用Spearman秩相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 胃癌组织中CDX2基因启动子甲基化状态分析 MSP检测提示,40例胃癌组织中,有19例完全甲基化,有10例发生部分甲基化,甲基化阳性率为72.5%。12例正常胃组织中未出现甲基化和未甲基化条带。(图1)
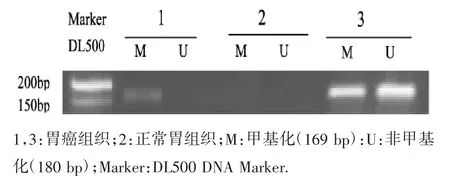
图1 胃癌组织CDX2基因启动子CpG岛甲基化情况
2.2 外周血中CDX2基因启动子甲基化状态分析在40例胃癌患者血清中,CDX2基因完全甲基化17例,部分甲基化8例,甲基化阳性率为62.5%(图2)。与胃癌组织甲基化阳性率比较,差异无统计学意义(P>0.05)。见表1。

图2 外周血CDX2基因启动子CpG岛甲基化情况
2.3 胃癌组织与外周血中CDX2基因启动子甲基化的关系 40例患者胃癌组织与外周血中CDX2基因启动子CpG岛甲基化阳性率的差异无统计学意义(表1)。Spearman秩相关分析提示,外周血中CDX2基因甲基化率与该患者胃癌组织中CDX2基因甲基化率呈正相关(r=0.5913,P=0.0012),见表2。

表1 胃癌组织及外周血中CDX2基因甲基化状态

表2 胃癌组织和外周血CDX2基因甲基化状态相关性
3 讨 论
癌基因的显性作用和抑癌基因的失活是恶性肿瘤发生的分子基础。目前许多研究提示,抑癌基因由于启动子区域CpG岛高甲基化而导致失活是胃癌发生、发展过程中的一个重要原因[5]。DNA甲基化发生在CpG二核苷酸上对胞嘧啶的共价修饰,是基因在转录水平的调控方式之一[6]。DNA甲基化具有可逆性,甲基化抑制剂5-杂氮-2’-脱氧胞苷(5-Aza-CdR)通过抑制甲基化酶,使启动子区高甲基化的抑癌基因重新表达[7],已用于治疗骨髓增生异常综合征等多种恶性血液病。CDX2是一种核转录因子,最早由Mlodzik从果蝇中分离,全长22~23kb,位于染色体13q12~13,由3个外显子和2个内含子构成[8]。CDX2主要表达于内胚层来源的肠道上皮及胰腺导管、腺泡上皮,但在正常上消化道黏膜组织中不表达。CDX2基因表达异常对消化系肿瘤的发生和发展起着重要作用[9]。近期研究表明,CDX2在上消化道具有抑癌基因的功能,Liu等[10]报道在肠上皮化生-异型增生-胃癌发生过程中,CDX2的表达水平逐步下降,在肠上皮化生和异型增生中CDX2缺失表达的患者更容易进展成胃癌。
我们的前期研究也发现,CDX2基因在胃癌组织中的表达缺失率约40%,与此同时,我们验证了胃癌MKN45细胞株CDX2基因启动子区CpG岛呈高甲基化状态,CDX2 mRNA和蛋白表达缺失,经不同浓度5-Aza-CdR处理后,MKN45细胞株基因启动子区CpG岛高甲基化状态得到逆转,CDX2 mRNA和蛋白均出现表达,且肿瘤细胞发生凋亡,提示CDX2基因启动子区域CpG岛甲基化是其表达缺失的一个重要机制,诱导包括CDX2基因在内的具有生长调控作用的基因再表达能发挥抑制胃癌细胞生长及促进胃癌细胞凋亡的作用[11]。
肿瘤患者外周血中往往存在着游离DNA,其含量明显高于健康人[12]。有关研究表明,肿瘤患者的血清游离DNA往往与原发肿瘤DNA基因组存在相同的遗传变异[13],且其变异的特征和表达量与原发肿瘤组织成正相关,提示血清游离DNA主要来源于原发肿瘤组织的表达[14],因此,检测患者外周血中的游离DNA可以发现及预测肿瘤组织的存在及某些特征性改变[15],将对临床肿瘤的预判和治疗起着重要的意义。
本研究采用MSP方法检测40例胃癌组织及其外周血中CDX2基因启动子甲基化状况,结果显示胃癌组织中的甲基化阳性率为72.5%(29/40),而在正常胃组织的阳性率为0,提示CDX2基因启动子CpG岛甲基化是胃癌发生及发展过程中的重要分子事件。同时还发现,胃癌患者外周血中CDX2基因启动子区域CpG岛甲基化阳性率为62.5%(25/40),与胃癌组织相比,差异无统计学意义,但外周血取材更经济、便捷,为胃癌的早期诊断和临床治疗提供了一种新的依据。
[1]Jones PA,Baylin SB.The epigenomics of cancer[J].Cell,2007,128(4):683-692.
[2]Deaton AM,Bird A.CpG islands and the regulation of transcription[J].Genes Dev,2011,25(10):1010-1022.
[3]Lorentz O,Duluc I,Arcangelis AD,et al.Key role of the Cdx2 homeobox gene in extracellular matrix-mediated intestinal cell differentiation[J].J Cell Biol,1997,139(6):1553-1565.
[4]Liu Q,Teh M,Ito K,et al.CDX2 expression is progressively decreased in human gastric intestinal metaplasia,dysplasia and cancer[J].Mod Pathol,2007,20(12):1286-1297.
[5]Xie Y,Li L,Wang X,et al.Overexpression of Cdx2 inhibits progression of gastric cancer in vitro[J].Int J Oncol,2010,36(2):509-516.
[6]Bird A.Perceptions of epigenetics[J].Nature,2007,447(7143):396-398.
[7]Momparler RL.Cancer epigenetics[J].Oncogene,2003,22(42):6479-6483.
[8]Daskalakis M,Nguyen TT,Nguyen C,et al.Demethylation of a hypermethylated P15/INK4B gene in patients with myelodysplastic syndrome by 5-Aza-2'-deoxycytidine(decitabine)treatment[J].Blood,2002,100(8):2957-2964.
[9]Drummond F,Putt W,Fox M,et al.Cloning and chromosome assignment of the human CDX2 gene[J].Ann Hum Genet,1997,61(Pt 5):393-400.
[10]Werling RW,Yaziji H,Bacchi CE,et al.CDX2,a highly sensitive and specific marker of adenocarcinomas of intestinal origin:an immunohistochemical survey of 476 primary and metastatic carcinomas[J].Am J Surg Pathol,2003,27(3):303-310.
[11]Zhang JF,Zhang JG,Kuai XL,et al.Reactivation of the homeotic tumor suppressor gene CDX2 by 5-aza-2'-deoxycytidine-induced demethylation inhibits cell proliferation and induces caspase-independent apoptosis in gastric cancer cells[J].Exp Ther Med,2013,5(3):735-741.
[12]Hashad D,Sorour A,Ghazal A,et al.Free circulating tumor DNA as a diagnostic marker for breast cancer[J].J Clin Lab Anal,2012,26(6):467-472.
[13]Morgan SR,Whiteley J,Donald E,et al.Comparison of KRAS mutation assessment in tumor DNA and circulating free DNA in plasma and serum samples[J].Clin Med Insights Pathol,2012,5:15-22.
[14]Wang YC,Yu ZH,Liu C,et al.Detection of RASSF1A promoter hypermethylation in serum from gastric and colorectal adenocarcinoma patients[J].World J Gastroenterol,2008,14(19):3074-3080.
[15]Zanetti-Dällenbach R,Wight E,Fan AX,et al.Positive correlation of cell-free DNA in plasma/serum in patients with malignant and benign breast disease[J].Anticancer Res,2008,28(2A):921-925.
Relationship between methylation of CDX2 gene in gastric cancer and corresponding peripheral blood
JIANG Wei1,ZHANG Jianfeng2,MAO Zhenbiao2
(1Department of Emergency;2Gastroenterology,the Affiliated Hospital of Nantong University,Jiangsu 226001)
Objective:To explore the relationship and clinical significance between methylation of CDX2 gene in gastric cancer tissues and corresponding peripheral blood.Methods:Postoperative gastric tissue and the corresponding peripheral blood were collected from 40 patients with gastric cancer,12 cases of benign gastric lesions in the adjacent normal gastric tissues and 20 cases of healthy blood samples.Methylation specific PCR was performed to detect the methylation status of CDX2 in the tumor tissues and the paired peripheral blood from 40 gastric cancer patients,to analyze the clinical significance and the relationship of each other.Results:The positive rate of methylation of CDX2 gene promoter CpG island was 72.5%(29/40)in the tumor tissues and 62.5%(25/40)in serum of gastric cancer patients,and the difference had no statistical significance.Correlation analysis showed that the CpG island methylation status of CDX2 gene promoter in gastric cancer tissues and corresponding peripheral blood was positively correlated (r=0.5913,P=0.0012).Conclusion:CDX2 gene promoter CpG island methylation can be detected in a high proportion of the tumor tissues consistent with that in the serum of gastric cancer patients,and the detection of methylation status of CDX2 gene in peripheral blood provides a more simple and fast way for the medical treatment of gastric cancer.
CDX2;DNA methylation;gastric neoplasm
R735.2
A
南通市社会发展基金资助项目(S2009022)。
2015-06-17
2015-06-18[收稿日期]2015-05-27
1006-2440(2015)04-0329-04
**[作者简介]蒋伟,男,汉族,江苏启东人,生于1984年9月,硕士,研究方向:消化道肿瘤基础与临床。 通信作者:毛振彪,E-mail: mzb63@163.com
胃癌是我国常见的消化系肿瘤之一,其发生与多基因遗传学改变和表观遗传学修饰有关,近年来表观遗传学研究是胃癌基础和临床研究的一个热点,其中,DNA甲基化是目前研究较为深入的表观遗传学机制[1]。基因启动子区域CpG岛甲基化导致基因转录失活,使蛋白表达缺失,最终导致有关肿瘤的发生发展[2]。甲基化特异性PCR(methylation-specific PCR,MSP)技术是目前检测基因启动子区域甲基化状态最常用的检测方法。尾型同源异型盒基因2(caudal type homeobox gene 2,CDX2)是CDX家族成员,在胃肠道的生长发育过程中起着重要作用[3]。近年发现,CDX2在消化道肿瘤中发挥抑癌基因的功能,在胃黏膜癌变过程中表达下调或缺失的患者临床预后较差[3,4]。本研究通过检测胃癌患者胃癌组
织及其对应外周血中CDX2基因启动子CpG岛甲基化状态,探讨两者的关系,并且为进一步探索胃癌的治疗提供理论依据。

