肝脏脱细胞支架与MIN6细胞三维共培养移植治疗Ⅰ型糖尿病实验研究*
朱沙俊,王 雷
(南通大学附属医院普外科,江苏226001)
·论著与基础研究·
肝脏脱细胞支架与MIN6细胞三维共培养移植治疗Ⅰ型糖尿病实验研究*
朱沙俊**,王 雷
(南通大学附属医院普外科,江苏226001)
目的:通过体外制备小鼠肝脏脱细胞支架并种植MIN6细胞,观测其定植生长并检测其功效发挥,为体外构建胰岛素分泌器官提供理论基础。方法:灌注法制备全肝脏脱细胞支架,将小鼠MIN6细胞种植入支架中于三维培养体系中培养,通过苏木精-伊红染色、胰岛素免疫组化分析及荧光定量聚合酶链反应检测其功效。检测MIN6细胞功能基因Insulin表达。将种植MIN6细胞的肝脏脱细胞支架移植入糖尿病小鼠体内,监测其功能发挥并初步评估其疗效。结果:体外成功制备肝脏脱细胞支架,在保留其原有脉管网络基础上,未见组织残留。HE染色显示肝脏脱细胞支架内没有细胞核染,且脉管结构保存完整。扫描电镜未见细胞结构,支架保存完整胶原纤维形态。MIN6细胞在脱细胞支架中三维培养后,检测胰岛素基因表达水平,结果和平面培养相比较,差异具有统计学意义(P<0.05)。将种植MIN6细胞的肝脏脱细胞支架移植入糖尿病小鼠体内能够较好的发挥降血糖作用。结论:通过将MIN6细胞种植入肝脏脱细胞支架并三维培养,可构建体外胰岛素分泌体系。
Ⅰ型糖尿病;肝脏脱细胞支架;移植;免疫组化染色法;实时定量聚合酶链反应
1 材料和方法
1.1 材料 清洁级C57BL/6J小鼠,12~16周龄,雌雄各半,由南通大学实验动物中心提供[实验动物生产许可证:SCXK(苏)2014-0001]。1%戊巴比妥钠按照40mg/kg剂量对小鼠行腹腔注射麻醉。75%乙醇消毒皮肤,打开腹腔,肝脏外展暴露门静脉,予以钝性分离。采用27G规格针头穿刺门静脉,用丝线固定待用;将预先配置好的1%TritonX-100/0.1%Ammonia洗涤液经门静脉灌注流经整个肝脏,速度为3mL/min,将细胞和细胞碎片洗去。用去离子水冲洗1h,将肝脏脱细胞支架内的细胞碎片彻底冲洗干净;10%胎牛血清和双抗灌注48小时备用。
1.2 方法 (1)肝脏脱细胞支架检测:肝脏脱细胞支架经γ射线照射消毒,行胶原荧光染色,清洗固定,锇酸处理脱水干燥后扫描电镜下观察。为检测支架的组织相容性,将约1cm3脱细胞支架组织与肌肉组织四角缝合后关闭切口。分别于不同时间段将小鼠处死,将移植物连同周围的皮肤和肌肉一同取下,行组织学H&E检查。(2)MIN6细胞/肝脏脱细胞支架三维共培养:MIN6细胞培养于DMEM(高糖)培养基+10%胎牛血清+β巯基乙醇(1L培养基+10μLβ巯基乙醇)+1%双抗,隔天换液,2天传代。脱细胞支架在再种植之前经由γ射线辐照灭菌,MIN6细胞(30×106)消化重悬于1 mL的培养基中。细胞悬液经三步注射入肝脏脱细胞支架中,每次注射0.5mL,每个步骤之间间隔30min。支架静置3h。待细胞贴壁后,经门静脉循环灌注培养基,于synthecon三维培养仪器培养,流速为3mL/min。在上述循环培养系统中培养5天后将支架取出。(3)再种植支架的组织学检测:将种植MIN6细胞的肝脏脱细胞支架置于10%甲醛固定48 h后行石蜡包埋切片苏木精染色,显微镜镜检。用pH6.0、0.01 mol/L CB热诱导修复,室温自然冷却,PBS洗3次×3 min。0.3%H2O2室温下抑制内源性过氧化物酶20 min。PBS洗3次×3 min。20%正常羊血清室温孵育30 min后不洗。滴加一抗兔抗小鼠胰岛素多克隆抗体(1∶100)37℃孵育2 h。PBS洗3次×3 min。EnVision试剂(HRP/R)37℃30 min。PBS洗3次×3 min。DAB显色8~12 min。苏木素染色,热水蓝化。吹干后,树脂封片。(4)实时定量PCR对功能基因的检测:将肝脏脱细胞支架3D培养和平面培养的MIN6细胞,分别由Qiagen 74104 Rneasy Mini Kit提取其中的总RNA。RNA在280和260nm的吸光度由核酸蛋白测定仪测出。得到RNA的浓度和纯度取出逆转录试剂盒Premier 5.0软件设计Insulin1引物:Forward primer:ACTATAAAGCTGGT GG GCATC,Reverse primer:GGGACTTGGGTGTGTAGAAGA;Insulin2引物:Forward primer:CAAGCAGCACCTTTGTGGTT,Reverse Primer:AAGGTCTGAAGGTCACCTGC由上海生工生物工程技术服务有限公司合成。PCR扩增反应条件:94℃预变性5 min,后经过35个循环的94℃变性30s、61℃~62℃(Insulin1 62℃,Insulin2 61℃)、退火30s、72℃延伸30s,最后72℃总延伸10 min。(5)支架体内移植实验及检测:12~16w的C57BL/6J小鼠共36只,雌雄各半,随机分为6组(n=5),第1组为正常未经处理小鼠组,第2组为糖尿病小鼠未移植组,第3组为糖尿病小鼠肝脏包膜下注射MIN6细胞组,第4组为糖尿病小鼠空支架移植腹腔组,第5组为糖尿病小鼠
再种植MIN6细胞支架移植腹腔组,第6组为肝脏脱细胞支架切块后再种植MIN6细胞移植入糖尿病小鼠腹腔组。STZ以160mg/kg的剂量注射到小鼠腹腔造糖尿病模型,造模成功后,按照实验分组移植细胞及支架。移植后前3天每天测量空腹血糖,从第4天开始,每3天测量1次空腹血糖。
1.3 统计学处理 用STATA 7.0软件进行One-Way-ANOVA分析,所有实验数据均以s表示,以P<0.05表示差异具有统计学意义。
2 结 果
2.1 肝脏脱细胞支架制备及检测 如图1(见封二)所示,肝脏脱细胞支架经双蒸水灌洗后由暗红色变成粉红色(图1a及图1b),其内的血细胞完全冲洗干净。经过1%TritonX-100/0.1%ammonium溶液灌注后立体肝脏呈现透明状(图1c),可见清晰的脉管网。
小鼠肝脏及肝脏脱细胞支架的HE染色,其结果显示经1%TritonX-100/0.1%ammonium溶液灌注后,肝脏脱细胞支架内无核染细胞(图2,见封二)。
图3(见封二)所示为小鼠肝脏及肝脏脱细胞支架的扫描电镜,其结果显示肝脏脱细胞支架内胶原结构成分保存完整,未见到明显细胞成分。图3a中箭头所示为肝细胞结构。
图4(见封二)为小鼠肝脏脱细胞前后的胶原荧光显色,其结果显示经洗涤剂灌洗过的脱细胞支架能够保存原有胶原结构及成分。
图5(见封二)显示小鼠肝脏脱细胞支架种植在小鼠背部皮下,于不同时间段分别取出做组织学染色。结果显示在移植3天后,移植区的中性粒细胞数量明显上升,有明显的炎症反应。然而到第7天时,炎症反应有所减轻,中性粒细胞的数量明显下降。第14天,移植区未找到明显的多核巨细胞的存在,无异物排斥反应。且在移植区可见有新生的毛细血管形成(图5c中箭头所示)。
2.2 MIN6细胞与肝脏脱细胞支架三维共培养及检测 如图6(见封二)所示MIN6细胞定植在肝脏脱细胞支架中三维培养及检测结果。图6a为肝脏脱细胞支架种植MIN6细胞前电镜图,图6b为MIN6细胞定植于肝脏支架内电镜图,图6c、d为MIN6细胞和脱细胞支架三维培养后胰岛素免疫组化染色(棕染区域)。
对相同数量的MIN6细胞进行平面培养和三维立体培养5天后,分别对其Ins1和Ins2的表达进行检测,其结果如图7所示。三维培养中Ins表达高于二维平面培养,差异具有统计学意义(P<0.05)。
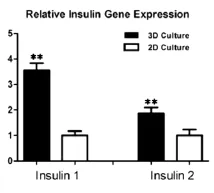
图7 Ins1,Ins2的表达结果
2.3 种植MIN6细胞的支架移植小鼠体内后效果检测 成功造糖尿病模型后进行细胞及支架移植,并检测移植后4周小鼠空腹血糖水平(图8)。第3组实验小鼠术后3天,血糖基本接近正常,但移植后8天开始,血糖缓慢上升。第5组实验小鼠血糖从支架移植入腹腔后第1天开始下降,但未能降至正常水平,从第9天开始,血糖缓慢上升。第6组实验小鼠移植后血糖下降的速度比第3组慢,到第6天血糖接近正常水平,第16天开始血糖开始缓慢上升。但各组血糖水平与第2组相比,差异有统计学意义(P<0.05)。
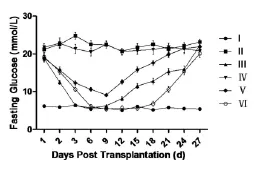
图8 含MIN6细胞支架移植后血糖监测结果
3 讨 论
近年来,随着对人工合成材料研究的进一步深入,越来越多的生物材料用于组织工程及再生医学的研究。与人工合成的材料相比,天然的脱细胞生物支架具有完整的脉管系统及胶原成分,并且能高度模拟细胞在体内的生长坏境,可以更好的保证定植细胞发挥效能。
我们在前期研究中,曾应用各种生物工程胰岛素分泌细胞对糖尿病动物模型进行自体移植治疗,获得了一定效果。移植途径包括肝脏包膜下,腹腔移
植,经动脉导管自体介入移植等[8-12]。但这些移植途径均面临一个问题,即缺乏有效的细胞载体,移植细胞进入体内后难以凝集而发挥更高的效能。本实验采用肝脏脱细胞生物支架为载体,肝脏拥有丰富的脉管系统,是胰岛素分泌发挥作用的第一站。肝脏支架完整的细胞外基质构架在生理、生化和几何空间方面都更适宜细胞和组织的生长[13]。由于蛋白质、多糖及特定的生长因子和细胞因子是基质构架的主要成分,在生理学层面上,有利于细胞定植和成熟分化。同时支架还保留了一套特定的循环脉管结构,可通过其动态供给培养液同时也有助于定植细胞分化为器官特异的表型[14]。
本实验制备肝脏脱细胞支架未见细胞核成分残留,排除了严重的组织相容性问题,避免其诱发机体产生不利于移植物的免疫应答反应。HE染色和扫描电镜检测证实,在有效去除细胞成分的同时,保留原有胰腺的细胞外基质的组成及完整脉络结构。免疫组化染色和实时定量PCR检测,分别从形态学和基因两方面证实再种植MIN6细胞的功能正常发挥。在本实验中,将再种植的肝脏脱细胞支架移植入糖尿病小鼠体内后,小鼠血糖水平得到了一定程度的控制,但后期血糖水平开始缓慢上升。分析其原因可能为定植MIN6细胞的肝脏脱细胞支架移植于小鼠腹腔后,由于腹腔空间较大,支架缺乏局部固定,活动度大。伴随肠管蠕动及小鼠活动,影响支架内细胞的定植生长。后续实验中,我们将对含不同数量级MIN6细胞的肝脏脱细胞支架,及同数量级细胞的支架移植于不同部位后的效能进行研究分析,以得到获取最佳效能的移植方式。本实验以小鼠β细胞系MIN6细胞作为种子细胞,将灌注法制备的全肝脏脱细胞支架作为模拟细胞生长的微环境,来重建胰岛素分泌器官,为体外生物器官支架构建提供进一步的理论依据。
[1]Monnier L,Colette C,Dejager S,et al.Magnitude of the dawn phenomenon and its impact on the overall glucose exposure in type 2 diabetes:is this of concern[J]?Diabetes Care,2013,36(12):4057-4062.
[2]Pepper AR,Gala-Lopez B,Ziff O,et al.Current status of clinical islet transplantation[J].World J Transplant,2013,3(4):48-53.
[3]Smink AM,Faas MM,De Vos P.Toward engineering a novel transplantation site for human pancreatic islets[J].Diabetes,2013,62(5):1357-1364.
[4]Scharp DW,Marchetti P.Encapsulated islets for diabetes therapy:history,current progress,and critical issues requiring solution[J].Adv Drug Deliv Rev,2014,67-68(1):35-73.
[5]Pan MX,Hu PY,Cheng Y,et al.An efficient method for decellularization of the rat liver[J].Journal of the Formosan Medical Association,2014,113(10):680-687.
[6]Badylak SF,Taylor D,Uygun K.Whole-organ tissue engineering:decellularization and recellularization of three-dimensional matrix scaffolds[J].Annu Rev Biomed Eng,2011,13:27-53.
[7]Hynes RO.The extracellular matrix:not just pretty fibrils[J]. Science,2009,326(5957):1216-1219.
[8]Lu Y,Wang Z,Zhu M.Human bone marrow mesenchymal stem cells transfected with human insulin genes can secrete insulin stably[J].Ann Clin Lab Sci,2006,36(2):127-136.
[9]Xu J,Lu Y,Ding F,et al.Reversal of diabetes in mice by intrahepatic injection of bone-derived GFP-murine mesenchymal stem cells infected with the recombinant retrovirus-carrying human insulin gene[J].World J Surg,2007,31(9):1872-1882.
[10]Zhu S,Lu Y,Zhu J,et al.Effects of intrahepatic bone-derived mesenchymal stem cells autotransplantation on the diabetic Beagle dogs[J].J Surg Res,2011,168(2):213-223.
[11]Guo QS,Zhu MY,Wang L,et al.Combined transfection of the three transcriptionalfactors,PDX-1,NeuroD1,and MafA,causes differentiation of bone marrow mesenchymal stem cells into insulin-producing cells[J].Exp Diabetes Res,2012,2012:672013.
[12]Wang L,Zhu M,Guo Q,et al.Comparing the reprogramming efficiency of mouse embryonic fibroblasts,mouse bone marrow mesenchymal stem cells and bone marrow mononuclear cells to iPSCs[J].In Vitro Cell Dev Biol Anim,2012,48(4):236-243.
[13]Orlando G,Farney AC,Iskandar SS,et al.Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations[J].Ann Surg,2012,256(2):363-370.
[14]Ng SL,Narayanan K,Gao SJ,et al.Lineage restricted progenitors for the repopulation of decellularized heart[J]. Biomaterials,2011,32(30):7571-7580.
Three dimensional co-culture of MIN6 cells and liver-derived perfusiondecellularized bioscaffold for potential clinical practice
ZHU Shajun,WANG Lei
(Department of General Surgery,the Affiliated Hospital of Nantong University,Jiangsu226001)
Objective:To observe the growth and function of primary mouse islets in the liver decellularized bioscaffold(LDB).At the same time,a new method of tissue engineering for treatment of diabetes was explored.Methods:The whole mouse liver was perfused by using detergent through hepatic portal vein in a continuous way and the whole liver decellularized bioscaffold was manufactured with the complete structure.The MIN6 cells cultured in the 3D bioscaffold.Then the hematoxylin-eosin(HE)staining,insulin immunohistochemical analysis and fluorescence quantitative polymerase chain reaction(PCR)were performed.qRT-PCR was conducted for the functional gene of INS1 and INS2 to further illuminate its function.The function of the recellularized pancreatic scaffold was monitored in vivo.Results:The liver decellularized bioscaffold,the extracellular cell matrix(ECM)of the LDB maintained their original round shape after decellularization and demonstrated a complete lack of nuclear staining as well as a complete network of blood vessel.Insulin gene expression was displayed,and the expression level of insulin in LDB was greater than that of the plate culture with statistical significance(P<0.05).MIN6 cells grown in the scaffold were better than those cultured on the culture dish.The recellularized pancreatic scaffold can control the blood glucose of the diabetic mice.Conclusion:LDB 3D culture system showed cell viability with effective insulin secretion.
type 1 diabetes;liver decellularized bioscaffold(LDB);transplantation;immunohistochemical analysis; real time polymerase chain reaction
R587.1
A
国家自然科学基金资助项目(81471801)。
2015-03-29
1006-2440(2015)04-0319-04
**[作者简介]朱沙俊,男,汉族,江苏泰兴人,生于1979年9月,博士在读,主治医师,讲师。研究方向:肝胆胰外科。
糖尿病已经成为对人类身体健康和生活质量危害仅次于癌症的疾病。糖尿病可分为Ⅰ型和Ⅱ型,Ⅰ型糖尿病是由于自身免疫破坏致β细胞数量减少所致。目前,胰岛素的使用使得糖尿病治疗有了很大进步,但很难完全消除由糖尿病引发的肾功能损害、神经性损害、心血管及视网膜疾病等并发症[1-2]。胰腺移
植和胰岛移植给糖尿病的治愈带来了曙光,尤其是Edmonton方案的提出使得50%的接受胰岛移植患者可不需依赖外源性胰岛素有效调节血糖达3~5年,然而供体细胞来源的不足和移植物免疫排斥问题阻碍了其进一步的推广[3]。近年来,通过再生医学及生物工程,体外构建适合种子细胞生长的生物容器进而是目前研究的一大热点[4]。肝脏的脱细胞支架具备完整且清晰的循环管路支撑结构,其完整的细胞外基质构架在生理、生化和几何空间方面都更适宜细胞和组织的生长[5]。脱细胞支架中包含的蛋白质、多糖及特定的生长因子和细胞因子是基质构架的主要成分,均有助于细胞的定植和成熟分化[6]。脱细胞支架还能最大程度的保留原器官中的脉管结构,通过动态灌注培养液有利于定植细胞分化为器官特异的表型并发挥效能。因此与其他人工支架相比,生物器官脱细胞支架包含了细胞生长和功能发挥所不可或缺的生物信息环境,是体外构建生物器官容器的理想基站[7]。本实验通过制备全肝脏脱细胞支架,将MIN6细胞种植入肝脏脱细胞支架并三维培养,检测其功能发挥并与二维平面培养MIN6细胞作对比。最后将其移植入糖尿病小鼠体内并检测其治疗作用,为细胞移植治疗Ⅰ型糖尿病提供理论依据。

