骨髓源性血管内皮祖细胞体外分离、培养及分化为内皮细胞的研究
胡 洋,郝兰坡,赵炳飞,赵梦华
(河北省邯郸市中心医院,河北 邯郸 056001)
骨髓源性血管内皮祖细胞体外分离、培养及分化为内皮细胞的研究
胡 洋,郝兰坡,赵炳飞,赵梦华
(河北省邯郸市中心医院,河北 邯郸 056001)

目的 探讨骨髓源性血管内皮祖细胞(EPCs)在体外分离、培养、诱导分化及鉴定的方法。方法 抽取SD大鼠的骨髓细胞,离心法提取骨髓液中单个核细胞,用含有血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、表皮细胞生长因子(EGF)的培养液诱导培养EPCs,观察并记录EPCs的生长分化过程;对培养后的细胞进行免疫荧光染色,鉴定细胞表面标志物,同时,RT-PCR法检测EPCs特异性分子标志物。结果 培养 24 h后细胞开始贴壁,4 d后细胞呈集落样生长,细胞从集落中央向外周生长,至培养的第7天成片生长的细胞集落相互连接,10 d 后细胞形态明显改变,呈现典型的“鹅卵石样”外观。贴壁细胞免疫荧光检测显示CD34、CD133、VEGFR-2、FGFR1均阳性,经RT-PCR法检测,EPCs表达的特异性分子标志物均为阳性。结论 以梯度离心法获得骨髓单个核细胞经培养后,可扩增出具有典型特征的EPCs,呈贴壁增殖状态且具有分化能力,经体外诱导可分化为成熟的血管内皮细胞。
骨髓;内皮祖细胞;细胞分离;诱导;血管内皮细胞
血管内皮祖细胞(endothelial progenitor cells, EPCs)是具有增殖、扩增并分化为成熟血管内皮细胞的一类多潜能细胞。近年来,EPCs在血管内皮功能受损和缺血梗阻性疾病中的治疗作用受到越来越多专家学者的重视,其相关的基础研究亦受到广泛关注。目前EPCs主要从骨髓、脐带血及外周血中获取[1-3]。外周血来源的EPCs损伤相对小、取材相对容易而被普遍使用,但此方法所获取到的EPCs纯度较低。骨髓中含有大量的祖细胞,与外周血和脐带血相比,骨髓液所含的血管EPCs更加丰富,故本实验拟从大鼠的骨髓液中分离、提取、培养EPCs,以期探索出一种能达到稳定生成及扩增的EPCs分离培养方法,并通过细胞因子对EPCs进行诱导分化,使之分化为成熟的内皮细胞,为将来治疗临床血管损伤性疾病或缺血性疾病提供细胞来源和理论基础。
1 实验资料
1.1 实验动物 成年SD大鼠,体质量,由河北医科大学动物实验基地提供,动物合格证号:SCXK-2013-0005。
1.2 主要试剂和仪器 LD5-10B水平离心机(美国Sigma公司),IX71-F22DIC倒置相差显微镜(日本Olympus公司),荧光显微镜(德国Leica公司),细胞培养板(美国Corning公司),CO2培养箱(德国binder公司),CM-3600D分光光度仪(日本美能达),电热恒温鼓风干燥箱(上海实贝仪器设备有限公司),DL-CJ-2N超净工作台(北京东联哈尔仪器制造有限公司),高速离心机(日本日立公司),血细胞计数板(德国Brand),全自动电热压力蒸汽灭菌器(tommy 公司),超纯水净化系统(美国Pall公司),PCR仪(美国Sigma公司),凝胶成像系统(美国Sigma公司),电泳仪(日本Olympus公司)。
1.3 试剂配制 ①PBS:分别称取8.0 g NaCl,2.9 g Na2HPO4·12H2O,0.2 g KCl和0.2 g KH2PO4,加1 000 mL超纯三蒸水,121℃高压蒸汽灭菌后,常温保存备用。②0.25%胰蛋白酶+0.02%EDTA2Na :称取0.25 g胰蛋白酶,100 mL PBS溶解0.02 g EDTA2Na,吹打将其完全溶解,0.22 μm微孔滤器过滤除菌,4 ℃保存备用。③葡萄糖-泛影葡胺(Percoll)工作液配置:Percoll原液经高压蒸汽灭菌后,按9份Percoll原液与1份10倍浓缩的PBS的比例加入浓缩的PBS混匀制成储存液,按照60%的储存液与40%的正常的无钙镁PBS混匀后配成终浓度为1.077 g/mL的工作液4 ℃避光保存。④4%多聚甲醛:称取4 g多聚甲醛,加入100 mL 超纯水中,60 ℃水浴过夜溶解,4 ℃保存备用。⑤L-谷氨酰胺:将2.923 g谷氨酰胺溶解于100 mL PBS中,0.22 μm微孔滤器过滤除菌并分装,-20 ℃保存备用。⑥多聚赖氨酸溶液配制:多聚赖氨酸5 mg溶于50 mL硼酸缓冲液中,配成浓度为100 μg/mL的多聚赖氨酸溶液。⑦4%牛血清白蛋白(BSA):称取4 g BSA加入100 mL PBS中,混匀备用。⑧0.1%明胶配制:称取0.1 g明胶,加入100 mL PBS中,高压蒸汽灭菌后,4 ℃保存备用。⑨细胞培养皿/板的预处理:将配制好的0.1%的明胶在无菌条件下平铺于培养皿或培养板的表面,放入培养箱平衡4~6 h,用吸头吸出液体后,即可接入细胞。⑩细胞爬片的预处理:将盖玻片放置于无菌盒子中,经过高压蒸汽灭菌器,灭菌处理放入烘干箱烘烤干燥并冷却后置于超净工作台中用多聚赖氨酸进行包被载玻片,轻轻移入培养板内放置于培养箱内过夜包被后,次日吸取多聚赖氨酸后即可接种细胞。表皮细胞生长因子(EGF)、胰岛素样生长因子-1(IGF-1)、碱性成纤维细胞生长因子(bFGF)、血管内皮细胞生长因子(VEGF)的分装:取50 μg细胞因子粉末,加入50 mL基础培养基中充分溶解过滤、标注后分装,-20 ℃密封冻存。DMEM /F12+2 mmol/L谷氨酰胺+10 ng/mL bFGF+10 ng/mL IGF-1+10 ng/mL EGF+10% FBS。EPC细胞向内皮细胞分化诱导液:DMEM/F12+2 mmol/L-谷氨酰胺+10 ng/mL bFGF+10 ng/mL IGF-1+50 ng/mL EGF+10% FBS。0.1%台盼蓝溶液:称取0.1 g台盼蓝粉末,加入100 mL PBS中,充分搅拌溶解后备用。
1.4 EPCs的分离 成年SD大鼠脱颈处死,用新洁尔灭溶液消毒后取大腿骨在无菌操作台内剥离肌肉及结缔组织,取胫骨,切除干骺端,暴露骨髓腔。使用注射器抽吸骨髓于无血清培养基,用针头轻轻吹打成细胞悬液,800 g离心15 min。弃去上层杂质,将下层细胞用无血清培养基清洗2~3次,重悬细胞。取10 mL离心管,缓慢注入1.077 g/mL的Percoll分离液3 mL,再缓慢注入已制备好的骨髓单细胞悬液3 mL。放入离心机,待离心结束后收集白膜层的单个核细胞,用无血清培养基洗涤2次。细胞计数后以 2×107/cm2密度加入铺有0.1%明胶的6孔板, 37 ℃、5% CO2饱和湿度下培养,每3 d换液1次。
1.5 EPCs生长曲线的绘制 取生长良好的第2、第5、第8代细胞,分别接种于 24 孔板,每天取 3 孔消化后计数(每孔计数 3 次,计算均值),以培养时间作为横轴,细胞计数作为纵轴,描绘细胞生长曲线。
1.6 间接免疫荧光法检测EPCs表面抗原 将细胞制成悬液接种于前述处理好的载玻片上,无菌培养后,用 4%多聚甲醛滴加在载玻片上固定细胞15 min。参照各抗体说明进行CD34、CD133、VEDFR-2免疫荧光检测;0.025% TritonX-100室温下通透处理细胞膜15 min,PBS漂洗2~3次,每次3~5 min。用PBS稀释后的一抗(CD34、CD133、VEDFR-2)滴加到细胞爬片上,将细胞爬片置于冰箱内,4 ℃孵育过夜;用PBS漂洗细胞爬片2~3次,每次3~5 min,以洗去与细胞非特异性结合的抗体;将FITC标记的二抗用PBS稀释后滴加到细胞爬片上,37 ℃条件下避光孵育1 h; PBS漂洗2~3次,每次3~5 min;将hoechst 33258稀释后滴加到细胞爬片上,复染细胞核15 min; PBS漂洗2~3次,置于荧光显微镜下观察并拍照。
1.7 EPCs表面标志物的RT-PCR检测 ①当细胞生长至70%~80% 时,吸除培养基后用预冷的PBS洗涤细胞2~3次。②Trizol法提取细胞总RNA:吹打细胞悬液后转移至1.5 mL离心管中,室温下静置,充分裂解细胞。向离心管中加入0.2 mL氯仿,颠倒震荡15 s,室温静置3 min。把离心管置于高速离心机中,4 ℃,12 000 r/min,离心12 min。离心后将含有RNA的水相层转移至另一个离心管中,加入0.5 mL异丙醇沉淀RNA,混匀后于室温下静置10 min。再次低温高速离心10 min,去上清,以75% 乙醇洗涤沉淀2次。再次离心后弃去上清,室温下晾干,紫外分光光度计测定260 nm和280 nm下的OD值。③cDNA的合成:提取的总RNA用TaKaRa RNA PCR Kit(AMV)Ver. 3.0 反转录合成并扩增cDNA。④按以下条件进行反转录:30 ℃,10 min;42 ℃,30 min;99 ℃,5 min;5 ℃,5 min共1个循环。⑤特异性引物设计:在Genbank查询基因信息,Primer Premier 5.0软件进行特异性引物的设计。⑥PCR检测:将5 μL PCR产物与1 μL上样缓冲液混匀后进行2% 琼脂糖凝胶电泳。用凝胶成像系统检测目的基因的表达情况并拍照。
1.8 EPCs向内皮细胞诱导分化及检测 将生长良好的细胞接种到24孔板中,弃去培养基,用 PBS 洗细胞3次,加入内皮细胞诱导液,每隔2 d换液1次,诱导至10 d,对细胞进行CD144、CD31免疫荧光检测,方法同上。设置对照组:加常规EPCs培养液,每隔2~3 d换液1次。
2 结 果
2.1 细胞形态学 分离出的骨髓单个核细胞呈圆形,大小不等,培养24~48 h后部分细胞贴壁、增大,形状变为梭形,见图1。培养8 d,有大量梭形贴壁细胞并连接成条索样,细胞集落出现;7~10 d出现多个细胞团,边缘细胞出芽长出,呈单层生长,此结构类似于血岛,亦可见细胞线状排列。培养至14 d时,细胞融合,呈大片的条索状结构,见图2。
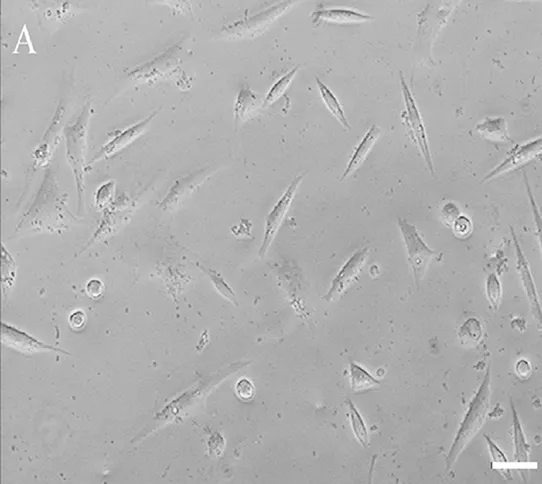
图1 新分离的EPCs 形态学表现
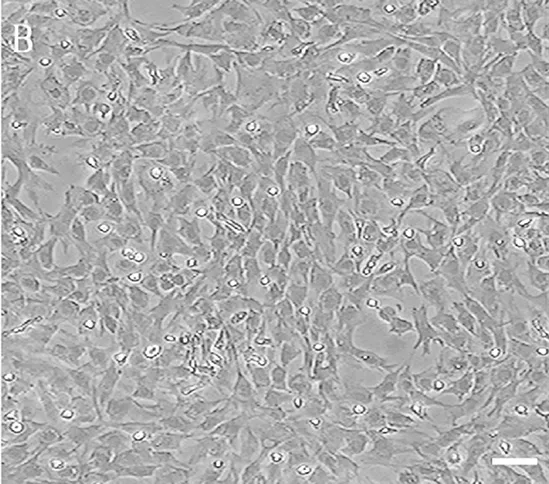
图2 培养14 d EPCs形态学表现
2.2 EPCs生长曲线 第2、第5、第8代EPCs的生长增殖情况类似,保持了良好的生长趋势。见图3。
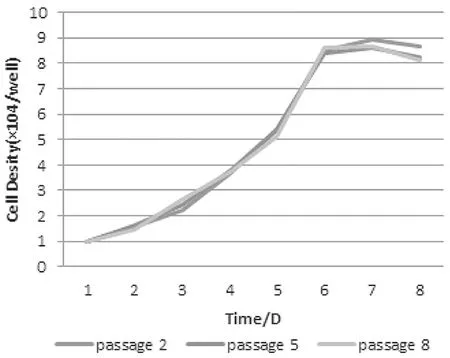
图3 第2、第5、第8代EPCs生长曲线
2.3 EPCs免疫荧光检测结果 EPCs表面标志物CD34、CD133、VEGFR-2、FGFR1均呈阳性,阳性率分别为(56.23±0.18)%、(87.23±1.66)%、(90.64±0.87)%、(89.78±0.99)%,免疫荧光表现见图4~7。
2.4 RT-PCR鉴定结果 分离培养的EPCs CD34、CD133、VEGFR2、FGFR1能用RT-PCR方法检测到条带,进一步说明分离的细胞为EPCs。见图8。
2.5 诱导分化鉴定 EPCs在内皮诱导液诱导10 d后,细胞形态明显改变,由原来的梭形逐渐缩短、变圆,最后变为明显的“鹅卵石样”结构。免疫荧光检测后CD144、CD31阳性。
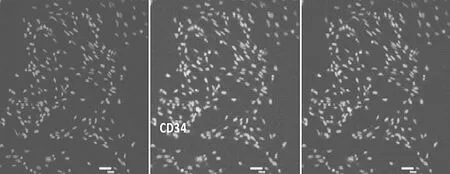
图4 CD34表达情况
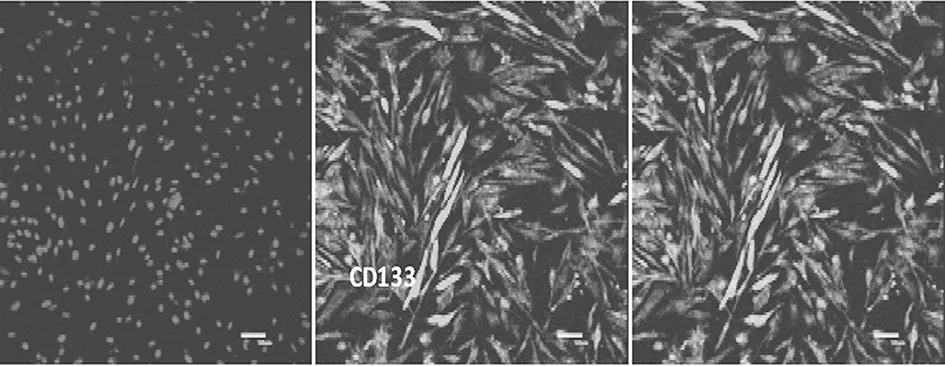
图5 CD133表达情况
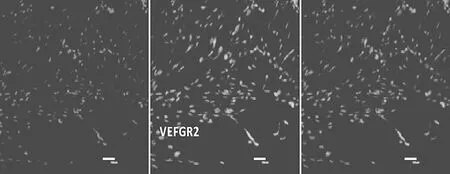
图6 VEGFR-2表达情况
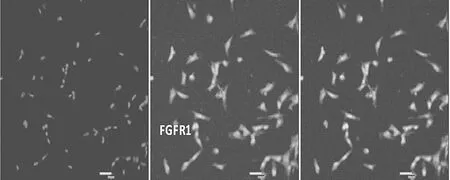
图7 FGFR1表达情况
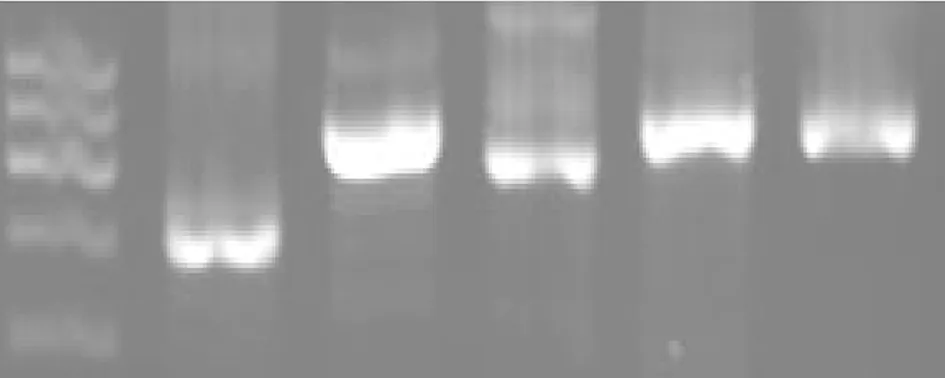
图8 CD34、CD133、VEGFR-2和FGFR-1阳性表达情况
3 讨 论
3.1 EPCs的来源 目前,国内专家和学者一致认为,EPCs主要存在于脐带血、胎肝、胎脾、外周血及骨髓当中,其中骨髓是最主要的来源[3-4]。以往国内体外培养EPCs主要来源于外周血,因为外周血来源的EPCs损伤相对小、取材相对容易而被广泛使用,但此方法所获取到的EPCs纯度较低;而脐带血取材往往需征得产妇及家属的知情同意,手续相对繁琐,且涉及伦理问题。目前,作为EPCs最主要来源的骨髓组织,因含有极其丰富的干细胞和祖细胞,在取材上较外周血和脐带血更具有优势[1]。骨髓细胞比较容易获取并通过成熟的培养技术进行体外扩增,且干细胞或祖细胞属于自体来源,用于移植治疗后无免疫排斥反应。因此,本实验采用骨髓细胞作为EPCs的来源。
3.2 EPCs的分离、培养 目前,体外培养EPCs的方法主要有流式细胞仪、免疫磁珠法和密度离心法[5]。流式细胞仪是干细胞分离和鉴定的重要方法,它可以精确分析样本中细胞的表型和数量,通过分选方法以极高的纯度将目标细胞群分离出来;但缺点是分选的速度相对较慢,细胞数量小,花费比较昂贵。免疫磁珠分选法是仅次于流式细胞仪的分离高纯度细胞的另一种实验方法,能够分选出足够数量的目标细胞,但只能针对一种细胞表型,对表达多种细胞表型的细胞群不适用。通常采用CD34单抗CD133单抗的免疫磁珠来吸附和分选,纯度较高,但实验花费也较高,为动物实验和临床实验增加了很大经费支出[6]。已有研究证实,利用免疫磁珠分选法分离获得的CD34+和CD133+细胞很少,且单独培养不易增殖,只有同CD34-或成熟内皮细胞一起培养才有增殖活性[5]。
密度离心法分离细胞是目前最常用的实验方法。采用此方法可从骨髓血中直接获取单个核细胞,之后用细胞贴壁筛选法来分离EPCs,培养扩增则在培养基中添加了VEGF、 EGF、bFGF等促内皮细胞生长因子。密度梯度离心法具有操作简单的优点,但往往分离不纯。CD133+KDR+双荧光细胞分选法可得到较高纯度的EPCs,但分选技术难度较大,费用高昂。在本研究中,笔者将分离的EPCs以 (1~4)×107/cm2的密度接种在纤维连接素包被的培养板上,用含胎牛血清的细胞培养基,同时加入FGF2、VEF、EGF和IGF进行培养,3 d后PBS液洗去非贴壁细胞,之后继续培养7~10 d,贴壁的梭形细胞可用少量胰蛋白酶消化收集。此方法较好地兼顾了细胞分离纯度和经济支出两方面问题。
在密度离心法分离培养细胞过程中,常规同时应用多种细胞生长因子促进细胞的生长分化。 EPCs 具有很严格的培养液要求,必须采用特殊配方培养液。最常用的EPCs培养液是EGM-2,少数情况下可用RPMI1640、IMDM、长周期培养液、Medium199和条件培养液。无论选用哪种培养液,在刺激因子的作用下都能诱导分化出典型的内皮细胞。培养过程中除需要bFGF、VEGF等多种刺激因子存在外,还需要许多未知因子的参与。当黏附的细胞数较少时,可在培养液中加入单核细胞,这有促进黏附细胞生长的作用,其原理是细胞之间通过接触传递了某种信号或分泌了某些末知因子。在培养液中添加牛脑提取物、胎牛血清进行细胞培养就是考虑到一些末知生长因子存在的可能[7]。
3.3 EPCs的增殖 正常情况下,EPCs的获取量较少,外周血每毫升中仅含有2~3个,脐带血含量比外周血高3.5倍[2]。成熟的内皮细胞可在培养基中迅速进入增殖期,但4~6周后增殖活力却逐步下降,而骨髓来源的EPCs在培养15~20 d后可迅速形成内皮细胞层,呈“鹅卵石”样形态,并能稳定的传代30次以上,增殖潜能10倍于脐静脉的内皮细胞。从骨髓中分离的单个核细胞,在VEGF的作用下可扩增约1 000倍,并能表达内皮细胞所具有的特异性抗原[7]。
3.4 EPCs的诱导分化 EPCs以前一直被认为是单能干细胞,只能分化为成熟的内皮细胞,不过这种观点现在正发生着变化。随着培养环境及培养液的改变,EPCs有向其他细胞分化的潜能。EPCs需借助细胞培养体系中细胞因子的作用才能分化。促使EPCs向内皮细胞分化的因子很多,vEGF是其中作用最强一种。EPCs首先通过细胞膜上的VEGFR-2受体和激动蛋白激酶B,再通过IP3通路激活各种细胞内信号,从而启动细胞的生长分化[6]。另外,促使EPCs向成熟内皮细胞分化的不可或缺的因子有EGF、bFGF及IGF等。
培养基中细胞因子组成成分的差异会影响骨髓中单个核细胞的生长和分化。在本研究中,应用细胞因子VEGF和bFGF作为EPCs的诱导分化剂,成功将其诱导为血管内皮细胞。VEGF是一种高选择度的促内皮细胞分裂素,可以促进内皮细胞增生;在体外培养中,VEGF浓度和EPCs的生长率呈正相关,而bFGF和VEGF之间存在协同作用关系,可促进内皮细胞的增殖和移行,进而增生出毛细血管样的组织结构,促进新生血管的产生[7-8]。单个核细胞在两者的联合作用下可向内皮细胞生长和分化,从而说明这是一种可行的促进EPCs增殖并分化的实验方法。
3.5 EPCs的鉴定 EPCs的表面标志物是指细胞表面独有的特异性生物大分子,主要是蛋白质,借此可以区分不同种类的细胞。CD133是EPCs的表面标志物,它在向内皮细胞转化过程中逐渐丢失,此种鉴定方法的优点是能够区分出前体细胞;但CD133亦可选择性的表达于早期造血干细胞、骨髓及外周血的祖细胞,所以不能单纯通过它来鉴定EPCs和造血细胞。CD34抗原作为一种糖蛋白可表达于细胞表面,随着幼稚细胞的分化逐渐成熟,其表达水平却趋于下降,是EPCs的重要标志物[6-7]。本实验对所获得的培养10 d的EPCs 进行表面标志物检测发现,CD34、CD133、VEGFR-2、FGFR1均呈阳性,RT-PCR鉴定亦获得了基本相同的结果,说明本研究分离、培养所形成的细胞为EPCs。
[1] 吴波,卢正茂,王尧,等.兔骨髓源性血管内皮祖细胞的分离、培养及鉴定[J]. 中国实验血液学杂志,2010,18(2):454-457
[2] 黄勇,王深明,王劲松,等. 人脐血CD133+血管内皮祖细胞的培养、鉴定与分化研究[J]. 中华外科杂志,2007,45(9):619-622
[3] 杜利,刘亢丁. 内皮祖细胞生物学特征及其临床应用[J]. 中国组织工程研究与临床康复,2011,15(40):7581-7584
[4] 郑胜武,昝涛,丁力,等. 大鼠骨髓来源的血管内皮祖细胞的体外培养和鉴定[J]. 组织工程与重建外科杂志,2010,6(5):244-247
[5] Sakamoto M,Nakamura T,Torimura T,et al. Transplantation of endothelial progenitor cells ameliorates vascular dysfunction and portal hypertension in carbon tetrachloride-induced rat liver cirrhotic model[J]. J Gastroenterol Hepatol,2013,28(1):168-178[6]XiaoN,QiXY,TangLN,etal.VEGFpromotescardiacstemcellsdifferentiationintovascularendothelialcellsviathePI3K/Aktsignalingpathway[J].ArtifCellsNanomedBiotechnol,2014,42(6):400-405
[7]DiBernardiniE,CampagnoloP,MargaritiA,etal.EndotheliallineagedifferentiationfrominducedpluripotentstemcellsisregulatedbymicroRNA-21andtransforminggrowthfactorβ2(TGF-β2)pathways[J].JBiolChem,2014,289(6):3383-3393
[8] 陈图刚,谭维羚,马战清,等. 内皮祖细胞移植对犬心肌梗死后血管新生、心肌修复及心功能的影响[J]. 实用中西医结合临床,2011,11(3):1-3
Study on the separation and culture in vitro of bone marrow derived endothelial progenitor cells and its differentiation into endothelial progenitor
HU Yang, HAO Lanpo, ZHAO Bingfei, ZHAO Menghua
(Handan Central Hospital, Handan 056001, Hebei, China)
Objective It is to explore the method for the the separation and culture in vitro and identification of bone marrow derived endothelial progenitor cells (EPCs). Methods The bone marrow cell of SD rats were selected and the mononuclear cells were extracted by centrifugation method, the cells were cultured by culture solution which containing VEGF, bFGF, EGF to induce EPCs, the growth and differentiation process were observed. The cultured cells were stained by immunofluorescence staining to identify the surface markers, and the specific molecular markers were identified by RT-PCR method. Results After culture for 24 h, the cell attachment was found; in 4 days later, the cells showed colony growth, and growth was from the center to the peripheral region; in 7 days later, the colony growth were more obvious like flakiness and connected with each other; in 10 days later, the changes of cell morphology structure was obvious, which showed a typical appearance like cobblestone. Immunofluorescence detection showed that CD34, CD133, VEGFR-2, FGFR1 were all positive, RT-PCR method showed that specific molecular markers of EPCs were positive. Conclusion Spinal cord mononuclear cells gotten by gradient centrifugation can be cultured to amplify EPCs with typical characteristic which show adherence proliferation status with differentiation ability to became grown-up blood endothelial cells by induction in intro.
bone marrow; endothelial progenitor cells; separation; induction; blood endothelial cells
胡洋,男,主治医师,主要从事心血管基础疾病的相关研究。
10.3969/j.issn.1008-8849.2015.22.008
R-33
A
1008-8849(2015)22-2421-05
2015-01-12

