红景天苷预处理对大鼠压疮模型炎症反应的影响
邹毅清,郑海燕,黄凤金,林 金
(1. 南京军区福州总院四七六医院,福建 福州 350002;2. 福建医科大学福总临床医学院,福建 福州 350025)
红景天苷预处理对大鼠压疮模型炎症反应的影响
邹毅清1,2,郑海燕1,黄凤金1,林 金1
(1. 南京军区福州总院四七六医院,福建 福州 350002;2. 福建医科大学福总临床医学院,福建 福州 350025)

目的 探讨红景天苷预处理对大鼠压疮模型组织损害程度和炎症反应的影响。方法 30只SD雄性大鼠随机分为对照组、模型组及红景天苷预处理组。红景天苷预处理组每日腹腔注射红景天苷12mg/(kg·d),连续1周,最后一次给药后30min建立压疮模型。再灌注后2h取全血2mL离心留血清,-20 ℃保存待测血清肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)水平以及髓过氧化物酶(MPO)和超氧化物歧化酶(SOD)的活力。结果 模型组和红景天苷预处理组皮肤组织发生损伤,且模型组损伤程度重于红景天苷预处理组。红景天苷预处理组和模型组血清TNF-α和IL-6水平及MPO和SOD的活性与对照组比较差异有统计学意义(P均<0.05);红景天苷预处理组与模型组比较,血清TNF-α和IL-6水平及MPO活性更低(P均<0.05),SOD的活性更高(P<0.05)。结论 红景天苷预处理可减轻大鼠压疮组织损害,其机制可能与抑制压疮引起的炎症反应有关。
红景天苷;大鼠;压疮;缺血再灌注损伤;炎症反应
压疮是卧床患者最严重的皮肤并发症之一,给患者及其家属带来极大的痛苦。如何预防及处理压疮一直困扰着医务人员,目前相关研究认为,氧化应激反应催生大量炎症递质和细胞因子过度释放,导致炎症级联反应是压疮发生的重要机制[1]。因此,抑制炎症因子与氧自由基的释放已成为防治压疮的重要策略之一。红景天是多年生草本植物,生长在海拔1 800~2 500 m高寒地带,具有很强的生命力和特殊的适应性,其具有显著的抗疲劳、抗辐射、抗衰老、抗缺氧、免疫调节、清除自由基等多种药理作用,但是其对减轻大鼠压疮模型缺血再灌注后炎症反应是否有效尚未见报道。本研究观察了红景天苷预处理对大鼠压疮模型组织损害程度和炎症反应的影响,现将结果报道如下。
1 实验资料
1.1材料
1.1.1 实验动物 SD雄性大鼠,体质量230~280 g,由福建医科大学实验动物中心提供,许可证号:SYXK(闽)2012-0002。适应性饲养1周,室温为20~22 ℃,湿度为40%~60%。实验前禁食12 h,不禁饮。
1.1.2 实验试剂 红景天苷,纯度为95%,成都明波生物技术有限公司提供;血清肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)试剂盒购自Sigma公司,血清髓过氧化物酶(MPO)和超氧化物歧化酶(SOD)试剂盒购自南京建成生物医学工程研究所。
1.2 实验方法
1.2.1 模型制备方法 动物模型制备参考文献[2]:使用10%水合氯醛(300 mg/kg)腹腔注射麻醉后,将大鼠仰卧于设计好的简易加压装置上,用胶布将大鼠的四肢固定在底盘上,再固定1个倒立的铁钉于装置上,钉尖连接1块木板,木板上可放置一定质量的物体,钉底放置于大鼠大腿近膝关节骨隆突处,钉身用2个半圆形扣子固定在直立的木板上,使铁钉垂直作用于皮肤。根据钉底面积计算木板上物体质量,使得皮肤组织受到70 mmHg(1 mmHg=0.133 kPa)的压强。
1.2.2 实验分组及给药 按随机数字表法将30只大鼠随机分为3组,每组10只。对照组:麻醉后仰卧于该装置,但未受任何压力。模型组:麻醉后仰卧于该装置,压迫2 h后再放松2 h。红景天苷预处理组:造模前每日腹腔注射红景天苷12 mg/(kg·d),连续1周,最后一次给药后30 min建立压疮模型。对照组和模型组给予等容积的生理盐水腹腔注射1周。
1.2.3 组织病理学观察 参考姜丽萍等[3]方法依压疮病理变化严重程度将组织损伤分为3度,轻度:鳞状上皮细胞变薄,表皮与真皮连接疏松,真皮轻度胶原变性,毛细血管扩张,少量淋巴细胞浸润;中度:鳞状上皮部分核固缩,表皮与真皮部分分离,真皮胶原纤维变性,炎细胞浸润明显,脂肪细胞游离,毛细血管扩张充血;重度:鳞状上皮脱屑,表皮与真皮分离,真皮胶原纤维溶解,细胞核碎裂,脂肪细胞溶解,毛细血管淤血。
1.2.4 血清TNF-α、IL-6及MPO和SOD的测定 各组大鼠于再灌注2 h后深麻醉下处死,用不加抗凝剂的2支试管分别心脏取血2 mL,一支试管于室温下血液自然凝固15~20 min后,离心5 min,取血清置-20 ℃冰箱保存。采用放射免疫法测定待测血TNF-α含量,采用ELISA法测定血清IL-6含量,按试剂盒说明书进行操作。另一支试管在4 ℃下离心10 min,取血清,严格按试剂盒要求监测MPO和SOD活性。
2 结 果
2.13组组织损伤程度比较 苏木精-伊红染色显示,模型组和红景天苷预处理组皮肤组织发生损伤;与红景天苷预处理组比较,模型组损伤更为严重,见表1。对照组大鼠皮肤组织结构未发生明显变化,上皮组织为复层鳞状上皮,结构清楚,炎症细胞浸润不明显,见图1;红景天苷预处理组上皮组织仍为复层鳞状上皮,相对于对照组变薄,上皮结构略不清楚,真皮内可见炎症细胞浸润,但病理改变明显较模型组轻,见图2;模型组复层鳞状上皮较对照组和红景天苷预处理组均薄,结构不清,细胞层次减少,部分上皮结构出现断裂,真皮内见到较多炎症细胞浸润,见图3。
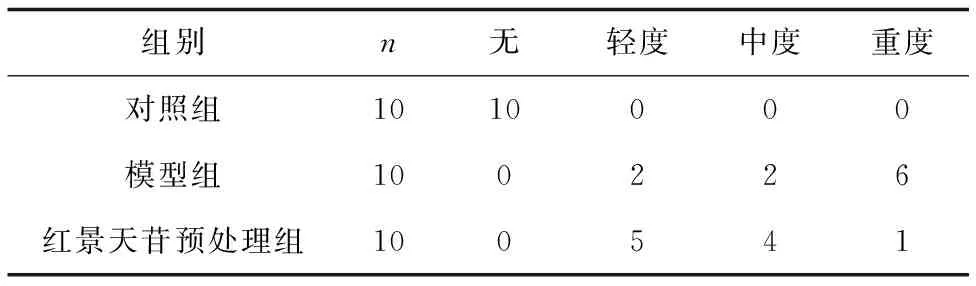
表1 3组皮肤软组织病理改变 只
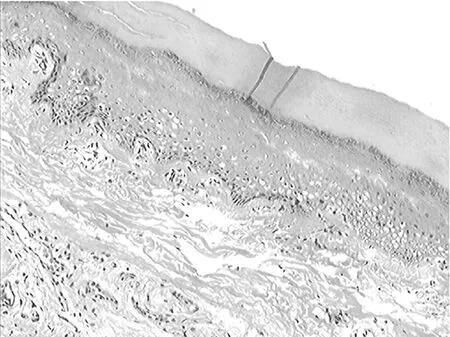
图1 对照组光镜下皮肤组织病理表现(×100)
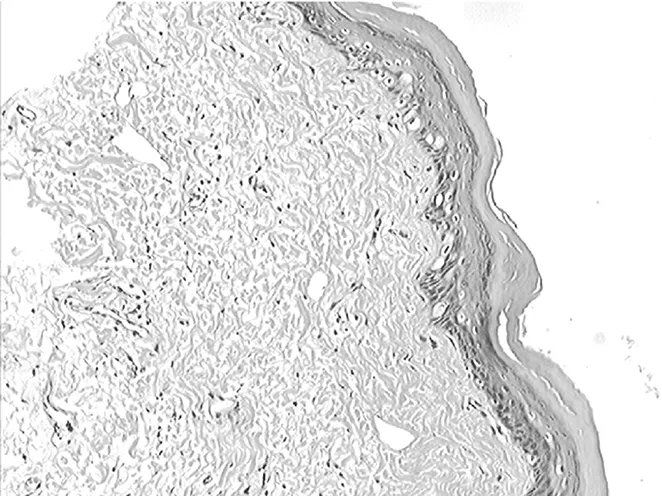
图2 红景天苷预处理组光镜下皮肤组织病理表现(×100)
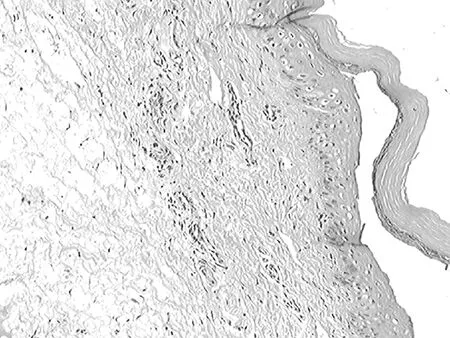
图3 模型组光镜下皮肤组织病理表现(×100)
2.2 3组血清TNF-α和IL-6水平比较 模型组与红景天苷预处理组血清TNF-α和IL-6水平均明显高于对照组(P均<0.05),且模型组高于红景天苷预处理组(P<0.05)。见表2。
2.3 3组血清MPO和SOD活性比较 模型组与红景天苷预处理组血清MPO活性均高于对照组(P均<0.05),且模型组高于红景天苷预处理组(P<0.05)。模型组与红景天苷预处理组血清SOD活性均低于对照组(P均<0.05),且模型组低于红景天苷预处理组(P<0.05)。见表3。

表2 3组血清TNF-α和IL-6水平比较
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05。
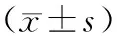
表3 3组血清MPO和SOD活性比较
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05。
3 讨 论
压疮是长期卧床患者最常见的并发症,是临床护理工作中的一大重点和难点,可延缓疾病的恢复,延长住院时间,严重者甚至死亡。随着人口老龄化,全球范围内压疮的发生率不断上升,因此压疮的预防和治疗备受国内外医护人员的关注。
压疮的形成是多因素共同作用的结果,但是缺血再灌注损伤(I/R)被认为是最重要的致病机制之一,通过诱发全身性炎症反应,增加氧自由基生成,加强组织脂质过氧化过程,从而加重组织损伤[4]。其中由多形核中性粒细胞(PMN)介导的炎症反应在I/R发生过程中有重要意义。研究证实,巨噬细胞被激活产生炎性递质,并释放TNF-α等促炎细胞因子,TNF-α可进一步激活PMN和内皮细胞等效应细胞,导致内皮细胞功能失调,增加内皮细胞的渗透性[5]。Bonnefoy等[6]研究表明,营养不良合并高代谢的老年严重压疮患者血清和压疮局部组织中IL-6增高,加剧了营养不良和高代谢。Davies等[7]研究也表明,脊髓损伤患者中合并压疮者血浆中IL-6水平显著升高,IL-6作为强炎症递质可进一步加重I/R的全身反应和局部损伤。MPO是一种由活化的多形核白细胞、单核细胞、巨噬细胞分泌的白细胞酶,是糖基化的四聚体血红素蛋白[8]。在特定条件下,MPO催化的反应所产生的氧化剂生成过量,超过局部抗氧化剂的防御反应时,就会导致氧化应激和氧化性组织损伤。王艳艳等[9]研究发现,早期压疮组织中MPO含量增加,且与压疮严重程度呈正相关。SOD能够清除氧自由基,保护细胞免受损伤,SOD的活性高低直接反映了机体清除自由基的能力[10]。
红景天苷是红景天属植物中广泛存在的一种天然酚类次生代谢产物,近年发现其具有调节免疫系统和内分泌系统、保护心脑血管、抗肝纤维化、抗肾损害、防辐射、抗肿瘤、抗炎等多种药理作用[11-12],可调节早期细胞因子的产生,通过阻断核转录因子-κB(NF-κB)和细胞外信号调节激酶/丝裂原活化蛋白激酶的活化作用,从而减少TNF-α、IL-6和IL-1β的分泌,显著增加内毒素血症小鼠的存活率[13]。笔者前期研究也证实[14],红景天苷预处理可降低大鼠全脑缺血再灌注后血清TNF-α、IL-6水平及海马区MPO和NF-κB的活力,表明红景天苷可缓解大鼠全脑缺血再灌注后全身和海马区的炎症反应。
本实验结果表明,70 mmHg的压强作用于皮肤2 h后放松2 h,可导致皮肤组织损伤,红景天苷可显著缓解压疮模型的组织改变。压疮模型可导致大鼠血TNF-α、IL-6水平增高, MPO活性增高,SOD活性降低。红景天苷预处理可显著降低压疮大鼠血TNF-α、IL-6水平及MPO活性,提高SOD活性。提示红景天苷预处理可减轻大鼠压疮组织损害,其机制可能与抑制压疮引起的炎症反应有关。
[1] 张纯瑜,崔飞飞,张龙,等. TNF-α、IL-1在Ⅰ期压疮中的作用及表达[J]. 护理学杂志,2011,26(24):1-4
[2] 蔡福满,姜丽萍,杨晔琴,等. 褥疮不完全性缺血再灌注损伤简易模型的建立[J]. 中国病理生理学杂志,2009,25(4):830-832
[3] 姜丽萍,蔡福满,杨晔琴,等. 局部皮肤持续受压致压疮的实验研究[J]. 解放军护理杂志,2007,24(12A):4-5;8
[4] Reid RR,Sull AC,Mogford JE,et al. A novel murine model of cyclical cutaneous ischemia-reperfusion injury[J]. J Surg Res,2004,116(1):172-180
[5] Sundin BM,Hussein MA,Glasofer S,et al. The role of allopurinol and deferoxamine in preventing pressure ulcers in pigs[J]. Plast Reconst Surg,2000,105(4):1408-1421
[6] Bonnefoy M,Coulon L,Bienvenu J,et al. Implication of cytokines in the aggravation of malnutrition and hypercatabolism in elderly patients with severe pressure sores[J]. Age Ageing,1995,24(1):37-42
[7] Davies AL,Hayes KC,Dekaban GA. Clinical correlates of elevated serum concentrations of cytokines and autoantibodies in patients with spinal cord injury[J]. Acrh Phys Med Rehabil,2007,88(11):1384-1393
[8] Podrez EA,Poliakov E,Shen Z,et al. A novel family of atherogenic oxidized phospholipids promotes macrophage foam cell formation via the scavenger receptor CD36 and is enriched in atherosclerotic lesions[J]. J Biol Chem,2002,277:38517-38523
[9] 王艳艳,张纯瑜,孙艳,等. 氧化应激反应及细胞凋亡与早期压疮形成的关系研究[J]. 中华护理杂志,2011,46(5):508-510
[10] Shen W,Gan J,Xu S,et al. Penehyclidine hydrochloride attenuates LPS-induced acute lung injury involvement of NF-kappa B pathway[J]. Pharmacol Res,2009,60(4):296-302
[11] 崔艳梅,娄安如,赵长琦. 红景天属植物化学成分及药理作用研究进展[J]. 北京师范大学学报:自然科学版,2008,44(3):328-332
[12] 张丽楠,李屹,刘永琦,等. 红景天苷现代药理研究进展[J]. 临床荟萃,2011,26(21):1931-1932
[13] Guan S,Feng H,Song B,et al. Salidroside attenuates LPS-induced pro-inflammation cytokine responses and improves survival in murine endotoxemia[J]. Int Immunopharmacol,2011,11(12):2194-2199
[14] 邹毅清,蔡志扬,李小宝,等. 红景天苷预处理对大鼠全脑缺血再灌注后炎症反应的影响[J]. 现代中西医结合杂志,2013,22(3):253-255
Effects of salidroside preconditioning on inflammatory reaction in rat model of pressure ulcer
ZOU Yiqing1,2, ZHENG Haiyan1, HUANG Fengjin1, LIN Jin1
(1. 476 Hospital of Fuzhou General Hospital, Fuzhou 350002, Fujian, China;2. Fuzhou General Clinical Medical College of Fujian Medical University, Fuzhou 350025, Fujian, China)
Objective It is to study the effect of salidroside preconditioning on histopathological changes and inflammatory reaction in rat model of pressure ulcer. Methods Thirty SD male rats were randomly divided into sham operated group (C group), model group (I/R group) and Salidroside preconditioning group (S group).The animals were intraperitoneally administered with drugs for 7 days. Thirty minutes after the end administration, pressure ulcer models were made. Ten rats in each group were killed to obtain their serum 2h after successful modeling. The levels of TNF-α and IL-6 and the activity of MPO and SOD in the serum were measured. Results Hematoxylin-eosin staining demonstrated tissue damage in I/R group and the S group were significantly severer than C group(P<0.05); whereas compared to I/R group, tissue damage in S group was significantly milder. The levels of TNF-α and IL-6, and the activity of MPO and SOD in the serum in I/R group and the S group showed differences compared with those in C group (allP<0.05). Compared to I/R group, the levels of TNF-αand IL-6, and the activity of MPO in the serum were significantly lower, and the activity of SOD in the serum were significantly higher in S group (P<0.05). Conclusion Salidroside could exert protective effect against ischemia-reperfusion injury in pressure ulcer rats, and its mechanism may be related to relieve the abnormity of inflammatory reactions.
salidroside; rat; pressure ulcer; ischemia reperfusion injury; inflammatory reaction
邹毅清,男,副教授,副主任医师,博士,研究方向为重症医学。
郑海燕,E-mail:haiyan51@163.com
10.3969/j.issn.1008-8849.2015.22.004
R
A
1008-8849(2015)22-2406-03
2015-02-10

