高压氧干预对大鼠脊髓继发性损伤中HIF-1α及VEGF表达的影响
王 涛
(辽宁省沈阳市骨科医院,辽宁 沈阳 110004)
高压氧干预对大鼠脊髓继发性损伤中HIF-1α及VEGF表达的影响
王 涛
(辽宁省沈阳市骨科医院,辽宁 沈阳 110004)

目的 观察大鼠脊髓损伤及高压氧干预后不同时期受损脊髓组织内血管内皮生长因子(HIF-1α)及血管内皮生长因子(VEGF)表达的变化,探讨高压氧干预对大鼠急性脊髓损伤后的神经保护机制。方法 将成年SD大鼠80只采用改良Allen’s方法制作脊髓损伤模型,然后将大鼠随机分为2组,损伤组不给予干预措施,干预组辅助以高压氧干预。2组分别于损伤后1,3,7,14 d随机抽取6只大鼠,采用BBB方法评价大鼠后肢运动功能,手术取出受损节段脊髓组织,采用荧光定量PCR法及Western-Blot法检测HIF-1α及VEGF的表达情况。结果 2组大鼠损伤后均表现为双下肢全瘫,BBB评分0~1分;干预组损伤后7,14 d BBB评分明显高于损伤组(P均<0.05),损伤后3,7,14 d HIF-1α mRNA和蛋白的表达均明显低于损伤组(P均<0.05),术后7,14 d VEGF mRNA和蛋白的表达均显著高于损伤组(P均<0.05)。结论 高压氧干预能够抑制HIF-1α的表达,且不依赖HIF-1α的作用实现VEGF的高表达,延长VEGF高表达的时间,从而发挥神经保护作用。
高压氧;脊髓损伤;缺氧诱导因子-1α;血管内皮生长因子
脊髓损伤(spinal cord injury, SCI)是一种严重危害人类健康的伤病,具有很高的致残率和致死率。高压氧(hyperbaric oxygen,HBO)可以有效改善脊髓损伤后的肢体功能障碍,在多方面阻断脊髓损伤后继发的病理变化,是治疗脊髓损伤的重要方法之一,其疗效已经得到了研究证实[1-2]。然而,高压氧对脊髓继发损伤的神经保护作用机制并不明确。以往的实验表明:脊髓损伤后导致局部缺氧缺血环境可以有效刺激缺氧诱导因子-1α(HIF-1α)表达的增加,通过对血管内皮生长因子(VEGF)进行转录和转录后的调控,上调VEGF的表达,促进血管生成,改善微循环[3]。然而,这种脊髓组织对缺氧缺血环境的自我保护机制迅速而短暂,并不足以持续对抗脊髓继发性的损伤。本研究通过比较HIF-1α及VEGF在脊髓损伤及高压氧干预后不同时期表达的变化,探讨高压氧干预对大鼠急性脊髓损伤可能存在的神经保护作用机制。
1 实验资料
1.1实验动物与分组 成年健康SD大鼠80只,雌雄不限,8周龄,体质量250~300 g,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK(京)2012-0003。饲养环境:室内温度18~26 ℃,相对湿度50%~75%。随机平均分为损伤组及干预组。
1.2 动物模型的建立 2组均采用Allen’s重物坠落法(Weight-Dropping, WD)制作脊髓撞击损伤模型[4-5],撞击成功标志:脊髓组织水肿、出血,硬脊膜完整膨隆呈紫红色;大鼠出现摆尾反射,双侧下肢回缩扑动,迟缓性瘫痪。造模成功后大鼠靠前肢拖动身体,腹部贴地,双后肢运动功能丧失,双足背侧着地,无负重功能,小便潴留,脊髓损伤大鼠运动功能评分系统(Basso,Beattie and Bresnassian locomotors rating scale,BBB)[5]评分0~1分。
1.3 高压氧干预方法 干预组大鼠在造模后6 h置入动物高压氧舱(YLC 0.5/0.8型)进行高压氧干预:纯氧洗舱5 min,升压10 min,稳压于2ATA,持续吸氧60 min,减压15 min,干预时保持持续通风,氧流量维持8~10 L/min,舱内氧浓度在95%以上。前3 d每天2次,每次间隔8 h,3 d后每天1次。
1.4 大鼠后肢运动功能评价 各组大鼠损伤后1,3,7,14 d随机抽取6只,由2名熟悉BBB评分标准的实验人员进行盲法评分。
1.5 动物标本的取材 以0.3%水合氯醛腹腔注射麻醉,俯卧位固定;腰背部原手术切口,剥离椎旁肌,暴露原打击的T10硬脊膜区域,切除T8—9及T11—12棘突、椎板以及上下关节突关节,扩大脊髓暴露区域,保持硬脊膜完整,取出包括损伤节段的脊髓组织2.0~2.5 cm置于液氮保存。
1.6 HIF-1α mRNA及VEGF mRNA表达的检测 采用免疫荧光定量PCR方法检测。采用RNA抽提试剂盒(天根生物)提取脊髓组织总RNA;紫外分光光度计测定吸光度评价RNA纯度,1%琼脂糖凝胶电泳检测RNA质量。应用M-MLV逆转录酶(宝生物)合成cDNA。使用Bio Easy SYBR GreenⅠ实时定量PCR试剂盒(杭州博日),结合SYBR Green荧光染料探测PCR产物,使用Line-gene荧光定量PCR检测系统(杭州博日)测定扩增效率,评价溶解曲线,采用2-△△ct方法进行定量分析。
1.7 HIF-1α及VEGF蛋白表达的检测 采用Western-Blot方法检测。常规方法提取蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度。电泳:配制12%分离胶和4%浓缩胶,每个样品上量20 μg,电泳电压分别为120 V分离胶和90 V浓缩胶。转膜:PVDF膜先在甲醛溶液中浸湿,按顺序组装好转膜装置,电压100 V,60 min,转膜完毕后,TBST中洗1次,5 min。封闭:用TBST配制脱脂奶粉,将膜浸入,室温4 h。一抗孵育:用1%封闭液将一抗HIF-1α,一抗VEGF和一抗B-actin分别按照1∶100,1∶200和1∶2 000比例稀释,与膜共同孵育,4 ℃过夜后,TBST中洗3次,5 min/次。二抗孵育:用1%封闭液稀释HRP标记的二抗(Jackson)山羊抗鼠和山羊抗兔,比例均为1∶10 000,与膜共同孵育4 h,TBST中洗3次,5 min/次。ECL曝光显色,照相后使用LabWorks软件对图像进行灰度分析。
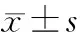
2 结 果
2.1造模情况 2组大鼠均表现为双下肢全瘫,完全符合大鼠脊髓损伤后肢行为学标准。
2.2 损伤后不同时间大鼠后肢运动功能BBB评分比较 损伤后1,3d,2组BBB评分比较差异均无统计学意义(P均>0.05)。损伤后7,14d,干预组BBB评分均明显高于损伤组(P均<0.05)。见表1。
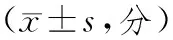
表1 损伤后不同时间点后肢运动功能BBB评分比较
注:①与损伤组比较,P<0.05。
2.3HIF-1αmRNA及VEGFmRNA表达情况 损伤后1d, 2组HIF-1αmRNA表达差异无统计学意义(P>0.05);损伤后3,7,14d,干预组HIF-1αmRNA表达显著低于损伤组(P均<0.05)。损伤后1,3d,2组VEGFmRNA表达比较差异无统计学意义(P>0.05);损伤后7,14d,干预组VEGFmRNA表达显著高于损伤组(P均<0.05)。见表2及表3。
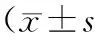
表2 损伤后不同时间点HIF-1α mRNA表达情况,分)
注:①与损伤组比较,P<0.05。
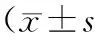
表3 损伤后不同时间点VEGF mRNA表达情况,分)
注:①与损伤组比较,P<0.05。
2.4HIF-1α及VEGF蛋白表达情况 损伤后1d,2组HIF-1α蛋白表达比较差异无统计学意义(P>0.05);损伤后3,7,14d,干预组HIF-1α蛋白表达显著低于损伤组(P均<0.05)。损伤后1,3d,2组VEGF蛋白表达比较差异无统计学意义(P>0.05);损伤后7,14d,干预组VEGF蛋白表达显著高于损伤组(P均<0.05)。见表4及表5。
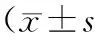
表4 损伤后不同时间点HIF-1α蛋白表达情况,分)
注:①与损伤组比较,P<0.05。
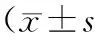
表5 损伤后不同时间点VEGF蛋白表达情况,分)
注:①与损伤组比较,P<0.05。
3 讨 论
HIF-1α作为体内氧调控信息传递通路中的低氧依赖性蛋白,受到细胞内氧分压的精确调控,通过高表达激活目标基因的低氧反应元件,有效提高组织细胞对缺氧缺血环境的适应性。高压氧干预可以有效改善脊髓损伤部位组织细胞的缺氧状态,提高损伤周围脊髓组织内的氧分压,减轻低氧环境对HIF-1α表达增强的影响程度,增加泛素-蛋白酶系统对HIF-1α的降解作用[6-7],从而导致HIF-1α表达的减少。本研究结果表明, 损伤后3,7,14d,干预组HIF-1αmRNA及HIF-1α蛋白表达均明显低于损伤组(P均<0.05), 间接说明高压氧的确能够增加组织细胞的氧分压,有效改善受损脊髓组织的缺氧状态,这在脊髓损伤早期对减轻缺氧缺血所引发的继发性损害具有积极意义。以往的研究发现[8-10]:HIF-1α表达的动态变化与细胞凋亡相关,提示HIF-1α对调节细胞凋亡起重要作用。
VEGF是上个世纪80年代发现的一种能够特异性作用于血管内皮细胞的促血管生成因子。本研究结果表明,VEGF的表达变化趋势与HIF-1α的表达变化趋势不一致。相对于脊髓损伤后VEGF表达的增强,高压氧干预后这种增强作用更加明显,在损伤后的1,3d,干预组VGEF的表达有轻度增加,但差异无统计学意义;分析原因考虑为高压氧抑制HIF-1α的表达,导致HIF-1α对VEGF的增强作用减弱有关。而在损伤后的7,14d,干预组VEGF的表达明显增加(P<0.05),表现为VEGF表达高峰的延迟以及高表达持续时间的延长。提示高压氧能够有效增加VEGF的表达,而且这一作用并不通过HIF-1α的增加来实现,考虑到VEGF的多个调控位点,推测高压氧直接或间接通过其他的调控位点来发挥对VEGF的调控作用。有研究表明[11-13]:VEGF通过R2/flk-1受体途径介导对脊髓神经细胞发挥神经营养作用。R2/flk-1受体不仅分布于血管内皮细胞,而且在神经元和神经胶质细胞中有广泛表达。近年来研究显示脊髓损伤后,R2/flk-1受体表达增加,VEGF通过该受体发挥促进血管生成及直接的神经营养与促进神经再生的作用[14]。本研究结果表明高压氧能够作为独立因素增加VEGF的表达,通过这一途径实现的高表达可能不仅仅是促进血管内皮细胞的增殖和再生来实现神经保护,还有可能是通过单独的神经营养发挥作用。这与目前的一些研究认为VEGF作为一种独立的神经保护因子发挥神经保护作用一致[10]。
综上所述,高压氧干预能够有效改善脊髓损伤后的肢体功能障碍;通过抑制HIF-1α及增加VEGF的表达减轻神经组织损伤的程度,促进神经功能的恢复;高压氧干预能够作为独立因素增加VEGF的表达,这一作用不依赖HIF-1α的调控作用,VEGF的高表达可能不仅仅是促进血管内皮细胞的增殖和再生来实现神经保护,更可能是通过单独的神经营养发挥神经保护作用。
[1]AtasmotoS,SugiyamaH,DoiH,etal.Hyperbaricoxygen(HBO)therapyforacutetraumaticcervicalspinalcordinjury[J].SpinalCord,2000,38(9):538-540
[2] 廖光军.Propentofylline对大鼠脊髓损伤后的神经保护作用及其机制的研究[D]. 武汉:华中科技大学,2007
[3] 孙沛. 血管内皮生长因子C(VEGF-C)融合蛋白的原核表达及纯化[D]. 福州:福建农林大学,2009
[4]AllenAR.Surgeryofexperimentallesionofspinalcordequivalenttocrushinjuryoffracturedislocationofspinalcolum[J].JAMA,1911,57(11):878-880
[5]BassoDM,BeattieMS,BresnassianJC.GradedhistologicalandlocomotoroutcomesafterspinalcordcontusionusingtheNYUweight-dropdeviceversustransection[J].ExpNeurol,1996,139(2):244-256
[6]BassoDM,BeattieMS,BresnassianJC.Asensitiveandreliablelocomotorratingscaleforopenfieldtestinginrats[J].JNeurotrauma,1995,12(1):1-21
[7] 吴天定. 川芎嗪对大鼠急性脊髓损伤后血管再生的作用及相关机制的研究[D]. 长沙:中南大学,2012
[8] 王法臣. 过氧化物酶体增殖物激活受体γ对大鼠脊髓损伤神经保护作用及机制的实验研究[D]. 泰安:泰山医学院,2010
[9]BruckerPU,IzzoNJ,ChuCR.Tonicactivationofhypoxia-induciblefactor1αinavasculararticularcartilageandimplicationsformetabolichomeostasis[J].ArthritisRheum,2005,52(10):3181-3191
[10]LiLH,QuY,LiJH,etal.RelationshipbetweenHIF-1αexpressionandneuronalapoptosisinneonatalratswithhypoxia-ischemiabraininjury[J].BrainRes,2007,1180(11):133-139
[11]LiY,ZhouCM,CalvertJW,etal.MultipleeffectsofhyperbaricoxygenontheexpressionofHIF-1αandapoptoticgenesinaglobalischemia-hypotensionratmodel[J].ExpNeurol,2005,191(1):198-210
[12]KimJY,AhnHJ,RyuJH,etal.BH3-onlyproteinNoxaisamediatorofhypoxiccelldeathinducedbyhypoxia-induciblefactor1α[J].JExpMed,2004,199(1):113-124
[13]RosensteinJM,KrumJM.NewrolesforVEGFinnervoustissue-beyondbloodvessels[J].ExpNeurol,2004,187(2):246-253
[14] 卢培刚. 高压氧和低压缺氧预处理对大鼠脊髓损伤神经保护作用及机制的实验研究[D]. 重庆:第三军医大学,2008
Effect of hyperbaric oxygen intervention on HIF-1 alpha and VEGF expression in rats with spinal cord secondary injury
WANG Tao
(Orthopedic hospital of Shenyang, Shenyang 110004, Liaoning, China)
Objective It is to observe the changes of hypoxia inducing factor-1 alpha (HIF-1 alpha) and VEGF expression in the injuried spinal cord tissue in the rats with spinal cord injury (SCI) before intervention and in different periods after intervention with hyperbaric oxygen, to explore the nerve protective mechanism of hyperbaric oxygen for acute SCI. Methods 80 adult SD rats used to establish SCI models by modified Allen’s method, then the models were randomly divided into two groups, the injury group were given no intervention, while the intervention group was treated with hyperbaric oxygen after model establishing. Six rats were randomly selected from each group in 1, 3, 7, 14 days after injury to evaluate hind limbs motor function by BBB method, and their damaged spinal cord segments were taken out by surgery to detect the expression of HIF - 1 alpha and VEGF by fluorescence quantitative polymerase chain reaction (PCR) and Western Blot method. Results All the rats in both group were characterized by double lower limbs panplegia, BBB score of 0~1 after injury; the BBB scores in intervention group were significantly higher than that in the injury group in 7, 14 days after injury (allP<0.05); the expression of HIF-1alpha mRNA and protein in intervention group were significantly lower than that in the injury group in 3, 7, 14 days after injury (allP<0.05), the expression of VEGF mRNA and protein in intervention group were significantly higher than that in the injury group in 7, 14 days after injury (allP<0.05). Conclusion Hyperbaric oxygen intervention can inhibit the expression of HIF-1 alpha, and do not rely on HIF-1 alpha role to realize high expression of VEGF, extend the time of high expression of VEGF, thus to play nerve protective effect.
hyperbaric oxygen; spinal cord injury; hypoxia inducing factor-1 alpha; vascular endothelial growth factor
王涛,男,主治医师,研究方向为创伤骨科。
辽宁省教育厅科学研究项目(L2010550);沈阳医学院科学研究基金项目(20121019)
10.3969/j.issn.1008-8849.2015.22.003
R-332
A
1008-8849(2015)22-2403-03
2015-01-10

