稳肾颗粒对肾间质纤维化大鼠MMP-9/TIMP-1比值及Ets-1表达的影响
高磊平,周育锋,王春花,王 锋
(江苏省常熟市中医院,江苏 常熟 215500)
论 著
稳肾颗粒对肾间质纤维化大鼠MMP-9/TIMP-1比值及Ets-1表达的影响
高磊平,周育锋,王春花,王 锋
(江苏省常熟市中医院,江苏 常熟 215500)

目的 观察稳肾颗粒对肾间质纤维化大鼠基质金属蛋白酶-9(MMP-9)/金属蛋白酶组织抑制因子-1(TIMP-1)比值及逆转录病毒E26转录因子1(Ets-1)表达的影响,初步探讨其抗肾间质纤维化的作用机制。方法 将30只大鼠随机分为正常组、模型组、治疗A组和治疗B组。除正常组外,其余组均采用腺嘌呤干预建立肾间质纤维化大鼠模型,造模第22天起,治疗B组给予稳肾颗粒干预直至第42天;造模第29天起,治疗A组给予稳肾颗粒干预直到第42天。第43天处死大鼠,留取标本观察病理。Real time-PCR法检测肾组织中Ⅳ型胶原(Col Ⅳ)、MMP-9、TIMP-1和Ets-1 mRNA表达量。结果 稳肾颗粒可以改善模型鼠肾功能,促进细胞外基质(ECM)降解,下调Col Ⅳ,上调MMP-9/TIMP-1比值,增加Ets-1表达。结论 稳肾颗粒可能通过调节Ets-1蛋白表达而改善降解酶系统的功能紊乱,促进ECM降解,减少ECM沉积,改善肾间质纤维化。
肾间质纤维化;基质金属蛋白酶9/金属蛋白酶组织抑制因子-1;逆转录病毒E26转录因子1;稳肾颗粒
慢性肾脏病(chronic kidney disease,CKD)是危害公众健康的常见病和多发病。我国CKD总患病率达10.8%,患者预计近1.2亿,发病率与美国及欧洲国家相当,而大多患者处于1~2期[1]。无论何种病因,在CKD进展的过程中,肾间质纤维化(renal interstitial fibrosis,RIF)是所有CKD进展至终末期肾病的共同途径。而细胞外基质(ECM)合成和降解平衡失调使ECM异常沉积,是造成RIF的主要机制之一,其中以合成增加、降解减少为特征的ECM代谢失衡能促进RIF[2]。基质金属蛋白酶(MMPs)和金属蛋白酶组织抑制剂(TIMPs)构成的降解酶系统在肾脏疾病中的异常表达与ECM的代谢失调密切相关[3]。研究表明,逆转录病毒E26转录因子1(Ets-1)通过调节降解酶系统的平衡,对ECM在肾间质内沉积产生影响[4]。因此,笔者推测,在体内增加Ets-1蛋白表达,改善降解酶系统的功能紊乱,促进ECM降解就可以减少ECM沉积,改善RIF。据报道,中药治疗CKD有一定作用,能明显改善RIF[5]。稳肾颗粒是以中医辨证理论为依据,针对CKD脾肾衰败、浊邪壅塞三焦的病机特点,结合现代医学研究成果,辨证与辨病相结合创立的有效制剂。稳肾颗粒由中药黄芪、党参、白术、茯苓、制首乌、鸡血藤、赤芍、川芎、车前草、紫苏、大黄等组成,具有健脾利湿、通腑降浊、活血化瘀的功能,能改善肾脏纤维化,然而,相关药理机制尚不清楚。笔者借助腺嘌呤诱导的RIF模型,观察了稳肾颗粒对肾组织Ⅳ型胶原(Col Ⅳ)、MMP-9/TIMP-1比值及Ets-1 mRNA表达及活性的影响,旨在明确其在ECM降解过程中的作用,进一步阐明其相关分子机制。
1 实验资料
1.1实验动物 体质量200 g左右、年龄2个月左右的雌性Sprague-Dawley大鼠(SPF级)30只,购于苏州希诺赛生物科技有限公司,动物合格证号:201504310。在苏州大学药学院动物实验中心饲养,所有大鼠均喂标准饲料,并自由饮水,大鼠购回后适应性饲养7 d。
1.2 药物和试剂 腺嘌呤购于Sigma公司,将1 g腺嘌呤溶解于50 mL淀粉中,配置成20 mg/mL的腺嘌呤悬浊液;稳肾颗粒配置:生黄芪颗粒10 g、党参颗粒10 g、炒白术颗粒10 g、茯苓颗粒10 g、制首乌颗粒10 g、制大黄颗粒6 g、鸡血藤颗粒15 g、赤芍颗粒10 g、川芎颗粒6 g、车前草颗粒15 g、紫苏叶颗粒10 g购于常熟中医院,将其溶于50 mL蒸馏水中,配置成1 344 mg/mL稳肾颗粒溶液。全蛋白提取试剂盒、ECL检测试剂盒、Braford蛋白含量检测试剂盒、预染蛋白分子量购自南京凯基生物科技发展有限公司;TRIzol购自美国Invitrogen;cDNA第一链合成试剂购自美国 Thermo Fisher;Real time PCR Master Mix(SYBR Green)购自日本 TOYOBO;Agarose购自西班牙Biowest。GAPDH、羊抗兔IgG-HRP均购自南京凯基生物科技发展有限公司。其中部分试剂和抗体委托上海元象医疗器械有限公司代购。引物设计情况见表1。
1.3 模型制作和分组、给药方法 将30只SD大鼠适应性喂养7d后,按随机数字表分为正常组5只、模型组8只、治疗A组8只、治疗B组9只。采用腺嘌呤灌胃的方法建立大鼠RIF模型。在实验开始的第1—28天对于正常组之外的25只大鼠进行腺嘌呤(150 mg/kg)灌胃;期间第22天起,治疗B组大鼠给予稳肾颗粒18.6 g/(kg·d)[对于60 kg标准体质量CKD患者,稳肾颗粒的临床治疗量为112 g/d,按动物标准换算公式,大鼠的有效量相当于18.6 g/(kg·d)]干预,直至第42天;第29天起,治疗A组大鼠给予稳肾颗粒18.6 g/(kg·d)干预,正常组、模型组大鼠给予蒸馏水2 mL灌胃,直至第42天。第43天,经腹腔注射氯胺酮麻醉大鼠,心脏穿刺处死,采集血液样本和肾组织进行各项指标的检测。

表1 PCR引物
1.4 观察指标及检测方法
1.4.1 一般情况和肾脏外观特征 每天观察各组大鼠精神、饮食、饮水、皮毛色泽以及活动情况等;药物和蒸馏水干预前后,每周末称量大鼠体质量;处死大鼠前观察外观特征;摘除大鼠肾脏后,称量肾脏质量,并摄片。
1.4.2 血清生化指标检测 第43天时,在氯胺酮麻醉状态下解剖大鼠胸腔,经心脏采血。采用全自动生化分析仪检测大鼠血清生化指标,包括血清肌酐(SCr)、血清尿素氮(BUN)、尿酸(UA)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(Alb)、胆固醇(TC)、三酰甘油(TG)等。
1.4.3 肾脏组织形态特征 解剖大鼠腹腔,自肾门处摘取两侧肾脏,肾脏摘除后,分离皮髓质,并取少量肾皮质(肾脏的上极或下极)固定于10%中性福尔马林内,经脱水16 h后,石蜡包埋,3 μm切片,进行苏木精伊红(HE)和过碘酸雪夫(PAS)染色,借助光学显微镜(光镜)观察肾组织病理特征,观察肾间质ECM沉积程度。以Masson染色观察肾组织胶原沉积程度来评估间质纤维化程度。每张切片随机选取不重叠的10个视野(×400)肾小球,采用病理图像分析系统Image-pro plus(IPP)计算肾间质ECM和胶原相对面积的比值(ECM或胶原面积/肾间质面积)。
1.4.4 肾组织Col Ⅳ、MMP-9、TIMP-1以及Ets-1 mRNA表达检测 采用Real time-PCR法:用TRIzol裂解,提取标本总RNA。用紫外分光光度计测定总RNA浓度及纯度。根据测定的RNA浓度,合成cDNA,将反转录得到的cDNA样本稀释10倍用于实验。设计引物序列,配制反应体系,进行PCR扩增,初始变性95 ℃、5 min,再次变性95 ℃、15 s,退火60 ℃、20 s,延伸72 ℃、40 s进行40个循环,最后按照95 ℃、15 s,60 ℃、60 s,每个循环按0.3 ℃递增到95 ℃。将产物进行溶解曲线分析,单峰溶解曲线表示扩增产物单一,无非特异性扩增产物。最后采用数据分析软件对数据进行处理分析,计算Col Ⅳ、MMP-9、TIMP-1和Ets-1相对表达量。
1.5 统计学方法 采用SPSS 18.0统计软件进行统计分析。计量资料采用均数±标准差表示,组间比较进行方差齐性检验后采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠一般情况 正常组5只大鼠状态均良好。模型组、治疗A组、治疗B组大鼠病死率较高,主要死因为代谢紊乱及操作失误。除正常组外,大鼠均出现精神萎靡,活动度下降,食欲不振,轻度腹泻,毛发枯暗而杂乱,体质量减轻等,其中模型组大鼠最为明显,治疗A组及治疗B组大鼠上述情况均有所改善,处死前体质量亦有所增加,但治疗A组与治疗B组比较差异无统计学意义。
2.2 各组大鼠血清生化指标比较 在第43天,模型组、治疗A组和治疗B组大鼠SCr、BUN、UA均明显高于正常组(P均<0.01),治疗A组、治疗B组与模型组相比SCr、BUN、UA均明显下降(P<0.05或P<0.01),但是治疗A组和治疗B组比较差异无统计学意义。模型组大鼠Alb低于正常组(P<0.05),治疗A组和治疗B组Alb明显高于模型组(P均<0.05),治疗A组和治疗B组比较差异无统计学意义。各组之间AST、ALT、TC、TG比较差异均无统计学意义。见表2。
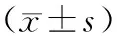
表2 各组大鼠血清生化指标比较
注:①与正常组比较,P<0.01;②与正常组比较,P<0.05;③与模型组比较,P<0.05;④与模型组比较,P<0.01。
2.3 各组大鼠肾脏组织形态比较
2.3.1 大体标本 正常组大鼠肾脏形态完整,颜色红润,表面光滑饱满,见图1;模型组大鼠肾脏体积较正常组明显增大,苍白而缺血,表面颗粒状,肾皮质变薄,见图2;治疗A组和治疗B组大鼠肾脏体积增大,但程度较模型组轻,缺血等外观特征有所改善,并且治疗B组好于治疗A组,见图3和图4。

图1 正常组大鼠肾脏外观和形态

图2 模型组大鼠肾脏外观和形态

图3 治疗A组大鼠肾脏外观和形态

图4 治疗B组大鼠肾脏外观和形态
2.3.2 大鼠肾小管间质病变特征及胶原的表达 经光镜观察,正常组大鼠肾小球毛细血管襻开放良好,肾小管上皮细胞排列整齐,未见肾间质ECM增宽和明显的炎性细胞浸润,见图5及图6;模型组大鼠出现肾小球系膜增殖、系膜硬化,肾间质水肿、大量炎症细胞浸润,肾小管扩张、萎缩,肾间质ECM增宽,见图7及图8;治疗A组和治疗B组以上情况有所改善,且治疗B组干预效果更明显,见图9~12。Masson染色显示正常组大鼠肾间质中胶原表达相对面积为1.39±0.09,见图13;模型组大鼠肾间质中胶原表达相对面积为32.25±1.08,明显多于正常组(P<0.05),见图14;治疗A组和治疗B组大鼠肾间质中胶原表达相对面积为21.86±0.81和12.45±0.45,均明显少于模型组(P均<0.05),且治疗B组少于治疗A组(P<0.05),见图15和图16。
2.4 各组大鼠肾组织Col Ⅳ、MMP-9、TIMP-1 mRNA的表达 模型组大鼠肾组织Col Ⅳ和TIMP-1 mRNA表达明显多于正常组(P均<0.05),MMP-9和MMP-9/TIMP1 mRNA表达显著低于正常组(P<0.05);治疗A组及治疗B组Col Ⅳ和TIMP-1 mRNA表达明显低于模型组(P均<0.05),MP-9和MMP-9/TIMP1 mRNA表达显著高于模型组(P均<0.05),治疗A组和治疗B组比较差异无统计学意义。见表3。
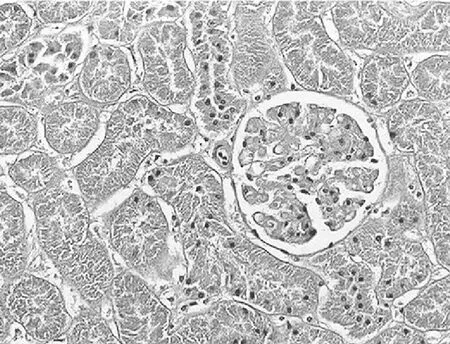
图5 正常组大鼠肾脏组织HE染色形态特征(×400倍)
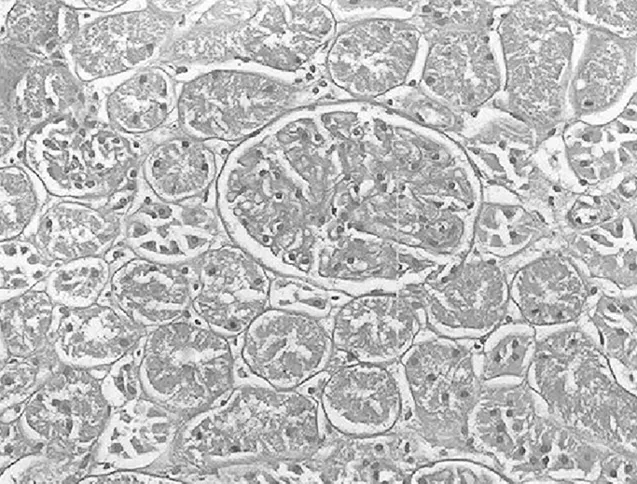
图6 正常组大鼠肾脏组织PAS染色形态特征(×400倍)
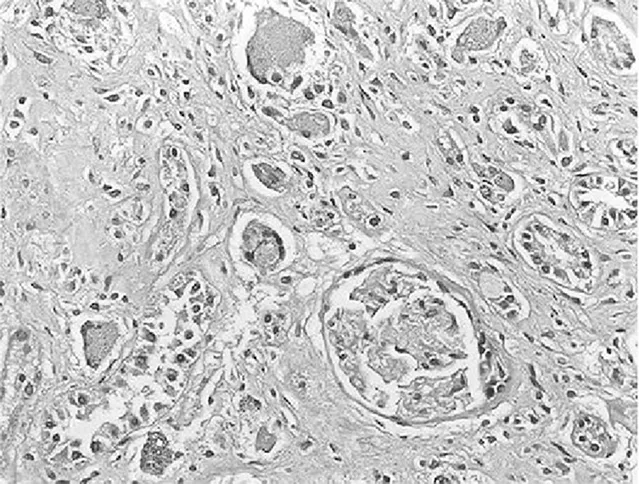
图7 模型组大鼠肾脏组织HE染色形态特征(×400倍)
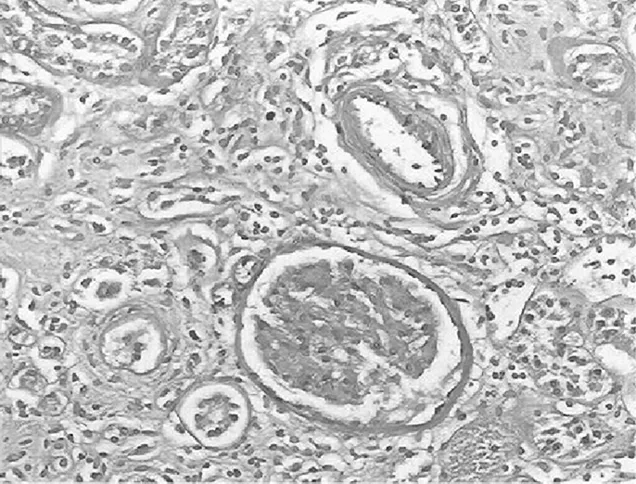
图8 模型组大鼠肾脏组织PAS染色形态特征(×400倍)
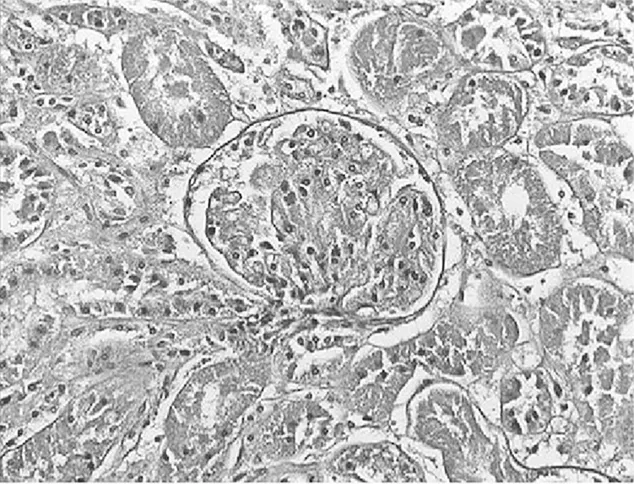
图9 治疗A组大鼠肾脏组织HE染色形态特征(×400倍)
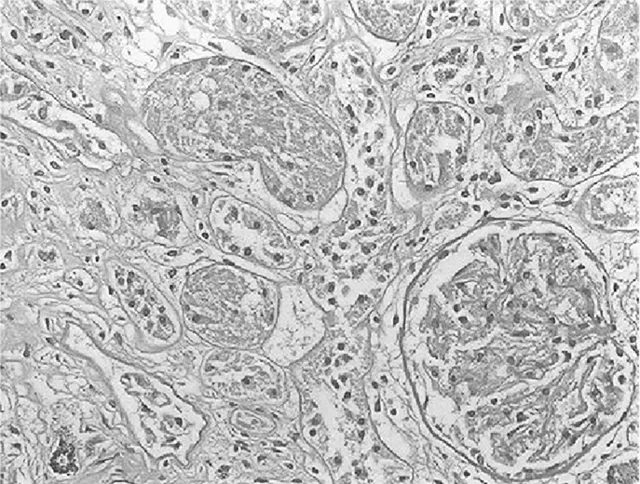
图10 治疗A组大鼠肾脏组织PAS染色形态特征(×400倍)
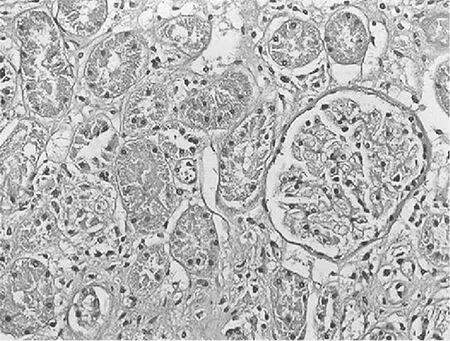
图11 治疗B组大鼠肾脏组织HE染色形态特征(×400倍)
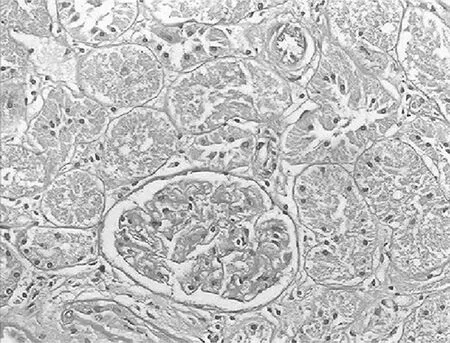
图12 治疗B组大鼠肾脏组织PAS染色形态特征(×400倍)
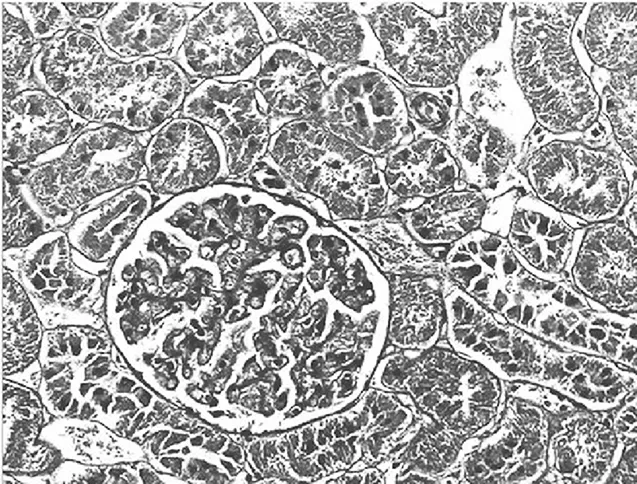
图13 正常组大鼠肾脏组织Masson染色形态特征(×400倍)
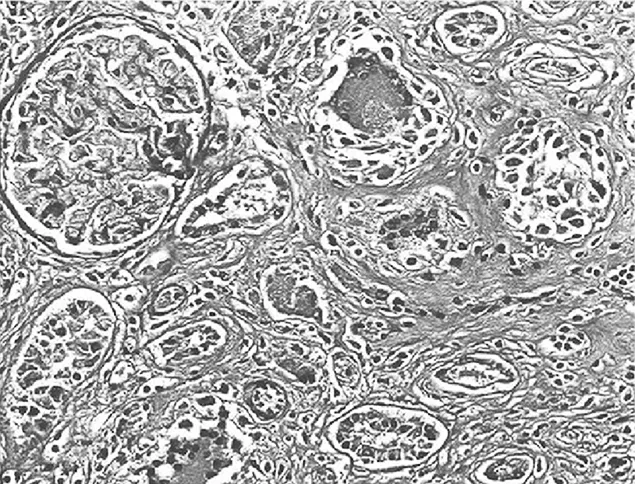
图14 模型组大鼠肾脏组织Masson染色形态特征(×400倍)
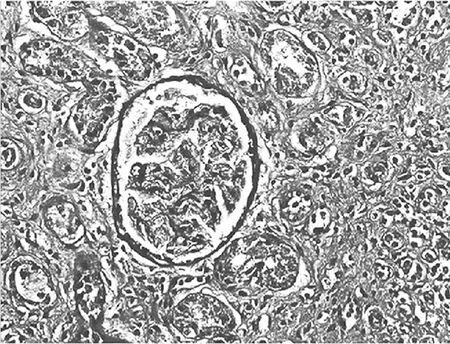
图15 治疗A组大鼠肾脏组织Masson染色形态特征(×400倍)
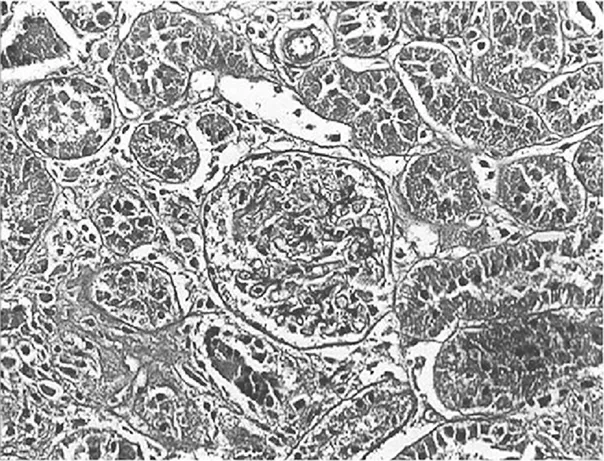
图16 治疗B组大鼠肾脏组织Masson染色形态特征(×400倍)
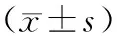
表3 各组大鼠肾组织Collagen Ⅳ、MMP-9、TIMP-1 mRNA表达
注:①与正常组比较,P<0.05;②与模型组比较,P<0.05。
2.5 各组大鼠肾组织Est-1 mRNA的表达 正常组、模型组、治疗A组、治疗B组大鼠肾组织Est-1 mRNA表达量分别为1.00±0.06,0.23±0.01,0.89±0.09,0.93±0.055。模型组Est-1 mRNA表达量明显低于正常组(P<0.05),治疗A组和治疗B组明显高于模型组(P均<0.05),治疗A组和治疗B组比较差异无统计学意义。
3 讨 论
CKD已成为全世界共同关注的公共健康问题,CKD不断进展及肾功能进行性下降的主要病理基础为持续加重的肾脏纤维化。目前认为RIF形成的分子机制主要分4个阶段[6]:第一阶段是细胞的活化和受损;第二阶段是促纤维化因子的释放;第三阶段是纤维化的形成,主要表现为ECM合成增多和降解减少;第四阶段是肾脏结构和功能受损,主要是ECM在肾脏的沉积所致。因此,ECM的沉积是RIF的核心。正常情况下,ECM合成与降解之间相互协调,相互制约,在体内始终保持着动态平衡,当这种生理平衡遭到破坏时,则最终出现ECM积聚,导致肾纤维化的发生发展,进而出现肾功能下降,SCr、BUN等升高。
ECM降解减少主要与蛋白酶抑制剂有关。ECM的降解是由MMPs和TIMPs构成的降解酶系统所调节的。MMPs属于锌离子依赖的内肽酶大家族,几乎能选择性分解所有ECM成分,MMP-9最为重要,主要降解Col Ⅳ[7];自然界中存在一种MMP-9的特异性抑制物TIMP-1。TIMP-1与MMP-9以1∶1比例非共价键结合形成MMP-9/TIMP-1复合体,阻断MMP-9与底物的结合和活化,两者共同参与ECM的降解过程[8]。既往研究已证实,MMP-9/TIMP-1失衡,降解ECM的能力减弱,从而促进RIF的发生[9]。傅淑霞等[10]借助单侧输尿管梗阻大鼠模型发现丹红注射液可以抑制TIMP-1活性,增强MMP-9表达,促进ECM降解而减轻RIF。
Ets作为丝裂原活化蛋白激酶亦参与了肾脏生理及各种肾损伤过程,包括RIF。Ets-1属于原癌基因,它编码的蛋白作为转录因子参与多种基因的转录调控,已经明确MMP-9基因的启动子序列上存在4个Ets-1的结合元件。Ets-1编码的蛋白作为转录因子参与了MMP-9/TIMP-1基因的转录调控。MMP-9基因启动子位置存在多种转录因子如Ets-1等的结合位点。体内转染Ets-1基因的肾炎性肾组织,肾小球MMP-9表达增加,系膜ECM减少;敲除肾小球Ets-1基因,则导致严重的细胞外基质沉积。用IL-1β刺激培养的小鼠肾脏成纤维细胞和小管上皮细胞,Ets-1蛋白和MMP-9活性显著提高;用Ets-1反义寡核苷酸链处理后,Ets-1蛋白表达下降50%,MMP-9的活性也明显抑制[11]。
本研究以腺嘌呤连续灌胃28d建立RIF大鼠模型,可以模拟人类早、中期阶段的CKD患者。结果发现,正常组大鼠肾功能正常,ECM沉积少;模型组大鼠SCr、BUN、UA明显升高,Alb下降,病理显示ECM沉积明显增多;而治疗A组和治疗B组大鼠SCr、BUN、UA水平低于模型组,且治疗B组的肾功能水平、病理改变更接近正常组各指标水平,推测稳肾颗粒的早期干预可更好地延缓肾功能进展,且不存在肝损害。另外稳肾颗粒可以上调Ets-1和MMP-9的表达,下调Col Ⅳ表达,且Ets-1表达增高还有下调TIMP-1表达的作用,使其对MMP-9的抑制作用降低,从而协同MMP-9对ECM的降解作用,同时也抑制了TIMP-1对ECM合成与沉积的促进作用。由此可见,稳肾颗粒可能通过上调Ets-1表达,调节MMP-9/TIMP-1之间的平衡而影响ECM(主要为Col Ⅳ)的合成与沉积,在RIF过程中起着关键性作用。
[1] Zhang L,Wang F,Wang L,et al. Prevalence of chronic kidney disease in China:a cross-sectional survey[J]. Lancet,2012,379(9818):815-822
[2] Hultstram M,Leh S,Skogstrand T,et al. Upregulation of tissue inhibitor of metalloproteases-1(TIMP-1)and procolla-gen-N-peptidase in hypertension-induced renal damage[J]. Nephrol Dial Transplant,2008,23(3):896-903
[3] Catania JM,Chen G,Parrish AR. Role of matrix metalloproteinases in renal pathophysiologies[J]. Am J Physiol Renal Physiol,2007,292(3):F905-911
[4] 陈涵枝,刘殿阁,丁弘,等. Ets-1在大鼠顺铂相关性肾病基质重塑中的作用[J]. 现代医学,2008,36(5):301-305[5]HuangYR,WeiQX,WanYG,etal.Ureicclearancegranule,alleviatesrenaldysfunctionandtubulointerstitialfibrosisbypromotingextracellularmatrixdegradationinrenalfailurerats,comparedwithenalapril[J].JEthnopharmacol,2014,155(3):1541-1552
[6]EddyAA.Molecularbasisofrenalfibrosis[J].PediatrcNephrol,2000,15(3/4):290-301
[7] 魏晴雪,万毅刚,赵青,等. 肾脏细胞外基质降解的分子机制及中药的干预作用[J]. 中国中药杂志,2013,38(4):533-538
[8]LiY,YangJ,DaiC,etal.Roleforintegrin-linkedkinaseinmediatingtubularepithelialtomesenchymaltransitionandrenalinterstitialfibrogenesis[J].JClinInvest,2003,112(4):503-516
[9]DuymelinekC,DengJT,DauweSE,etal.Inhibitionofthematrixmetalloproteinasesysteminaratmodelofchroniccyclosporinenephropathy[J].KidneyInt,1998,54(3):804-818
[10] 傅淑霞,陈亚坤,王晓铃,等. 丹红注射液对单侧输尿管梗阻大鼠Ets-1、MMP-9和TIMP-1表达的影响[J]. 中国现代医学杂志,2010,20(9):1284-1288
[11]NaitoT,TanihataY,NishimuraH,etal.Expressionofmatrixmetalloproteinase-9associatedwithets-1proto-oncogeneinrattubulointerstitialcells[J].NephrolDialTransplant,2005,20(11):2333-2348
Effect of Wenshen granules on MMP-9/TIMP-1 and the expression of Ets-1 in the rats with renal interstitial fibrosis
GAO Leiping, ZHOU Yufeng, WANG Chunhua, WANG Feng
(Changshu Hospital of Traditional Chinese Medicine, Changshu 215500, Jiangsu, China)
Objective It is to observe the effect of Wenshen granules on matrix metalloproteinases-9(MMP-9)/tissue inhibitor of metalloproteinase-1(TIMP-1)and the expression of E26 transformation specific-1(Ets-1) in the rat model of renal interstitial fibrosis(RIF), and to explore its anti-fibrotic mechanism. Methods 30 rats were randomly divided into 4groups:normal group,model group,treatment group A,treatment group B. All the rats except the ones in the normal group were used to establish renal interstitial fibrosis model by Adenine. On the 22th day after model establishing, treatment group B was treated with Wenshen granules, On the 29th day after model establishing, treatment group A was treated with Wenshen granules, the treatment would not stop until to the 42th day. All rats were killed on day 43, and their kidneys were harvested for morphological. Real time-PCR was used to assess the expression of college Ⅳ, MMP-9, TIMP-1 and Ets-1. Results WenShen granules treatment could significantly improve renal function, promote degradation of ECM, reduce the expressions of COL-Ⅳ, up-regulated the expressions of MMP-9/TIMP-1, and increase Ets-1 expression. Conclusion Wenshen granules could improve dysfunction of degrading enzyme system, promote degradation and reduce deposition of ECM and improve renal tubulointerstitial fibrosis by up-regulation of Ets-1 protein.
renal interstitial fibrosis;MMP-9/TIMP-1;Ets-1;Wenshen granules
高磊平,男,副主任医师,副教授,研究方向为各种肾小球疾病、急慢性肾功能不全的中西医结合治疗。
江苏省中医药局科技项目立项计划资助课题(LZ13158)
10.3969/j.issn.1008-8849.2015.22.001
R-332
A
1008-8849(2015)22-2395-06
2015-02-02

