PARP-1抑制剂PJ34对脑缺血再灌注损伤大鼠血脑屏障的影响
李岩,吴捧莲,杜良鹤,付新慧,王东玉
(1.辽宁省锦州市中心医院神经内科,辽宁 锦州 121000;2.辽宁医学院研究生院,辽宁 锦州 121001)
·论著·
PARP-1抑制剂PJ34对脑缺血再灌注损伤大鼠血脑屏障的影响
李岩1,吴捧莲2,杜良鹤2,付新慧2,王东玉1
(1.辽宁省锦州市中心医院神经内科,辽宁 锦州 121000;2.辽宁医学院研究生院,辽宁 锦州 121001)
目的探讨PARP-1抑制剂PJ34对大鼠局灶脑缺血再灌注损伤后血脑屏障的影响。方法线栓法建立大鼠局灶性脑缺血再灌注模型,135只大鼠随机分为假手术组(sham组)、缺血再灌注模型组(IR组)、PJ34干预组(PJ34组),每组45只,每组大鼠再随机分为3个亚组,分别在再灌注6、24和48 h时间点处死。测定伊文思蓝(EB)含量,观察脑组织血脑屏障通透性。免疫组织化学及Western bolt方法观察缺血侧皮层肿瘤坏死因子α(TNF-α)的表达和基质金属蛋白酶9(MMP-9)的活性变化。结果与sham组比较,IR组大鼠EB含量、TNF-α及MMP-9的表达明显升高(P<0.05);与IR组比较,PJ34组EB含量、TNF-α及MMP-9表达水平明显降低(P<0.05)。结论PARP-1抑制剂PJ34对大鼠脑缺血再灌注损伤后血脑屏障有一定的保护作用,其作用机制与降低缺血侧皮层TNF-α、MMP-9的表达水平,维持血脑屏障的稳定性有关。
脑缺血再灌注;血脑屏障;PARP-1;PJ34;肿瘤坏死因子α;基质金属蛋白酶9
缺血性脑血管病是危害人类健康的一种常见疾病,治疗关键在于恢复缺血脑组织的血液供应,但不可避免会带来再灌注损伤,再灌注损伤目前仍是临床治疗的瓶颈。脑缺血再灌损伤与血脑屏障破坏关系密切,血脑屏障通透性增加可引起严重的血管源性脑水肿和出血转化等并发症[1]。近年动物实验研究表明多聚腺苷二磷酸核糖聚合酶1[poly(ADP-ribose)polymerase-1,PARP-1]通过诱导细胞凋亡、调控炎性反应、加重出血转化等途径加重脑缺血损伤[2~4],但其与缺血损伤后的血脑屏障的关系国内尚无相关报道。本研究以一种高效PARP-1抑制剂PJ34作为干预因素,利用线栓法制备大鼠大脑中动脉栓塞模型,观察血脑屏障(blood brain barrier,BBB)通透性、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)和基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)表达水平的变化,进一步探索PARP-1抑制剂的脑保护途径,为临床治疗缺血性脑卒中提供实验依据。
1 材料与方法
1.1 实验动物
健康SD雄性大鼠135只,体质量250~300 g,由辽宁医学院动物实验中心提供。
1.2 试剂
PJ34(上海蓝木化工有限公司);TNF-α、MMP-9一抗(武汉博士德生物工程有限公司);伊文思蓝(Evans blue,EB)(北京化学试剂公司);甲酰胺(天津市标准科技有限公司提供)。
1.3 方法
1.3.1 动物分组:将135只SD大鼠随机分为假手术组(sham组)、缺血再灌注组(IR组)、PJ34干预组(PJ34组),每组45只。每组又根据再灌注时间分为6 h、24 h、48 h 3个亚组。PJ34组于缺血再灌注时及再灌注后2 h腹腔注射给药PJ34(10 mg/kg)。sham组、IR组于同时间点给予等剂量生理盐水。
1.3.2 模型制备:参照改良的Longa法[5]制备大鼠左侧大脑中动脉局部脑缺血再灌注模型。大鼠经10%水合氯醛(3 mL/kg)腹腔注射麻醉后,颈部正中切口,在左侧肩胛舌骨肌与胸锁乳突肌三角处暴露左颈总动脉、颈外动脉、颈内动脉,结扎左颈总动脉近心端、颈外动脉起始端。将一端烧成圆头(圆头直径约0.26~0.30 mm)的鱼线经颈总动脉分叉处通过颈内动脉入颅,插至大脑中动脉起始部,插入深度约为(18.0±0.5)mm。缺血2 h后,固定大鼠,轻轻提拉所留线头,拔出10 mm,使血流再通。sham组除不插入鱼线外,其余操作相同。在手术结束大鼠麻醉清醒后按Longa 5分制(0~4分)评分标准进行神经功能缺失程度评分。评分为1~3分的大鼠为合格脑缺血再灌注模型,对不合格大鼠所在组进行补充。术后保持环境温度在25~30℃,再灌注相应时间点除死大鼠。
1.3.3 EB渗透法定量分析BBB通透性变化:模型制备成功后,取脑前半小时股静脉注射2%EB。麻醉下用肝素化的生理盐水对大鼠进行心脏灌流,直至右心房流出清澈液体后断头取脑。脑组织称重,浸入甲酰胺(100 mg/mL),置于60℃水浴箱内孵育24 h。用分光光度计检测波长为620 nm的吸光度,根据绘制的EB标准曲线定量分析染料的含量。
1.3.4 TNF-α和MMP-9免疫组化检测:在规定时间点将大鼠以10%水合氯醛(3 mL/kg)麻醉,快速打开胸腔,经左心室灌流内固定后,断头取脑,在视交叉前2 mm及视交叉后2 mm处冠状切面切开,取中间脑组织放入相同固定液中继续外固定,4℃过夜,常规梯度乙醇脱水、二甲苯透明、浸蜡、包埋,连续冠状切片(厚5 μm),每隔5片取1片,用SABC免疫组化染色法检测TNF-α、MMP-9的表达。免疫组化染色操作步骤严格按试剂盒说明书进行,阴性对照以PBS代替TNF-α、MMP-9一抗。光镜下观察TNF-α和MMP-9的表达和分布,400倍光镜下随机选取缺血侧额叶皮层3个视野,计算平均积分光密度值(mean oprieal density,MOD)。
1.3.5 Western blot检测TNF-α和MMP-9:取缺血侧视交叉后2 mm皮层脑组织用于Western blot检测。将脑组织剪成碎块,加入0.3 mL裂解液,超声波细胞破碎20 s。5℃、12 000 r/min、离心30 min,取上清分装50 μL/管,用Bradford蛋白染色法检测蛋白含量。将上样缓冲液60 μL与30 μL样品上清裂解液混合,混匀后沸水浴上煮沸5 min。制备10%SDS-聚丙烯酰胺凝胶,每孔加变性后的总蛋白含量皆为50 μg。在100 V下电泳,至溴酚兰到凝胶底部。电压80 V恒压,1.5 h后将蛋白电转移到PVDF膜上。用含5%脱脂奶粉的封闭缓冲液室温封闭1 h。加入抗体4℃孵育过夜,加入辣根酶标记过的二抗,室温振荡孵育1 h。用ECL试剂盒显色,用发光法进行X线胶片曝光,然后进行条带扫描和分析TNF-α和MMP-9的表达。
1.4 统计学处理
2 结果
2.1 BBB通透性(通过检测EB含量)
结果表明,IR组及PJ34组内,随缺血再灌注时间延长,脑内EB含量逐渐增多,48 h达高峰;与sham组比较,IR组脑内EB含量明显增多(P<0.01),48 h时间点增加最多(P<0.01);与IR组比较,PJ34组的脑内EB含量明显减少,以48 h时间点减少幅度最大(P<0.05)。见表1。
2.2 免疫组化染色检测各组大鼠TNF-α和MMP-9蛋白分布与表达
2.2.1 TNF-α免疫组化染色:TNF-α阳性表达为缺血侧皮层细胞质棕黄色着色(图1)。与sham组比较,IR组和PJ34组TNF-α表达增加,24 h时间点增加到最多(P<0.01);与IR组比较,PJ34组TNF-α表达减少(P<0.05)。见表1。
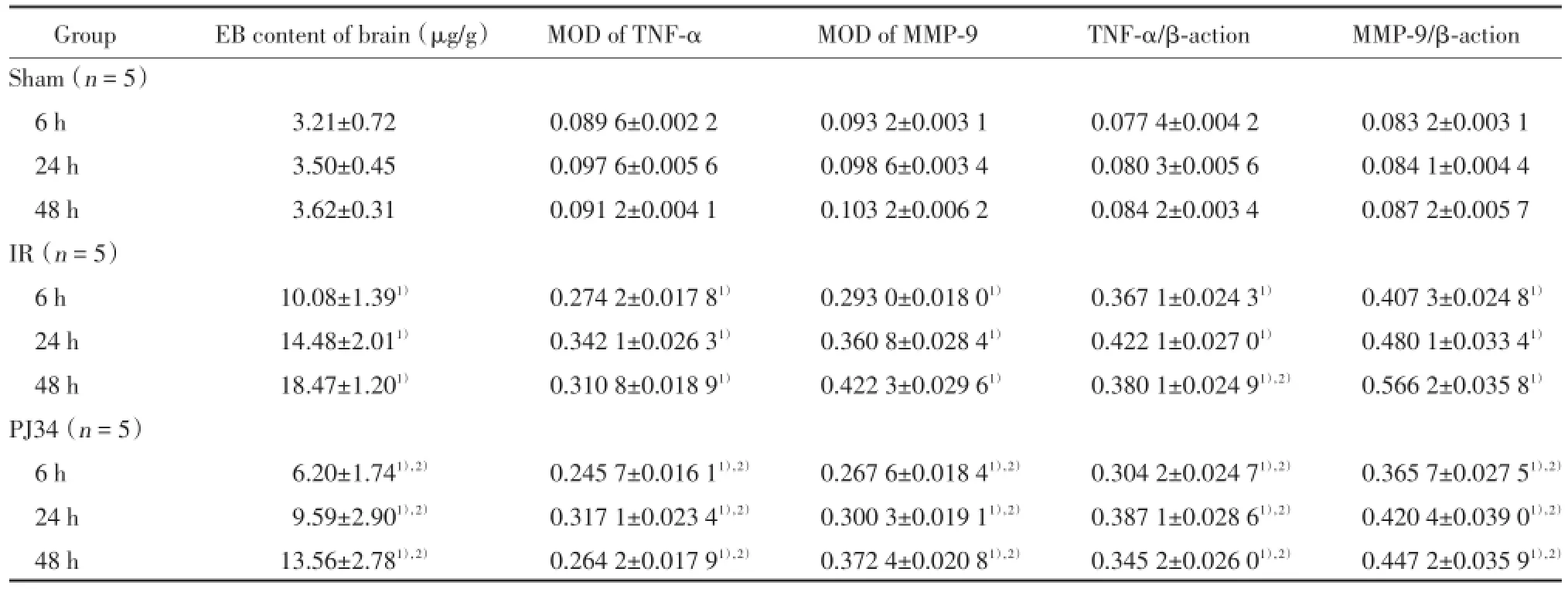
表1 各组大鼠EB含量、缺血侧皮层MMP-9和TNF-α MOD值及蛋白相对表达量比较Tab.1 Comparison of the EB content of brain,the MOD values and the relative protein expression of TNF-α and MMP-9 in the ischemic cortex of rats
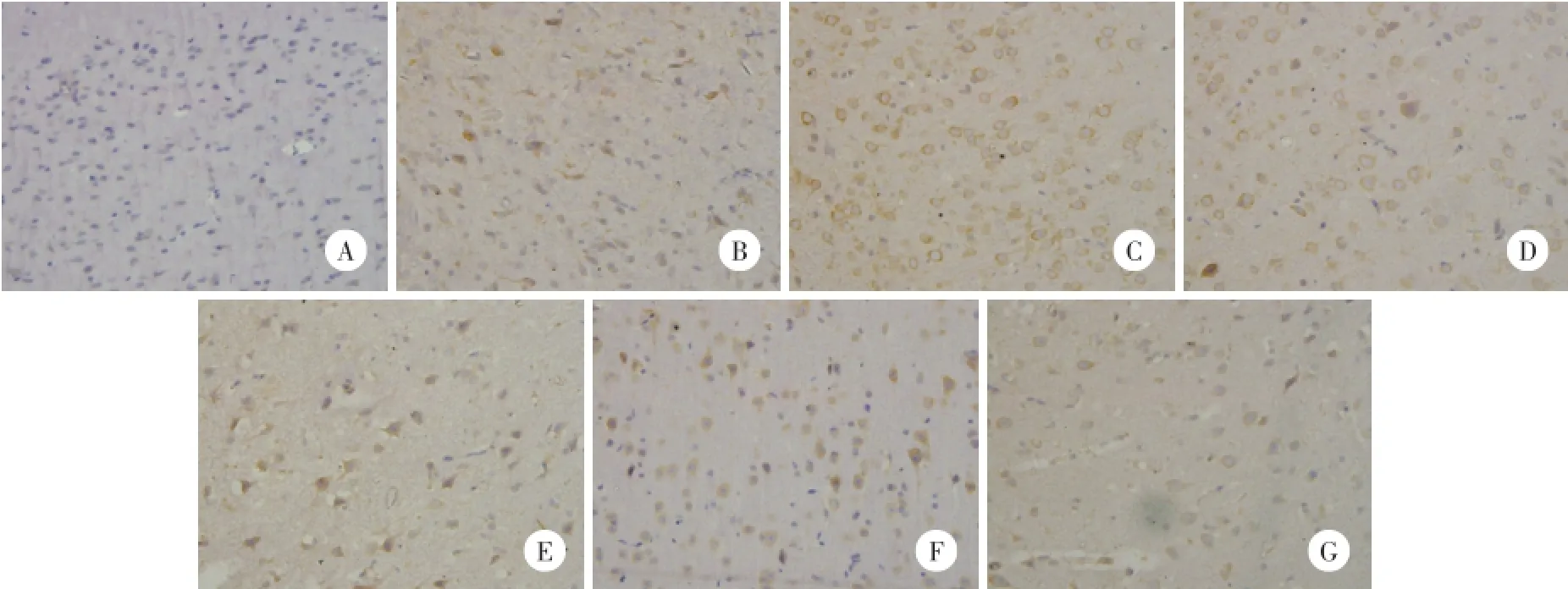
图1 免疫组化法检测缺血再灌注皮层TNF-α的表达与分布 ×400Fig.1 Immunohistochemical staining showing the expression of TNF-α in the ischemia-reperfusion cortical of rats×400
2.2.2 MMP-9免疫组化染色:MMP-9阳性表达为缺血侧皮层细胞质棕黄色着色(图2)。与sham组比较,IR组和PJ34组MMP-9表达增加,并随时间呈递增趋势,48 h时间点达高峰(P<0.01);与IR组比较,PJ34组MMP-9表达减少(P<0.05)。见表1。
2.3 Western bolt检测各组大鼠缺血侧皮层TNF-α和MMP-9蛋白含量
2.3.1 TNF-α蛋白含量:与sham组比较,IR组和PJ34组TNF-α蛋白表达量增加,24 h时间点增加最多(P<0.01);与IR组比较,PJ34组TNF-α蛋白表达量减少(P<0.05)。见表1、图3。
2.3.2 MMP-9蛋白含量:与sham组比较,IR组及PJ34组MMP-9蛋白表达量增加,并随时间呈递增趋势,48 h时间点增加最多(P<0.01);与IR组比较,PJ34组MMP-9蛋白表达量减少(P<0.05)。见表1、图3。
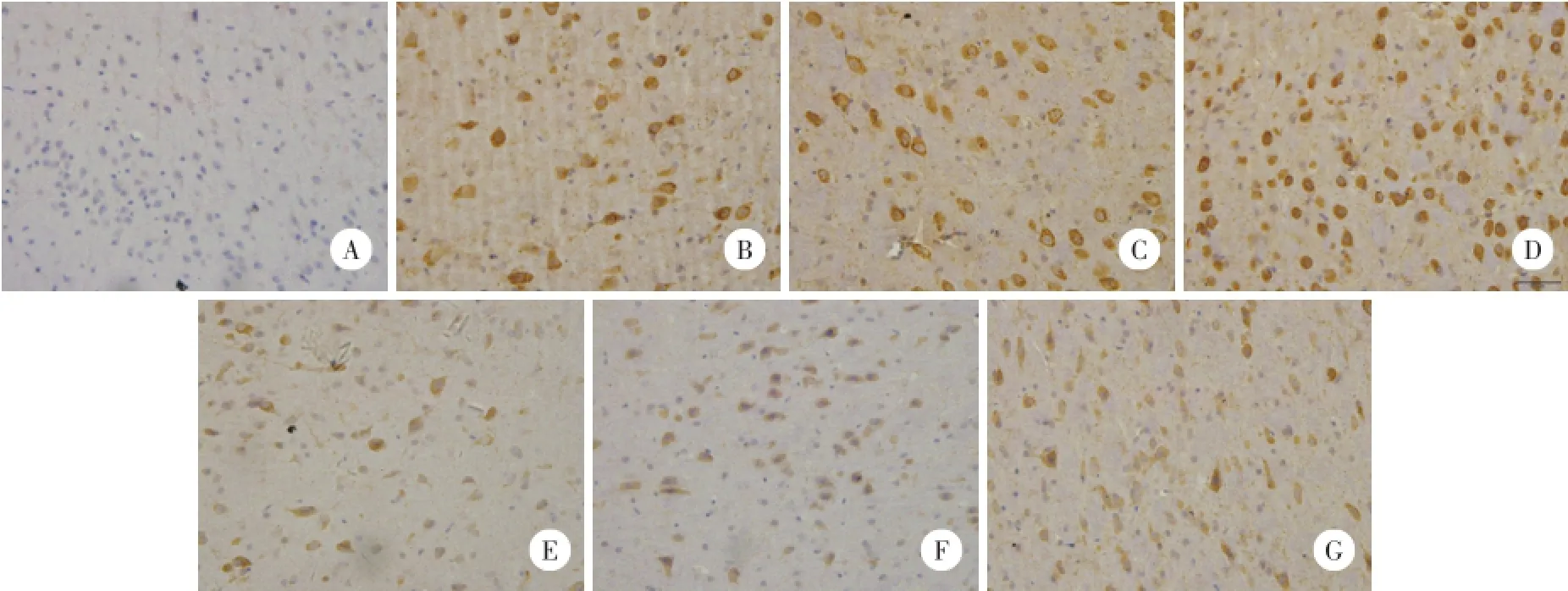
图2 免疫组化法检测缺血再灌注皮层MMP-9的表达与分布 ×400Fig.2 Immunohistochemical staining showing the expression of MMP-9 in the ischemia-reperfusion cortical of rats×400

图3 Western blot法检测大鼠脑缺血再灌注皮层TNF-α和MMP-9蛋白的表达水平Fig.3 Western blot analysis of the TNF-α and MMP-9 protein expression in the ischemia-reperfusion cortical of rats
3 讨论
PARP是一类单体蛋白酶,与多种疾病的发生发展有关。既往动物实验表明,PARP抑制剂PJ34能抑制缺血后诱导的小胶质细胞的激活[5],减少炎性因子TNF-α、白细胞介素6表达[6],发挥脑保护作用。而缺血后炎性因子的过度表达,能加重BBB通透性,后者又可进一步增加血液中白细胞入侵脑组织,加重炎性反应,形成恶性循环[7]。Wu等[8]利用帕金森模型,研究表明应用PARP抑制剂3-AB能减少TNF-α、白细胞介素1β的表达,增加紧密连接蛋白claudin-5、occludin和ZO-1的表达,降低BBB的通透性。本研究制备大鼠脑缺血再灌注模型后,脑内TNF-α表达迅速增加,BBB通透性显著提高,应用PJ34干预后TNF-α表达下降,BBB通透性减少,提示PJ34通过调节TNF-α的表达,影响BBB。
在本研究中,TNF-α表达高峰在缺血再灌注24 h,而BBB通透性高峰在缺血再灌注48 h或48 h之后,二者达峰时间不一致,推测TNF-α间接影响BBB。为进一步检测PJ34对BBB的影响,本研究选择MMP-9作为检测指标。有研究表明,MMP-9是降解细胞外基质成分的重要蛋白水解酶,而细胞外基质是维持BBB完整性的重要结构,因此调控MMP-9对脑缺血再灌注损伤后BBB通透性改变至关重要[9]。MMP-9的生物活性受基因转录、酶的活化等多种因素调控,既往在动物肠黏膜炎的模型研究中表明,TNF-α是MMP-9的重要的诱导因子,能在转录水平促进MMP-9的表达[10]。Lescot等[11]应用外伤性脑损伤大鼠模型研究PARP-1参与外伤后BBB通透性的改变,发现PAPR-1抑制剂3-AB能下调MMP-9的表达,减轻外伤后血脑屏障通透性。本研究证实在脑缺血再灌注损伤早期(48 h内),MMP-9的表达上调,BBB通透性也增加,且MMP-9的活性与BBB开放程度趋势相一致,推测MMP-9直接参与脑缺血再灌注后BBB的破坏,这与已往的研究结果一致[12],且其表达高峰在TNF-α之后,提示在脑缺血再灌注损伤模型中,TNF-α同样是MMP-9的诱导因子。应用PJ34干预后,脑内TNF-α和MMP-9的表达都降低,推测PJ34通过调控TNF-α影响MMP-9的活性。
综上所述,在脑缺血再灌注后应用PJ34干预后,抑制炎性因子TNF-α的表达,TNF-α的表达下降诱导MMP-9的活性降低,从而减少对细胞外基质成分的分解,降低BBB通透性,对脑再灌注损伤产生保护作用。PARP抑制剂的临床应用将为脑缺血再灌注损伤的治疗提供一个新思路。
参考文献:
[1]Yang Y,Rosenberg GA.Blood-brain barrier breakdown in acute and chronic cerebrovascular disease[J].Stroke,2011,42(11):3323-3328.
[2]Cozzi A,Cipriani G,Fossati S,et al.Poly(ADP-ribose)accumulation and enhancement of postischemic brain damage in 110-kDa poly(ADP-ribose)glycolhydrolase null mice[J].J Cereb Blood Flow Metab,2006,26(5):684-695.
[3]Hamby AM,Suh SW,Kauppinen TM,et al.Use of a poly(ADP-ribose)polymerase inhibitor to suppress inflammation and neuronal death after cerebral ischemia-reperfusion[J].Stroke,2007,38(2 Suppl):632-636.
[4]Haddad M,Beray-Berthat V,Coqueran B,et al.Reduction of hemorrhagic transformation by PJ34,a poly(ADP-ribose)polymerase inhibitor,after permanent focal cerebral ischemia in mice[J].Eur J Pharmacol,2008,588(1):52-57.
[5]Wang J,Yang Z,Liu C,et al.Activated microglia provide a neuroprotective role by balancing glial cell-line derived neurotrophic factor and tumor necrosis factor-α secretion after subacute cerebral ischemia[J].Int J Mol Med,2013,31(1):172-178.
[6]Haddad M,Rhinn H,Bloquel C,et al.Anti-inflammatory effects of PJ34,a poly(ADP-ribose)polymerase inhibitor,in transient focal cerebral ischemia in mice[J].Br J Pharmacol,2006,149(1):23-30.
[7]Kelly MA,Shuail A,Todd KG.Matrix metalloproteinase activation and blood-brain barrier breakdown following thrombolysis[J].Exp Neurol,2006,200(1):38-49.
[8]Wu XL,Wang P,Liu YH,et al.Effects of Poly(ADP-ribose)polymerase inhibitor 3-aminobenzamide on blood-brain barrier and dopaminergic neurons of rats with lipopolysaccharide-induced parkinson’s disease[J].J Mol Neurosci,2014,53(1):1-9.
[9]Piao MS,Lee JK,Park CS,et al.Early activation of matrix metalloproteinase-9 is associated with blood-brain barrier disruption after photothrombotic cerebral ischemia in rats[J].Acta Neurochir,2009,151(12):1649-1653.
[10]de Araújo RF Jr,Reinaldo MP,Brito GA,et al.Olmesartan decreased levels of IL-1β and TNF-α,down-regulated MMP-2,MMP-9,COX-2,RANK/RANKL and up-regulated SOCs-1 in an intestinal mucositis model[J].PLoS One,2014,9(12):e114923.
[11]Lescot T,Fulla-Oller L,Palmier B,et al.Effect of acute poly(ADP-ribose)polymerase inhibition by 3-AB on blood-brain barrier permeability and edema formation after focal traumatic brain injury in rats[J].J Neurotrauma,2010,27(6):1069-1079.
[12]Kelly MA,Shuail A,Todd KG.Matrix metalloproteinase activation and blood-brain barrier breakdown following thrombolysis[J].Exp Neurol,2006,200(1):38-49.
(编辑 陈 姜)
Influence of Poly(ADP-ribose)Polymerase Inhibitor PJ34 on Blood Brain Barrier in Ratswith CerebralIschemia-reperfusion Injury
LIYan1,WUPeng-lian2,DU Liang-he2,FU Xin-hui2,WANG Dong-yu1
(1.DepartmentofNeurology,Jinzhou CentralHospital,Jinzhou 121000,China;2.Graduate School,Liaoning MedicalUniversity,Jinzhou 121001,China)
Objective To investigate the influence ofpoly(ADP-ribose)polymerase inhibitorPJ34 on blood brain barrier(BBB)in rats with cerebral ischemia-reperfusion injury.MethodsRat model of cerebral ischemia-reperfusion injury was established by the middle cerebral artery occlusion.A total of 135 SD rats were randomly divided into 3 groups:sham-operated group(sham group),ischemia-reperfusion group(IR group)and PJ34 group(PJ34 group).45 animalsin each group were then equally divided into subgroups and the rats were sacrificed at6 h,24 h,48 h afterreperfusion,respectively.BBB permeability was evaluated by detection of extravasated Evans blue(EB).The expression of tumor necrosis factor α(TNF-α)and matrix metalloproteinase 9(MMP-9)activity were measured by immunohistochemistry and Western blotatdifferenttime points.ResultsCompared with sham group,the contents of EB and the expressions of TNF-α and MMP-9 in IR group were increased significantly(P<0.05).Compared with IR group,the contents of EB and the expressions of TNF-α and MMP-9 in PJ34 group were markedly decreased at the same time point(P<0.05).ConclusionThe presentstudy provided in vivo evidence thatPARPinhibitor PJ34 can protectagainstcerebralischemia reperfusion injury,and the mechanism might be related to maintaining the stability of blood-brain barrier by suppressing the expression of TNF-α and MMP-9 in ischemic cortex.
ischemia-reperfusion;blood brain barrier;poly(ADP-ribose)polymerase-1;PJ34;tumor necrosis factor α;matrix metalloproteinase 9
R743.3
A
0258-4646(2015)08-0709-05
辽宁省自然科学基金(201102074)
李岩(1980-),女,主治医师,硕士.
王东玉,E-mail:1448219167@qq.com
2015-02-28
网络出版时间:

