FAK及pAKT在乳腺癌中的表达及预后分析
徐璐,石晶,张凌云,时莎,曲晶磊,李智,侯科佐,曲秀娟,滕月娥
(中国医科大学附属第一医院肿瘤内科,沈阳 110001)
·论著·
FAK及pAKT在乳腺癌中的表达及预后分析
徐璐,石晶,张凌云,时莎,曲晶磊,李智,侯科佐,曲秀娟,滕月娥
(中国医科大学附属第一医院肿瘤内科,沈阳 110001)
目的探讨黏着斑激酶(FAK)及磷酸化的丝氨酸/苏氨酸蛋白激酶(p-AKT)在乳腺癌组织中的表达情况及临床价值。方法收集从1997至2008年于我院行乳腺癌根治手术的271例有完整存档蜡块标本,采用组织微阵列芯片和免疫组化SP法检测FAK和p-AKT在乳腺癌组织中的表达,并对两者的表达情况及其与乳腺癌临床病理因素和患者生存情况的关系进行分析。结果FAK、p-AKT的高表达率分别为53.9%(146/271)、36.2%(98/271),两者的表达水平呈正相关(r=0.397,P<0.01)。FAK/pAKT同时均高表达的比率为29.2%(79/271)。FAK高表达与孕激素受体(PR)呈负相关(P=0.046),pAKT高表达与组织学分级(P=0.024)、淋巴结转移(P=0.016)呈正相关,FAK与pAKT共同高表达的患者更倾向于出现淋巴结转移、骨/软组织转移(P=0.019,P=0.022)。FAK高表达人群中,p-AKT高表达者的总生存期(OS)明显短于低表达者(P=0.047)。单独分析FAK及p-AKT表达与总体人群预后无关,将两者联合分析后,FAK/pAKT均高表达患者的OS明显缩短(P=0.027)。亚组分析显示:HER2阳性患者,FAK/pAKT高表达者的OS缩短(P=0.015),FAK/pAKT高表达是HER2阳性乳腺癌的独立预后因素(HR= 3.352,P=0.021)。结论在乳腺癌组织中FAK和p-AKT两者密切相关,FAK/pAKT联合检测能够预测乳腺癌患者的预后,并能够成为HER2阳性乳腺癌的独立预后指标。
乳腺癌;黏着斑激酶;磷酸化丝氨酸/苏氨酸蛋白激酶;预后
乳腺癌是女性最常见的恶性肿瘤。世界卫生组织公布的数据表明,在2012年乳腺癌已造成522 000人死亡[1]。随着对乳腺癌基因表达谱认识的逐渐深入,乳腺癌患者的个体化治疗和预后预测也在不断完善[2]。目前除ER、PR、HER-2、Ki67等指标外,尚未发现其他更好指标能够预测乳腺癌患者的预后,所以探索新的乳腺癌分子标志物将有助于更深入的解释乳腺癌的临床生物学行为并为其治疗提供新的靶点。黏着斑激酶(focal adhesion kinase,FAK)是蛋白质分子量为125 kDa的非受体酪氨酸激酶,是整合素重要的下游信号分子[3,4],参与包括细胞增殖、侵袭转移、血管生成、上皮细胞间充质转化等几乎所有与肿瘤发生发展相关的过程[5]。目前的研究发现,FAK在大肠癌、前列腺癌、乳腺癌、卵巢癌和甲状腺癌等多种肿瘤组织中蛋白水平或RNA水平处于高表达状态,通过抑制其表达或功能可抑制肿瘤的恶性表型[6]。既往研究对FAK蛋白的表达是否能够预测乳腺癌患者预后结论不一,目前FAK蛋白表达还不能作为一个成熟的生物学指标预测乳腺癌患者的预后。磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)是FAK的下游信号通路,共同参与肿瘤发生发展和侵袭转移的调控[7],但目前FAK和其下游的pAKT在乳腺癌中联合表达的意义和预后价值尚不清楚。本研究利用免疫组织化学方法检测FAK联合pAKT在271例乳腺癌组织中的表达,并分析其与乳腺癌临床病理因素及预后的关系。
1 材料与方法
1.1 材料
1.1.1 临床资料:收集1997至2008年期间于中国医科大学附属第一医院行乳腺癌根治手术且有完整存档的蜡块标本271例,委托上海芯超生物科技有限公司制备组织微阵列芯片。所有病例术后病理学诊断均为浸润性导管癌。入选病例均为女性,年龄26~76岁。所有患者术前均未接受任何化疗和放疗,且术后均在肿瘤内科接受蒽环或紫杉类药物辅助化疗,激素受体阳性患者接受辅助内分泌治疗,T2~T3/N1~N2行辅助放疗,无应用曲妥珠单抗辅助治疗的患者。所有患者随访资料完整。依据美国癌症联合委员会(AJCC)2007年标准进行TNM分期,Ⅰ期患者52例(19.2%),Ⅱ期患者157例(57.9%),Ⅲ期患者61例(22.9%)。随访时间截止至2014年8月31日。从手术日期至复发转移日期或末次随访截止日期定义为患者的无进展生存期(progression free survival,DFS),从病理诊断乳腺癌日期至死亡日期或末次随访截止日期定义为患者的总生存期(overall survival,OS)。全部患者的DFS为6.6~169.4个月,OS为11.7~175.5个月,中位随访时间为99.1个月。
1.1.2 主要试剂:兔抗人FAK及p-AKT多克隆抗体(工作浓度分别为1∶200和1∶250)购自SANTA CRUZ公司;免疫组化SP试剂盒、DAB试剂盒及柠檬酸修复液(100倍)、生物素标记的羊抗鼠/兔IgG(二抗)均购自福州迈新生物技术开发有限公司;蒸馏水、无水乙醇、二甲苯、0.01 mol/L磷酸盐缓冲液、苏木素、中性树脂等均为国产试剂。
1.2 方法
采用SP免疫组化法。实验步骤严格按照说明书进行操作。用已知阳性对照片作为阳性对照,PBS代替一抗作为阴性对照。
结果判定:FAK和pAKT均以胞膜和(或)胞质见浅黄色至棕褐色颗粒为阳性染色。结果判定采用双盲法,由2位病理科医师对染色结果复阅核定。依照阳性细胞比例评分:1分,1%~≤10%;2分,>10%~≤33%;3,>33%~≤66%;4分,>66%~≤100%。依照显色强度评分:未着色、浅黄色、棕黄色、棕褐色分别判定为0、1、2、3分。将2项得分相加,得到最终得分,0~3分为低表达,4~7分为高表达。
1.3 统计学分析
应用SPSS 16.0软件进行统计学分析。不同组间比较用χ2检验及Fisher确切概率法,生存率的比较采用Kaplan-Meier法,组间比较采用Log-rank检验,采用Cox比例风险回归分析进行预后因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 FAK和pAKT在浸润性乳腺癌组织中的表达
免疫组化染色结果显示:271例乳腺癌组织中,FAK蛋白的高表达率为53.9%(146/271),pAKT的高表达率为36.2%(98/271),两者的表达呈正相关(r=0.397,P<0.01),FAK和pAKT均高表达的比率为29.2%(79/271)。见图1、2。
2.2 FAK与pAKT联合检测分析及其与乳腺癌临床病理因素的关系
FAK蛋白表达与孕激素受体(progesterone receptor,PR)呈负相关(P=0.046),与患者的年龄、组织学分级、肿瘤大小、淋巴结转移、临床分期、雌激素受体(estrogen receptor,ER)状态、HER-2状态无显著相关(表l)。pAKT高表达与组织学分级(P= 0.024)、淋巴结转移呈正相关(P=0.016),与其他指标无显著相关(表l)。FAK与pAKT共同高表达的患者更倾向于出现淋巴结转移、骨/软组织转移(P= 0.019,P=0.022)。
2.3 FAK及pAKT表达与乳腺癌预后的关系
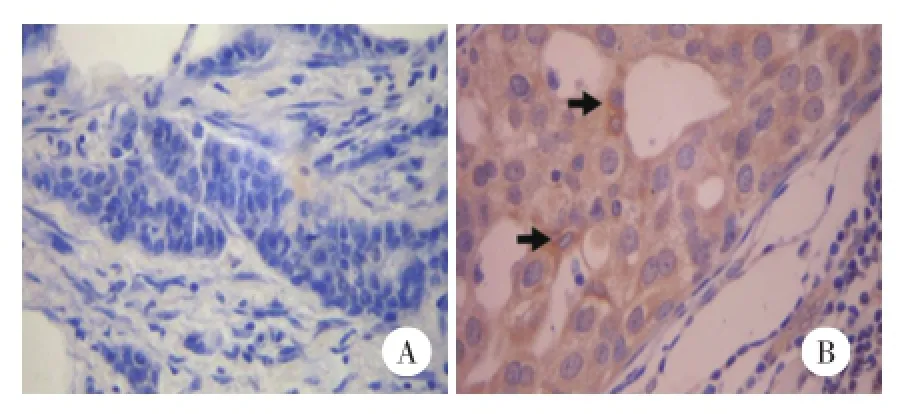
图1 免疫组化方法检测乳腺癌中FAK蛋白的表达 ×400Fig.1 Immunohistochemistry staining of FAK protein in breast cancer×400

图2 免疫组化方法检测乳腺癌中pAKT蛋白的表达 ×400Fig.2 Immunohistochemistry staining of pAKT protein in breast cancer×400
在271例乳腺癌患者中,删除术后辅助化疗未满4个周期的患者,剩余221例患者进行生存分析。Kaplan-Meier法的分析结果显示,FAK蛋白表达与乳腺癌患者预后的DFS(P=0.569)及OS(P= 0.366)无关。FAK高表达患者,pAKT高表达者生存期明显短于低表达者(P=0.047),见图3。FAK/ pAKT均高表达者OS显著缩短(P=0.027),见图4。HER-2阳性亚组分析中,FAK/pAKT高表达者的OS缩短(P=0.015),见图5。
2.4 乳腺癌复发及死亡的单因素及多因素分析
2.4.1 乳腺癌复发的单因素及多因素分析:对乳腺癌患者复发的Cox比例风险回归模型分析结果显示,对患者复发有显著影响的因素为TNM分期(P<0.01)、淋巴结转移(P=0.007)、HER-2状态(P= 0.017),而诊断时年龄、肿瘤大小、病理组织学分级、HR状态、FAK、pAKT、FAK与pAKT联合表达对乳腺癌的复发均无显著影响。将单因素分析筛选出的因子纳入多因素COX风险模型中,发现只有TNM分期能够成为影响乳腺癌复发的独立危险预后因素(P=0.003,表2)。

表1 FAK和pAKT蛋白表达与乳腺癌临床病理因素的相关性分析Tab.1 Relationship between the expression of FAK and pAKT protein and clinical pathology of breast cancer

图3 FAK蛋白高表达患者pAKT表达的DFS和OS曲线Fig.3 DFS and OS curves of FAK positive breast cancer patients with pAKT expression

图4 FAK和pAKT蛋白联合表达的DFS和OS曲线Fig.4 DFS and OS curves of breast cancer patients with co-expression of FAK and pAKT
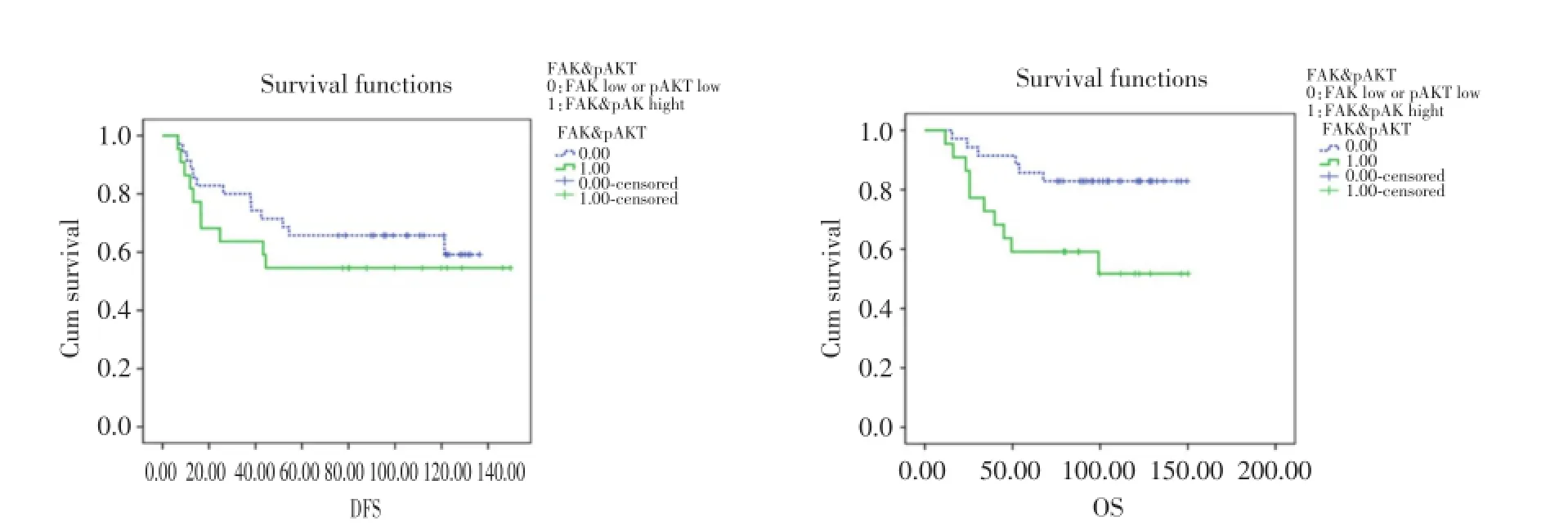
图5 HER2阳性亚组FAK和pAKT蛋白联合表达的DFS和OS曲线Fig.5 DFS and OS curves of HER2 positive breast cancer patients with co-expression of FAK and pAKT
2.4.2 乳腺癌死亡的单因素及多因素分析:单因素生存分析结果显示,对患者死亡有显著影响的因素为诊断时年龄(P=0.001)、TNM分期(P<0.01)、淋巴结转移(P=0.004)、HER-2状态(P=0.006)、FAK与pAKT联合表达(P=0.027),而肿瘤大小、病理组织学分级、HR状态、FAK、pAKT、对乳腺癌的死亡均无显著影响。将单因素分析筛选后纳入多因素COX风险模型中,发现发病年龄(P=0.001)、TNM分期(P=0.007)能够成为影响乳腺癌死亡的独立危险预后因素(表2)。
2.4.3 HER2亚组的乳腺癌复发及死亡的单因素及多因素分析:在HER2阳性亚组患者中,单因素分析显示诊断时年龄(P=0.012)、TNM分期(P=0.048)显著影响患者的DFS,且诊断时年龄(P=0.003)、TNM分期(P=0.017)是影响HER2阳性乳腺癌患者复发的独立危险预后因素。而诊断时年龄(P<0.01)、FAK联合pAKT表达(P=0.016)显著影响患者的OS,且诊断时年龄(P=0.002)、FAK联合pAKT(P=0.021)是HER2阳性亚组总生存的独立危险预后因素(表3)。
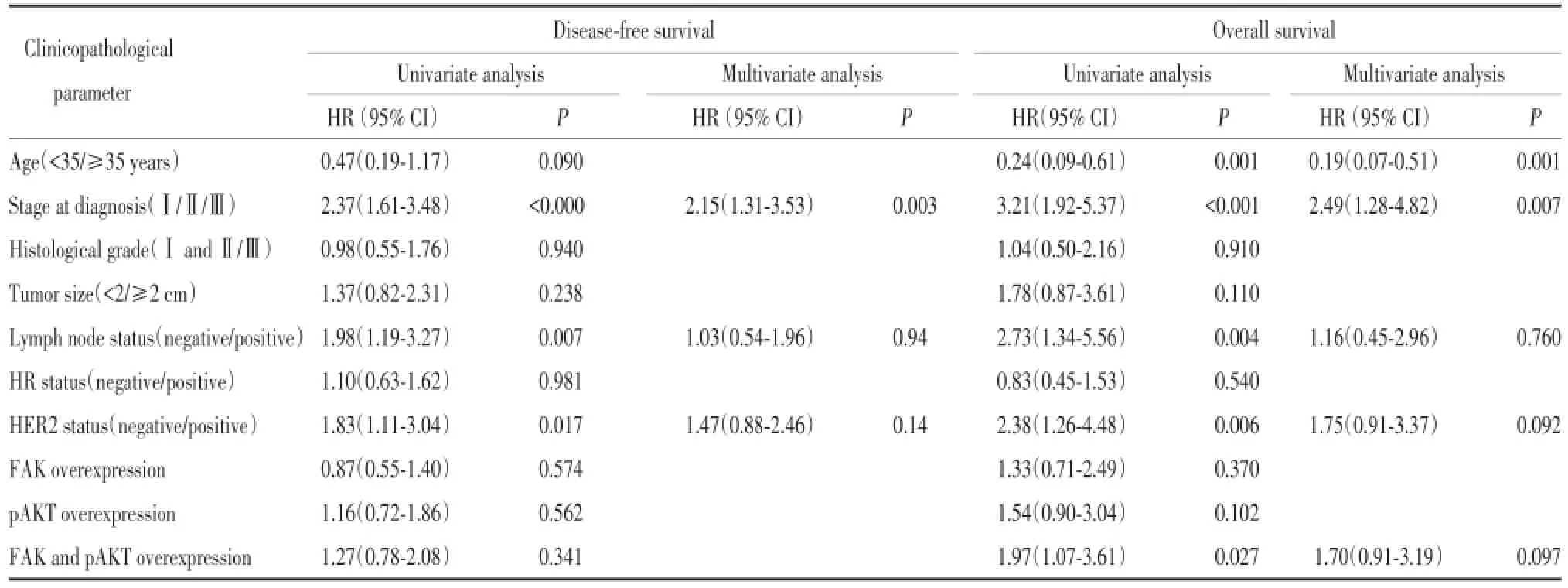
表2 乳腺癌复发及死亡的单因素和多因素分析Tab.2 Univariate and multivariate analysis of breast cancer for recurrence and mortality
3 讨论
聚集于细胞膜表面的FAK的活化是胞外信号向胞内传导的重要环节,参与包括整合素、生长因子受体和细胞因子受体等一系列细胞表面受体的下游信号传导[6],并在细胞的黏附、迁移、侵袭、转移、上皮-间质细胞转化(epithelial to mesenchymal transition,EMT)及血管生成方面发挥重要作用[8,9]。相比于正常乳腺组织,乳腺癌组织中FAK蛋白和mRNA均呈高表达,且与乳腺癌细胞高组织学分级、低分化、激素受体阴性及高Ki67指数等不良预后因素密切相关[10~13]。体外实验结果表明,抑制FAK的活性可以显著降低乳腺癌细胞侵袭和转移的能力[14,15]。但目前仍缺少充分的临床证据明确FAK蛋白表达与乳腺癌生存之间的关系。本研究结果显示,FAK蛋白表达不能影响患者预后,与既往的研究结论一致,但基础研究发现,激活FAK会加速细胞的恶性转化而非增强细胞的侵袭能力[16],因此有必要进一步研究FAK与乳腺癌之间的关系。

表3 HER2阳性乳腺癌复发及死亡的单因素和多因素分析Tab.3 Univariate and multivariate analysis of prognostic factors for the HER positive breast cancer patients
PI3K/AKT作为FAK的下游信号通路,参与调控肿瘤发生发展和侵袭转移[7]。Schmitz等[11]发现,在162例淋巴结阴性的乳腺癌患者中,FAK的高表达与pAKT呈正相关,这与本研究结果相一致,为FAK与pAkt的联合检测提供了依据。本研究结果还发现,虽然FAK和pAKT高表达与临床分期、组织分级、淋巴结转移及激素受体状态等临床特征均不相关,但FAK与pAKT共同高表达的患者更倾向于出现淋巴结转移、骨/软组织转移,并且OS显著缩短,提示FAK与AKT在促进肿瘤侵袭转移方面发挥协同作用,具有二者共同高表达的乳腺癌患者预后不良。既往研究证实,FAK在HER2信号传导通路中发挥重要的作用[17],并可能与乳腺癌的曲妥珠单抗耐药相关[18,19],抑制FAK的活性,能够增加乳腺癌细胞系ER+/HER2+(BT-474 and MDAMB361)对曲妥珠单抗的敏感性[14],说明FAK与HER2介导的乳腺癌密切相关。进一步在HER2阳性患者中进行生存分析,结果发现FAK/pAKT均高表达患者OS明显缩短,并与诊断时年龄共同成为HER2阳性亚组总生存的独立危险预后因素,进一步从临床上证实HER2可能是通过FAK/PI3K/AKT通路影响乳腺癌患者预后。虽然本研究为回顾性研究,具有一定的局限性,同时,组织芯片不能代表整个组织表达情况,可能因为肿瘤异质性等原因存在误差,但本研究结果提示这2种蛋白的共同高表达,而非单独FAK蛋白高表达,可能在未来成为判定乳腺癌不良预后的重要指标,二者的联合检测对预测乳腺癌患者的生存更有价值。阻断FAK和AKT的相互作用也可以成为预防乳腺癌转移的新靶点,为HER2阳性乳腺癌患者的治疗提供新的手段。
[1]The International Agency for Research on Cancer(IARC).GLOBOCAN 2012:estimated cancer incidence,mortality and prevalence worldewide in 2012[R/OL].(2014-06-20)[2015-06-10].http:// globocan.iarc.fr/Pages/fact_sheets_cancer.aspx.
[2]Wirapati P,Sotiriou C,Kunkel S,et al.Meta-analysis of gene expression profiles in breast cancer:toward a unified understanding of breast cancer subtyping and prognosis signatures[J].Breast Cancer Res,2008,10(4):R65.
[3]Schaller MD,Borgman CA,Cobb BS,et al.pp125FAK a structurally distinctive protein-tyrosine kinase associated with focal adhesions[J].Proc Natl Acad Sci USA,1992,89(11):5192-5196.
[4]Schaller MD.Cellular functions of FAK kinases:insight into molecular mechanisms and novel functions[J].J Cell Sci,2010,123(Pt7):1007-1013.
[5]Golubovskaya VM.Targeting FAK in human cancer:from finding to first clinical trials[J].Front Biosci(Landmark Ed),2014,19:687-706.
[6]Parsons JT.Focal adhesion kinase:the first ten years[J].J Cell Sci,2003,116(Pt8):1409-1416.
[7]Thamilselvan V,Craig DH,Basson MD.FAK association with multiple signal proteins mediates pressure-induced colon cancer cell adhesion via a Src-dependent PI3K/Akt pathway[J].FASEB J,2007, 21(8):1730-1741.
[8]Hsia DA,Mitra SK,Hauck CR,et al.Differential regulation of cell motility and invasion by FAK[J].J Cell Biol,2003,160(5):753-767.
[9]Fan H,Zhao X,Sun S,et al.Function of focal adhesion kinase scaffolding to mediate endophilin A2 phosphorylation promotes epithelial-mesenchymal transition and mammary cancer stem cell activities in vivo[J].J Biol Chem,2013,288(5):3322-3333.
[10]Owens LV,Xu L,Craven RJ,et al.Overexpression of the focal adhesion kinase(p125FAK)in invasive human tumors[J].Cancer Res,1995,55(13):2752-2755.
[11]Schmitz KJ,Grabellus F,Callies R,et al.High expression of focal adhesion kinase(p125FAK)in node-negative breast cancer is related to overexpression of HER-2/neu and activated Akt kinase but does not predict outcome[J].Breast Cancer Res,2005,7(2):R194-203.
[12]Yom CK,Noh DY,Kim WH,et al.Clinical significance of high focal adhesion kinase gene copy number and overexpression in invasive breast cancer[J].Breast Cancer Res Treat,2011,128(3):647-655.
[13]Alexopoulou AN,Ho-Yen CM,Papalazarou V,et al.Tumour-associated endothelial-FAK correlated with molecular sub-type and prognostic factors in invasive breast cancer[J].BMC Cancer,2014,14:237.
[14]Lazaro G,Smith C,Goddard L,et al.Targeting focal adhesion kinase in ER+/HER2+breast cancer improves trastuzumab response[J].Endocr Relat Cancer,2013,20(5):691-704.
[15]Hiscox S,Barnfather P,Hayes E,et al.Inhibition of focal adhesion kinase suppresses the adverse phenotype of endocrine-resistant breast cancer cells and improves endocrine response in endocrinesensitive cells[J].Breast Cancer Res Treat,2011,125(3):659-669.
[16]Madan R,Smolkin MB,Cocker R,et al.Focal adhesion proteins as markers of malignant transformation and prognostic indicators in breast carcinoma[J].Hum Pathol,2006,37(1):9-15.
[17]Nahta R.Pharmacological strategies to overcome HER2 cross-talk and Trastuzumab resistance[J].Curr Med Chem,2012,19(7):1065-1075.
[18]Wang SE,Xiang B,Zent R,et al.Transforming growth factor beta induces clustering of HER2 and integrins by activating Src-focal adhesion kinase and receptor association to the cytoskeleton[J]. Cancer Res,2009,69(2):475-482.
[19]Yang XH,Flores LM,Li Q,et al.Disruption of laminin-integrin-CD151-focal adhesion kinase axis sensitizes breast cancer cells to ErbB2 antagonists[J].Cancer Res,2010,70(6):2256-2263.
(编辑 王又冬)
Expression and ClinicalSignificance of FAKCombined with pAKTin BreastCancer
XULu,SHIJing,ZHANGLing-yun,SHISha,QUJing-lei,LIZhi,HOU Ke-zuo,QUXiu-juan,TENG Yue-e
(DepartmentofOncology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
Objective To explore the expression prognostic value of FAK combined with pAKT in breast cancer patients.MethodsData from a cohortof271 invasive breastcancerpatients underwentradicaloperation in The FirstHospital,China MedicalUniversity from 1997 to 2008,wascollected.FAK and pAKTwas validated by IHCin tissue microarrays and statistically assessed forrelationship with clinicopathologicalfactorsand prognosis.ResultsThe high expression rate ofFAK was 53.9%(146/271),and pAKTwas 36.2%(98/271)in breastcancertissues.There was positive correlation between FAK and pAKT(r=0.397,P<0.01).High expression of FAK was related to PR state(P=0.046),high expression of pAKT was related to histological grade(P=0.024)and lymph node metastasis(P=0.016),and high co-expression of FAK and pAKT was related to lymph node metastasis(P=0.019)and bone/soft tissue metastasis(P=0.022).High expression of FAK,lower expression of pAKT has better prognosis than its higher expression.There was no significant difference of the disease-free survival(DFS)or overall survival(OS)between breast cancer patients with/without FAK or pAKT expression.High expression of FAK/pAKT showed worse OS(P=0.027)in whole patient.HER2 positive subgroup analysis showed thatFAK/pAKTnegative patients hassignificantly betterOS than positive group(P=0.015),and multivariate Cox proportional hazard regression analysis showed that FAK/pAKT is mortality of independent prognostic factor(HR=3.352,P=0.021).ConclusionThere was closely relationship between FAK and pAKT.High co-expression of FAK and pAKT can predict OS of breast cancer patients,which can be used as the mortality ofindependentprognostic factorofHER2 positive breastcancerpatients.
breast cancer;FAK;p-AKT;prognosis
R737.9
A
0258-4646(2015)08-0673-06
国家自然科学基金(81172535)
徐璐(1985-),女,医师,博士研究生.
滕月娥,E-mail:tengyuee0517@163.com
2015-06-04
网络出版时间:

