低剂量静脉注射米诺环素后处理对大鼠缺血再灌注心肌的保护作用
张利群,陈咏君,崔仁善,齐国先
(1.沈阳医学院护理学院人文教研室,沈阳 110034;2.沈阳医学院沈洲医院检验科,沈阳 110002;3.中国医科大学附属第一医院心内科,沈阳 110001)
·论著·
低剂量静脉注射米诺环素后处理对大鼠缺血再灌注心肌的保护作用
张利群1,陈咏君2,崔仁善1,齐国先3
(1.沈阳医学院护理学院人文教研室,沈阳 110034;2.沈阳医学院沈洲医院检验科,沈阳 110002;3.中国医科大学附属第一医院心内科,沈阳 110001)
目的探讨低剂量静脉注射米诺环素后处理对大鼠心肌缺血再灌注损伤的保护作用及可能机制。方法48只雄性Wistar大鼠随机均分为假手术组(SO组)、缺血再灌注组(IR组)、低剂量米诺环素组(3 mg/kg,IR+LM组)和高剂量米诺环素组(10 mg/kg,IR+HM组)。通过结扎大鼠左冠状动脉前降支45 min,复灌120 min,建立心肌缺血再灌注损伤模型。再灌注后,检测各组大鼠心脏血流动力学、血清肌酸激酶MB型(CK-MB)和心肌肌钙蛋白Ⅰ(cTn-Ⅰ)的水平、血清及缺血心肌丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性、心肌凋亡指数(AI)以及HE染色,观察心肌病理改变。结果与IR组比较,低、高剂量米诺环素均能降低左心室舒张末压、CK-MB、cTn-Ⅰ、AI以及MDA含量,升高左心室收缩压、左心室变化速率最大值及SOD活性(P均<0.05)。IR+HM组与IR+LM组比较上述指标差异均无统计学意义(P>0.05)。结论低剂量米诺环素后处理减轻大鼠心肌缺血再灌注损伤,其机制与清除氧自由基、抑制脂质氧化反应和抑制凋亡有关。
米诺环素;缺血后处理;心肌缺血再灌注损伤
近年发现米诺环素(minocycline,M)对缺血心肌细胞具有保护作用,研究中米诺环素多采用预处理与腹腔注射,应用剂量是临床用于抗感染、抗炎常规剂量的30倍[1,2]。目前尚不清楚相当于人类安全应用的较低剂量米诺环素静脉注射是否仍具有心肌保护作用。本研究首次采用低剂量米诺环素(3 mg/kg),相当于临床应用标准剂量200 mg的给药剂量[3],观察其后处理对缺血再灌注(ischemia-reperfusion,IR)心肌的作用,探讨其对氧化应激的影响,为米诺环素防治心肌再灌注损伤的可行性和临床转化提供理论依据。
1 材料与方法
1.1 实验动物及分组
雄性Wistar大鼠48只,体质量250~280 g,由中国医科大学实验动物中心提供,生产许可证号SCXK(辽)2008-0005。随机分为假手术(sham-operation,SO)组、缺血再灌注(IR)组、低剂量米诺环素后处理(IR+LM)组、高剂量米诺环素后处理(IR+ HM)组,每组各12只。(1)SO组:冠状动脉左前降支只穿线,不结扎,穿线后35 min由股静脉缓慢注入生理盐水(1 mL/100 g);(2)IR组:结扎冠状动脉左前降支45 min,再灌注120 min,再灌注前10 min由股静脉缓慢注入生理盐水(1 mL/100 g);(3)IR+LM组:再灌注前10 min由股静脉缓慢注入盐酸米诺环素(3 mg/kg,0.3 mg/mL生理盐水,1 mL米诺环素溶液/100 g);(4)IR+HM组:再灌注前10 min由股静脉注入盐酸米诺环素(10 mg/kg,1 mg/mL生理盐水,1 mL米诺环素溶液/100 g)。
1.2 试剂及仪器
盐酸米诺环素(美国sigma公司),大鼠心肌肌钙蛋白Ⅰ(cardiac troponin-Ⅰ,cTn-Ⅰ)酶联免疫检测试剂盒(北京尚柏生物医学技术有限公司),肌酸激酶MB型(creatine kinase MB,CK-MB)、丙二醛(malondialdehyde,MDA)、超氧化物歧化(superoxide dismutase,SOD)试剂盒(南京建成生物工程研究所),TUNEL试剂盒(南京凯基生物科技发展有限公司)。小动物呼吸机(HX-300,成都泰盟科技有限公司),八导生理记录仪(日本RM6000),石蜡切片机(德国LEICA公司),光学显微镜(日本OLYMPUS公司),酶标仪(MpltiskanMK3芬兰Thermo Lab System),全自动生化分析仪(Cobase501德国Roehe)。
1.3 指标与方法
1.3.1 血流动力学指标测定:再灌注120 min经右侧颈总动脉插管至左心室,连接至八导生理记录仪,记录心率(heart rate,HR)、左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末期压(left ventricular end diastolic pressure,LVEDP)、左心室变化速率最大值(±dp/dtmax)。
1.3.2 血清CK-MB和cTn-Ⅰ含量测定:再灌注120 min后收集右颈总动脉血4 mL,4℃下3 000 r/min,离心10 min,分离出血清,分别用全自动生化分析仪和ELISA法测血清CK-MB活性和cTn-Ⅰ含量。具体操作按试剂盒说明书进行。
1.3.3 心肌组织病理形态学的测定:再灌注结束,迅速留取左心室前壁心肌组织,于4%的多聚甲醛固定12 h,石蜡包埋,HE染色观察再灌注心肌组织的病理变化。
1.3.4 心肌凋亡细胞原位测定:应用TUNEL凋亡测试试剂盒严格按照试剂盒说明书操作。光镜下正常心肌细胞核呈蓝色,棕色为TUNEL染色阳性细胞,每张切片随机选取l0个视野(×400倍),计数凋亡阳性细胞,以凋亡细胞个数/所有细胞个数作为凋亡指数(apoptotic index,AI),AI反映各组心肌细胞凋亡的情况。
1.3.5 血清、心肌组织MDA含量及SOD活性测定:再灌注120 min颈动脉取血2 mL,静置后3 000 r/min,离心10 min分离出血清;取大鼠左心室结扎线以下心尖部缺血区心肌组织,每20 mg组织加入150 μL裂解液,与生理盐水混合后研磨匀浆,4℃15 000 g离心5 min,取上清液;硫代巴比妥酸法测定MDA含量,黄嘌呤氧化酶法测定超氧化物歧化酶SOD活性,根据说明书检测。
1.4 统计学分析
采用SPSS17.0统计软件进行分析,计量资料多组间比较采用单因素方差分析,多组间两两比较采用SNK法。P<0.05认为差异有统计学意义。
2 结果
2.1 米诺环素后处理对大鼠心脏血流动力学影响
与SO组比较,IR组HR、LVSP、±dp/dtmax指标均降低(P均<0.01),LVEDP升高(P<0.01);与IR组比较,IR+LM、IR+HM组显著升高LVSP和±dp/dtmax(P<0.05或P<0.01),降低LVEDP(P<0.05)。IR+HM组与IR+LM组比较有进一步改善趋势,但差异无统计学意义(P>0.05)。见表1。
2.2 米诺环素后处理对大鼠心肌组织病理形态学的影响
光镜下观察,SO组心肌细胞排列整齐,着色均匀,肌纤维横纹清晰,无细胞肿胀,未见变性坏死和炎性细胞浸润(图1A);IR组心肌肌纤维排列紊乱,着色不均匀,细胞肿胀明显,心肌细胞间隙水肿严重,肌纤维部分断裂,横纹模糊或消失,可见心肌细胞呈片状坏死,坏死区细胞核碎裂或崩解,周围有炎性细胞浸润,红细胞漏出明显(图1B);IR+LM组和IR+HM组心肌细胞排列基本规整,部分心肌细胞水肿变性,肌纤维间隙水肿,偶尔可见散在的红细胞,但明显少于IR组,少见炎性细胞浸润;与IR组比较心肌组织结构明显改善(图1C、1D)。
表1 米诺环素后处理对大鼠心脏血流动力学的影响()Tab.1 Effects of minocycline postconditioning on the cardiac parameters of haemodynamics in rats()
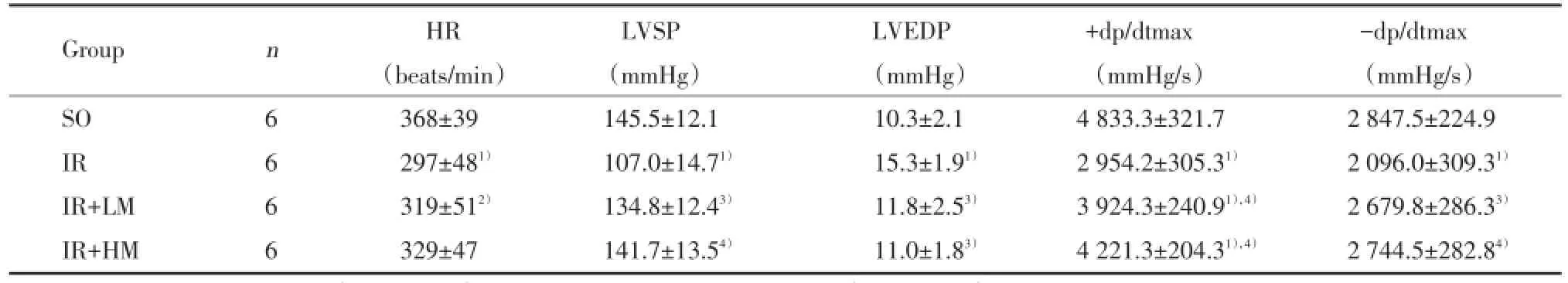
表1 米诺环素后处理对大鼠心脏血流动力学的影响()Tab.1 Effects of minocycline postconditioning on the cardiac parameters of haemodynamics in rats()
Compared with SO group,1)P<0.01,2)P<0.05;compared with I/R group,3)P<0.05,4)P<0.01.
Group n HR LVSP LVEDP +dp/dtmax -dp/dtmax(beats/min) (mmHg) (mmHg) (mmHg/s) (mmHg/s)SO 6 368±39 145.5±12.1 10.3±2.1 4 833.3±321.7 2 847.5±224.9 IR 6 297±481) 107.0±14.71) 15.3±1.91) 2 954.2±305.31) 2 096.0±309.31)IR+LM 6 319±512) 134.8±12.43) 11.8±2.53) 3 924.3±240.91),4) 2 679.8±286.33)IR+HM 6 329±47 141.7±13.54) 11.0±1.83) 4 221.3±204.31),4) 2 744.5±282.84)
2.3 米诺环素后处理对大鼠血清cTn-Ⅰ、CK-MB的影响
与SO组比较,IR组血清cTn-Ⅰ水平、CK-MB活性显著升高(P<0.01);与IR组比较,IR+LM组和IR+HM组能显著降低血清cTn-Ⅰ水平和CKMB活性(P<0.01)。IR+HM组与IR+LM组比较差异无统计学意义(P>0.05)。见表2。
2.4 米诺环素后处理对大鼠心肌细胞凋亡的影响
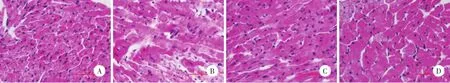
Fig.1 米诺环素后处理对大鼠心肌组织病理形态学的影响 HE染色×400Fig.1 Effects of minocycline postconditioning on the myocardial tissue morphology in rats HE dyeing×400
表2 米诺环素后处理对大鼠血清cTn-Ⅰ、CK-MB及AI的影响()Tab.2 Effects of minocycline postconditioning on the cTn-Ⅰ,CK-MB in serum and AI in rats()
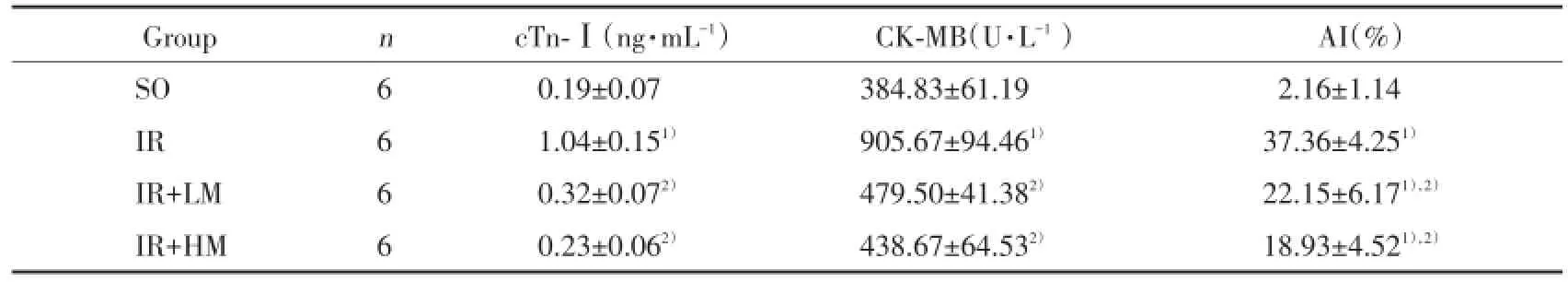
表2 米诺环素后处理对大鼠血清cTn-Ⅰ、CK-MB及AI的影响()Tab.2 Effects of minocycline postconditioning on the cTn-Ⅰ,CK-MB in serum and AI in rats()
Compared with SO group,1)P<0.01;compared with I/R group,2)P<0.01.
Group n cTn-Ⅰ(ng·mL-1) CK-MB(U·L-1) AI(%)SO 6 0.19±0.07 384.83±61.19 2.16±1.14 IR 6 1.04±0.151) 905.67±94.461) 37.36±4.251)IR+LM 6 0.32±0.072) 479.50±41.382) 22.15±6.171),2)IR+HM 6 0.23±0.062) 438.67±64.532) 18.93±4.521),2)
TUNNEL染色后正常细胞核染蓝色,凋亡细胞核呈棕色。如图2所示,SO组大鼠心肌中极少量TUNEL染色阳性细胞,与SO组比较,IR组大鼠染色阳性细胞明显增多,AI明显增高(P<0.01),与IR组比较,IR+LM组和IR+HM组染色阳性细胞明显减少,AI明显降低(P<0.01)。IR+HM组与IR+LM组比较差异无统计学意义(P>0.05)。见表2。
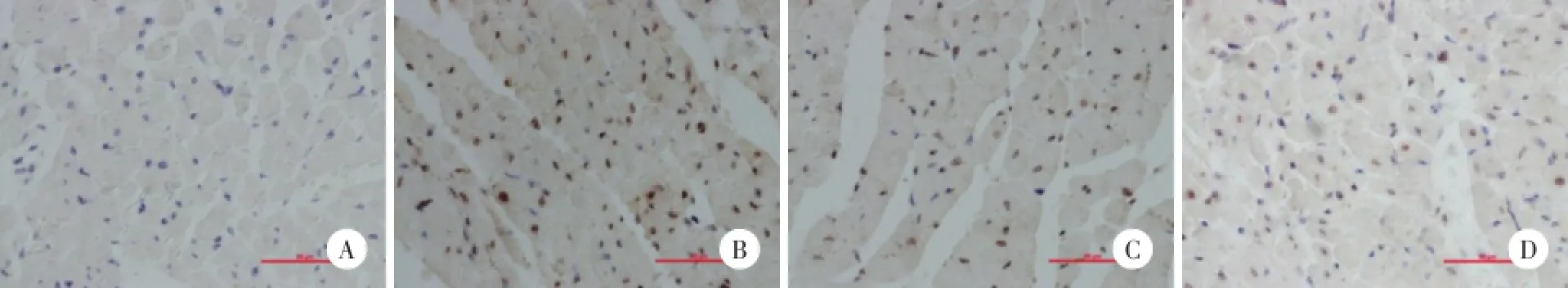
图2 米诺环素后处理对大鼠心肌细胞凋亡的影响 TUNEL染色×400Fig.2 Effects of minocycline postconditioning on the myocardial apoptosis in rats TUNEL dying×400
2.5 米诺环素后处理对大鼠血清、心肌组织MDA含量和SOD活性的影响
与SO比较,IR组血清、心肌组织MDA含量均明显增高(P<0.01),血清、心肌组织SOD活性明显降低(P<0.01);与IR组比较,IR+LM组和IR+HM组血清、心肌组织MDA含量明显降低(P<0.01),血清、心肌组织SOD活性明显升高(P<0.05或P<0.01)。IR+HM组与IR+LM组比较差异无统计学意义(P>0.05)。见表3。
表3 米诺环素后处理对大鼠血清、心肌组织MDA含量和SOD活性的影响()Tab.3 Effects of minocycline postconditioning on the MDA and SOD in serum and myocardium in rats()

表3 米诺环素后处理对大鼠血清、心肌组织MDA含量和SOD活性的影响()Tab.3 Effects of minocycline postconditioning on the MDA and SOD in serum and myocardium in rats()
Compared with SO group,1)P<0.01;compared with I/R group,2)P<0.05,3)P<0.01.
Group n Serum MDA Serum SOD Myocardial MDA Myocardial SOD(nmol/mL) (U/mL) (nmol/mg pro) (U/mg pro)SO 6 1.96±0.78 117.35±12.01 2.96±0.48 198.7±17.24 IR 6 5.17±0.971) 51.36±10.631) 8.47±1.271) 97.4±8.631)IR+LM 6 2.45±0.83) 72.54±13.081),2) 6.15±1.091),3) 141.5±15.291),3)IR+HM 6 2.04±0.673) 81.67±12.201),3) 5.54±1.311),3) 167.1±13.373)
3 讨论
心肌再灌注治疗是限制急性缺血性心肌坏死最有效的方法,而伴随再灌注出现的活性氧的产生、钙超载、炎性介质释放所介导的心肌缺血/再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)削弱了再灌注治疗的净效益[4,5]。米诺环素是一种半合成的四环素衍生物,在临床上主要用于治疗关节炎及其它感染性疾病,除抗菌作用外还具有抗炎、抗凋亡、基质金属蛋白酶抑制剂以及氧自由基清除等多效性,近年发现它对多种神经系统疾病具有显著的神经保护作用[6,7]。动物试验也证实了米诺环素预处理对肾脏[8]及心肌缺血再灌注损伤有保护作用。然而,在急性缺血性心肌损伤中米诺环素应用剂量(45~90 mg/kg)较高[1,2],而且多采用腹腔注射或经口途径给药,而研究发现腹腔注射米诺环素将导致药物延迟吸收及腹膜激惹[9],而急性心肌保护中静脉给药途径更能快速达到有效血药浓度进而渗透心肌发挥作用。因此,本研究选择与米诺环素临床应用标准剂量200 mg相当的给药剂量(3 mg/kg)[3],再灌注前10 min经静脉注射给药,检测血清cTn-Ⅰ、CK-MB评价心肌组织损伤程度,cTn-Ⅰ特异性存在于心肌细胞内,是横纹肌收缩的重要调节蛋白,在心肌细胞膜完整状态下,cTn-Ⅰ不能透过细胞膜进入血循环,当心肌缺血缺氧,发生变性坏死、细胞膜破损时,cTn-Ⅰ因其分子量较小而弥散进入细胞间质,从而能较早释放到外周血,对诊断心肌损伤具有高度的特异性和敏感性[10]。同时监测再灌注后心脏血流动力学参数-dp/dtmax和LVEDP评价心脏舒张功能,结果显示,cTn-Ⅰ、CK-MB在IR组与米诺环素组均显著高于SO组,提示缺血再灌注导致明显的心肌损伤。MIRI使心脏舒张功能减低同时损害了心肌收缩能力,低、高剂量米诺环素后处理均明显减少心肌坏死,同时改善了受损心肌的舒张、收缩功能,其心肌保护作用具有剂量依赖性。
凋亡是一种主动地、程序性细胞死亡,是在一定条件下,核细胞通过启动内部机制,激活内源性DNA内切酶而发生的细胞自然死亡过程,主要表现为细胞核变化,包括:染色质断裂、固缩、崩解、细胞质空泡变、凋亡小体形成。MIRI导致心肌细胞过度凋亡是心肌细胞死亡的重要因素,减少心肌细胞凋亡能减轻心肌损伤和改善心功能。本研究应用TUNEL法染色,结果表明SO组可见少量散在凋亡细胞,IR组凋亡细胞显著增多,提示心肌缺血或再灌注过程有促进或加速心肌细胞凋亡的作用,而低、高剂量米诺环素后处理均能有效减少心肌细胞凋亡,米诺环素的心肌保护作用与抑制心肌细胞凋亡有关。
在MIRI过程中,大量氧自由基产生导致的氧化应激、脂质过氧化反应是造成心肌细胞损伤的重要因素之一[11]。MDA和SOD是反映自由基损伤的指标[12],MDA作为脂质过氧化的代谢产物,具有细胞毒性,其含量与体内脂质过氧化的速率和强度直接相关,在一定程度上能反映细胞损伤的程度。MDA通过促使蛋白质和DNA等生命大分子发生交联聚合;与磷脂反应破坏生物膜结构,使膜通透性增大而引起一系列细胞损伤。SOD即为机体内抗氧化活性重要物质,能特异性清除超氧自由基,阻断自由基产生,提高抗氧化物酶的活性,进而增强机体的抗氧化能力,SOD活性可间接反映机体清除自由基和抗氧化损伤的能力。抗氧化应激,抑制体内脂质过氧化反应,能保护缺血心肌,促进缺血再灌注心脏的心功能恢复[12]。本研究结果显示,MIRI使血清与心肌内MDA含量明显升高,SOD活性显著降低,证明了氧自由基爆发在心肌再灌注的病理生理改变中起关键作用。而低、高剂量米诺环素后处理均能显著维持再灌注期的SOD活性且不增加MDA的含量,提示米诺环素可改善缺血再灌注时机体的抗氧化能力,减轻心肌细胞的损伤程度。
大量证据表明,再灌注损伤是缺血后炎性反应的结果,再灌注损伤可能存在时间的依赖性,因此,缺血和再灌注的各自持续时间可以影响再灌注损伤的程度,同时也能影响药物干预的有效性。本研究结果显示再灌注2 h,高剂量较低剂量米诺环素组有进一步改善趋势,但其差异无统计学意义,本研究为单次给药,后续的研究考虑延长再灌注的时间至24 h,适当增加给药次数,观察高、低剂量米诺环素组的心肌保护作用是否存在差异。
本研究首次证实低剂量米诺环素后处理能减轻大鼠心肌缺血再灌注损伤,静脉注射在大鼠急性心肌损伤模型中应用安全、可行,其心肌保护机制涉及对循环和心肌氧化应激状态的调整,通过降低MDA含量与提升SOD的活性,减少心肌细胞的凋亡和坏死,进而改善心功能,以上结果对米诺环素的急性心肌保护的临床应用具有指导意义。
[1]Scarabelli TM,Stephanou A,Pasini E,et al.Minocycline inhibits caspase activation and reactivation,increases the ratio of XIAP to smac/DIABLO,and reduces the mitochondrial leakage of cytochrome C and smac/DIABLO[J].Am Coll Cardiol,2004,43(5):865-874.
[2]Tao R,Kim SH,Honbo N,et al.Minocycline protects cardiac myocytes against simulated ischemia-reperfusion injury by inhibiting poly(ADP-ribose)polymerase-1[J].Cardiovasc Pharmacol,2010,56(6):659-668.
[3]Saivin S,Houin G.Clinical pharmacokinetics of doxycycline and minocycline[J].Clin Pharmacokinet,1988,15(6):355-366.
[4]Moens AL,Claeys MJ,Timmermans JP,et al.Myocardial ischemia/ reperfusion-injury,a clinical view on a complex pathophysiological process[J].Int J Cardiol,2005,100(2):179-190.
[5]邹吉丽,尹照萍,张利群,等.大鼠心肌缺血再灌注早期心肌及血清中IL-6、TNF-α的表达[J].中国医科大学学报,2013,42(9):830-833.
[6]Fagan SC,Cronic LE,Hess DC.Minocycline development for acute ischemic stroke[J].Transl Stroke Res,2011,2(2):202-208.
[7]Plane JM,Shen Y,Pleasure DE,et al.Prospects for minocycline neuroprotection[J].Arch Neurol,2010,67(12):1442-1448.
[8]Xia D,Shen K,Zhong W,et al.Administration of minocycline ameliorates damage in a renal ischemia/reperfusion injury model[J]. Clin Invest Med,2011,34(2):E55-63.
[9]Fagan SC,Edwards DJ,Borlongan CV,et al.Optimal delivery of minocycline to the brain:implication for human studies of acute neuroprotection[J].Exp Neurol,2004,186(2):248-251.
[10]Apple FS.Tissue specificity of cardiac troponin I,cardiac troponin T and creatine kinase MB[J].Clin Chim Acta,1999,284(2):151-158.
[11]Yellon DM,Hausenloy DJ.Myocardial reperfusion injury[J].N Engl J Med,2007,357(11):1121-1135.
[12]赵润英,郝伟,孟祥军,等.阿魏酸川芎嗪后处理对大鼠心肌缺血再灌注损伤的影响[J].中国医科大学学报,2012,41(11):1081-1021.
(编辑 武玉欣)
Protective Effectof Intravenous Infusion ofLow Dose Minocycline Postconditioning on Myocardial Ischemia-reperfusion Injury in Rat
ZHANGLi-qun1,CHENYong-jun2,CUIRen-shan1,QIGuo-xian3
(1.Department of Humanity,School of Nursing of Shenyang Medical College,Shenyang 110034,China;2.Department of Clinical Lab,Shenzhou Hospital,Shenyang MedicalCollege,Shenyang 110002,China;3.DepartmentofCardiology,The FirstHospital,China MedicalUniversity,Shenyang 110001,China)
Objective To evaluate the effects of low dose intravenous minocycline postconditioning on myocardial ischemia-reperfusion injury in rat,and to investigate the possible mechanisms.MethodsForty-eight male Wistar rats were randomly divided into four groups:sham-operation(SO)group,ischemia-reperfusion(IR)group,low-dose minocycline(3 mg/kg,LM)group and high-dose minocycline(10 mg/kg,HM)group. The rat model of myocardial IR was established by occlusion of the left anterior descending coronary artery for 45 minutes and reperfusion for 120 minutes.Afterthe reperfusion,the parameters ofhaemodynamicswere recorded;creatine kinase MB(CK-MB),cardiac troponin-I(cTn-I),malondialdehyde(MDA),superoxide dismutase(SOD)in serum and myocardium,myocardial apoptosis index(AI)and the myocardial tissue morphology were determined.ResultsCompared with IR group,LM and HM treatment significantly reduced the levels of CK-MB form,cTn-I,AI and MDA,lowered LVEDP,enhanced LVSP and±dp/dtmax,elevated the activity of SOD in serum and myocardium(P<0.05).The effect of HM is stronger than LM on these above mentioned indicators,but the difference was not statistical significance(P>0.05).ConclusionLM postconditioning can protect against myocardial IR injury,and the protective effect may be related to the scavenging of oxide free radical,which further restrain the reaction oflipid peroxidation and apoptosis.
minocycline;ischemia postconditioning;myocardial ischemia-reperfusion injury
R541.4
A
0258-4646(2015)08-0685-05
辽宁省教育厅科学研究一般项目(L2013399);沈阳医学院博士科研启动基金(20133050)
张利群(1970-),女,副教授,博士. E-mail:sunflowerzlq@163.com
2015-01-16
网络出版时间:

