猪伪狂犬病毒野毒感染的PCR检测方法建立及应用
范克伟,戴爱玲,吴德峰,杨小燕*,江丹丹
(1.龙岩学院生命科学学院,福建龙岩364012;2.福建省预防兽医学与兽医生物技术重点实验室,福建龙岩364012;3.福建农林大学动物科学学院,福建福州350002)
猪伪狂犬病是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种急性传染病,以新生仔猪的腹泻及神经症状,妊娠母猪繁殖障碍、流产、死胎及呼吸道症状,成年猪隐形感染,长期带毒排毒为特征[1]。在我国猪伪狂犬病的流行范围很广,迄今为止已有20 多个省份出现该病的流行[2-3]。尤其自2012年以来,由猪伪狂犬病毒变异株引起的猪伪狂犬病出现了新的发病特征,发病率和死亡率明显上升,给我国养猪业造成了重大的经济损失[4-8]。该病目前尚无有效治疗药物,猪伪狂犬病的防制主要依靠基因缺失疫苗的广泛应用,虽然疫苗接种可使猪免于发病,但不能阻止野毒的潜伏感染[9]。由于该病的流行形势发生了新变化,近年来疫苗的保护率不是很高,这给该病的防控工作大大增加了难度。此外,PRV 的检测方法主要是针对抗体或gE 抗体缺失的血清学检测方法,无法区分疫苗免疫猪和野毒感染猪[10]。
糖蛋白gB 是PRV 的一个重要包膜组分和中和抗原,对于PRV 感染必不可少。而gB 基因对PRV 的复制也是不可缺少的[11-12]。gE 基因是PRV 的主要毒力基因之一,但不是病毒复制所需的[13]。PRV Bartha-K61株疫苗(缺失gE/gI)目前在世界上应用最为广泛,市场占有率超过90%。因此,本研究根据猪伪狂犬病毒gB 和gE 基因序列,建立了快速鉴别猪伪狂犬病毒gE 基因缺失疫苗毒与野毒的双重PCR 检测方法,对于猪伪狂犬病的快速确诊具有重要意义。
1 材料与方法
1.1 病毒株、细胞和病料
PRV 容A(RA)株购自中国兽医微生物菌种保藏管理中心,PRV、PPV、PCV2、HP-PRRSV 及CSFV野毒株均由本实验室分离鉴定;PRV 疫苗HB-98株和Bartha-K61株均购自武汉科前生物制品有限责任公司;猪肾细胞PK-15由本实验室保存;疑似PRV病料样品由龙岩学院动物医学研究所保存。
1.2 主要试剂
LA Taq DNA 聚合酶、2×GC Buffer I、dNTP、DL 2,000DNA Marker、Universal Genomic DNA Extraction Kit及pMD18-T Vector均购自宝生物工程(大连)有限公司。
1.3 引物设计
根据GenBank中登录的PRV gE和gB基因序列设计2 对特异性引物,P1:5'-GCGCTGGGCTCCTTCGTGAT-3',P2:5'-CGCCATAGTTGGGTCCATTCGT-3'; P3:5'-ATCCAGGCGCACGT-GAACGAC-3',P4:5'-CTGGTTGCGGCGCTGGAT-3'。引物P1/P2扩增gE(400bp),引物P3/P4扩增gB(582bp)。引物由上海英骏生物技术有限公司合成。
1.4 病毒培养
分别用PRV、PCV2和PPV,接种PK-15细胞,PCV2在接毒后72h收毒,PRV 和PPV 在PK-15细胞出现80%细胞病变时收毒。
1.5 病毒DNA 提取
根据TaKaRa 公司Universal Genomic DNA Extraction Kit试剂盒说明书,分别提取PRV 容A株、PRV 疫苗株、PPV 及PCV2病毒基因组DNA,直接用于PCR 反应。
1.6 单重PCR 方法的建立
以PRV容A 株DNA 为模板,分别用gE、gB特异性引物进行PCR 扩增。PCR 程序:94℃5 min;94℃1min,62℃50s,72℃1min,33个循环;72 ℃10min。PCR产物用1%琼脂糖凝胶电泳检测。将PCR产物片段大小正确的目的基因连接至pMD18-T载体中,送上海英骏生物技术有限公司测序。
1.7 双重PCR 方法的建立
在单重PCR 扩增反应的基础上,将PRV gE和gB特异性引物对加入同一PCR 反应体系中,分别对双重PCR 反应体系中的引物浓度、退火温度、模板量、dNTP浓度等条件进行优化,筛选出用于双重PCR 扩增的最佳反应体系和程序。
1.8 特异性试验
分别以PRV 细胞毒株、PRV 疫苗毒株、PCV2及PPV 的DNA 和HP-PRRSV、CSFV 的cDNA 为模板进行PCR 反应,同时以PK-15 正常细胞为阴性对照,以验证该方法的特异性。
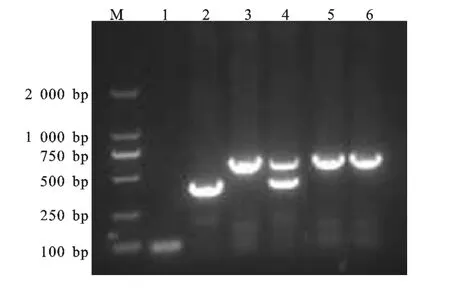
图1 双重PCR 扩增结果Fig.1 Amplification result of the duplex PCR
1.9 敏感性试验
用Thermo 多功能酶标仪对PRV 细胞毒的DNA 浓度进行测定,然后将其10倍倍比稀释后作为模板,采用优化后的扩增条件进行双重PCR 扩增,检测其敏感性。
1.10 临床样品的检测
利用建立的双重PCR 方法,对2014年龙岩学院动物医学研究所送检的20份疑似PRV 感染猪组织样品(脑、淋巴结、脾脏、肺等)进行应用检测。
2 结果与分析
2.1 PCR 扩增结果和产物特异性分析
用gE和gB相应的引物对进行单一扩增和双重扩增,1%琼脂糖凝胶电泳结果显示(图1),PRV 容A株可观察到400bp(gE)和582bp(gB)条带,HB-98及Bartha-K61疫苗株仅有一条582bp(gB)的条带,大小与预期相符,阴性对照没有扩增出条带。说明建立的该PCR 方法能够区分PRV 野毒株和疫苗弱毒。同时,将目的基因PCR产物连接至pMD18-T 载体中进行测序鉴定,结果表明序列结果与GenBank中登录的PRV gE和gB基因序列一致。
2.2 双重PCR 反应条件的优化
对PRV gE 和gB 基因的引物浓度、PCR 扩增温度及dNTP 浓度等进行了优化。最终确定的双重PCR 反应25μL体系为:DNA 模板1μL、2×GC Buffer I 12.5μL、dNTP(2.5mmol/L)4μL、上下游引物各(20pmol/L)1μL、LA Taq酶(5 U/μL)0.25μL,用ddH2O 补至25μL。最佳退火温度为62 ℃(图2),最终确定双重PCR 反应程序:94 ℃5 min;94 ℃1min,62 ℃50s,72 ℃1min,35个循环;72 ℃10min。

图2 双重PCR 不同退火温度的扩增结果Fig.2 Amplification result of the duplex PCR at different annealing temperature
2.3 双重PCR 反应的特异性
用gE和gB特异性引物分别对PRV 细胞毒、疫苗毒、PCV2、PPV 的DNA 和HP-PRRSV、CSFV 的cDNA 进行PCR 反应,以PK-15正常细胞为阴性对照。结果显示,仅PRV 容A 株和分离株可扩增出gE和gB基因的两条特异性条带,HB-98和Bartha-K61疫苗株仅扩增出一条gB基因的特异性条带,而其他均未扩增出明显条带(图3)。
2.4 双重PCR 反应的敏感性
采用优化后的双重PCR 扩增条件来扩增10倍倍比稀释的PRV 容A 株DNA,进行双重PCR 反应。结果显示,当模板量为1pg 时,PCR 扩增的目的条带不清晰,模板量为10pg时,双重PCR 扩增能够获得清晰的目的条带(图4)。因此,该PCR 方法检测PRV DNA 的下限为10pg/μL。
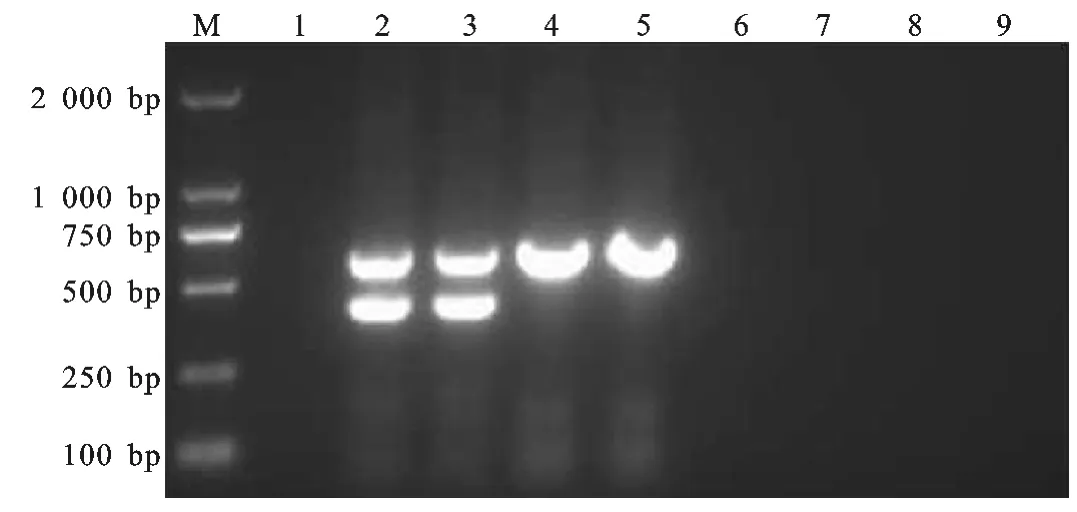
图3 双重PCR 特异性试验Fig.3 Specificity test of the duplex PCR

图4 双重PCR 敏感性试验Fig.4 Sensitivity test of the duplex PCR
2.5 临床样品检测结果
应用建立的双重PCR 方法,对2014年龙岩学院动物医学研究所送检的20份疑似PRV 感染猪组织样品(脑、淋巴结、脾脏、肺等)进行应用检测,结果显示,PRV 疑似感染病料中8份为PRV 野毒感染,仅3份为疫苗接种感染。用单重和双重PCR 方法分别检测来证明其准确性,双重PCR 检测的结果与单一PCR 检测结果总体符合率为100%,该方法可用于临床病料检测。
3 讨论
目前,猪伪狂犬病疫情形势严峻,我国许多使用PRV 基因缺失活疫苗免疫的规模化猪场出现了猪狂犬病流行,且发病特点和流行形势也发生了变化[14]。研究表明,与以前的流行株相比,PRV 新流行株的抗原性已发生变异,进而导致现有疫苗不能提供完全保护,从而增加了该病的防控难度[4-5,7]。因此,建立一种快速、高效、灵敏的PRV 野毒感染病原学检测方法,对于猪伪狂犬病的分子流行病学调查及早期的预防和治疗等都具有重要意义。
我国主要通过接种基因缺失疫苗来预防和控制伪狂犬病。由于gE基因缺失疫苗在病毒侵入神经系统方面被认为比其它单个非必需糖蛋白缺失苗更安全,同时gE 基因缺失不会影响病毒的复制和中和抗体的产生,gE 又是所有野毒株均表达的一类糖蛋白[15]。因此,gE 可作为标志基因,区别感染动物和疫苗接种动物[16]。目前,我国大部分区域均使用gE基因缺失疫苗防控猪伪狂犬病,本研究依据针对PRV 基因缺失疫苗不含毒力基因gE 只含有表面抗原基因gB,而PRV 野毒既含有毒力基因gE又含有表面抗原基因gB 的特性建立了一种快速鉴别猪伪狂犬病毒野毒和gE 基因缺失疫苗毒感染的双重PCR 方法。通过对gE和gB 引物浓度和双重PCR 退火温度等进行优化,最终确定的双重PCR反应条件,能够对目的片段gE 和gB进行有效地扩增。敏感性试验结果表明,所建立的方法可检测的目的基因最低核酸拷贝数均为10pg/μL。重复性试验结果显示双重PCR 方法3次重复检测试验结果均完全一致,可以满足临床样品检测的需要。对2014年龙岩学院动物医学研究所送检的20 份疑似PRV 感染猪组织样品进行检测结果表明,阳性检出率与发病猪的临床症状、剖检病化和病毒分离与鉴定结果均具有较高的符合率,说明本试验所建立的双重PCR 检测方法具有灵敏度高、重复性好、特异性强的特点,可以用于猪伪狂犬病的流行病学调查和进行PRV 野毒感染的快速确诊。
[1]殷 震,刘景华.动物病毒学[M].第2 版.北京:科技出版社,1997.
[2]蔺 芳,尹双辉,尚佑军,等.多重PCR 方法快速鉴别猪伪狂犬疫苗毒和野毒[J].安徽农业科学,2009,37(13):5 889-5 891.
[3]赵雪丽,闫若潜,陈慧娟,等.鉴别猪伪狂犬病毒gE 基因缺失疫苗和野毒感染的二重PCR 诊断方法的建立和应用[C]∥中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会论文集,2013.
[4]An T Q,Peng J M,Tian Z J,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].Emerg Infect Dis,2013,19(11):1 749-1 755.
[5]Yu X L,Zhou Z,Hu D M,et al.Pathogenic pseudorabies virus,China,2012[J].Emerg Infect Dis,2014,20(1):102-104.
[6]汤德元,郝 飞,李春燕,等.伪狂犬病病毒Guizhou-DY 株的分离鉴定及致病性研究[C]∥中国畜牧兽医学会家畜传染病学分会第八届全国会员代表大会暨第十五次学术研讨会论文集,2013.
[7]童 武,张青占,郑 浩,等.免疫后发病仔猪中伪狂犬病毒的分离和鉴定[J].中国动物传染病学报,2013,21(3):1-7.
[8]吴云飞,朱 玲,徐志文,等.伪狂犬病病毒四川株的分离鉴定及增殖特性[J].中国兽医科学,2013,43(6):557-564.
[9]金升藻,陈焕春,熊 符.伪狂犬病基因缺失疫苗研究进展[J].中国农业科学,2002,35(1):89-93.
[10]顾 阳,高晓云,程 琨,等.鉴别猪伪狂犬病病毒强毒与疫苗毒双重PCR 检测方法的建立[J].华北农学报,2014,29(2):94-97.
[11]陈振海,林天龙,陈少莺,等.伪狂犬病毒Fa 株gB,gC,gD基因的克隆与序列分析[J].福建农业学报,2007,22(2):120-125.
[12]张新平,刘建奎,魏春华,等.猪伪狂犬病病毒福建株gB,gD基因的克隆和序列分析[J].中国畜牧兽医,2014,41(5):62-65.
[13]Tirabassi R S,Enquist L W.Role of envelope protein gE endocytosis in the pseudorabies virus life cycle[J].J Virol,1998,72(6):4 571-4 579.
[14]赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE 基因的分子特征[J].中国预防兽医学报,2014,36(7):506-509.
[15]周 斌,苏鑫铭,张素芳,等.PCR 快速检测伪狂犬病病毒野毒感染[J].中国病毒学,2004,19(6):612-615.
[16]Kinker D R,Swenson S L,Wu L L,et al.Evaluation of serological tests for the detection of pseudorabies gE antibodies during early infection[J].Veterinary Microbiology,1997,55(1-4):99-106.

