微生态制剂对肉羊生长性能和免疫功能的影响
杨 华,张韩杰,吴信明,汪 洋,王明贤,张 红,吕娅毅
(1.乐山职业技术学院,四川乐山614000;2.滨州学院生命科学系,山东滨州256600;3.山东省滨州畜牧兽医研究院,山东滨州256600)
近年来,随着人们生活质量的不断提高和对食品安全的日益重视,开发利用无公害、无污染、无残留的绿色饲料添加剂逐步成为畜牧养殖业进一步发展的新课题。动物微生态制剂又称为微生物饲料添加剂,是将从动物体内分离到的有益微生物经培养、发酵、干燥、加工等制成的含有活菌及其代谢产物的生物制品[1],具有绿色安全、无污染、无残留、无毒副作用等优点,且可调节胃肠道微生物菌落平衡,抑制有害病原微生物的生长,是一类绿色环保的新型饲料添加剂[2],但微生态制剂在反刍动物生产中的应用还处于起步阶段,且多数研究针对提高反刍动物生产性能方面[3-5],目前尚无针对反刍动物屠宰性能和免疫功能方面的研究。本研究首次全面探讨了肉羊基础饲粮中添加不同水平微生态制剂对肉羊生产性能、营养物质消化率、免疫功能、屠宰性能和肉品质的影响,以期为微生态制剂在肉羊饲料添加剂中的合理开发应用提供重要的理论依据和实践参考。
1 材料与方法
1.1 试验材料
微生态制剂为某单位微生物实验室自主研发产品,由分离自羊瘤胃液的芽孢杆菌和双歧杆菌经冻干而成,其活菌数高达10 亿/g;羊免疫球蛋白G(IgG)、羊免疫球蛋白A(IgA)、羊免疫球蛋白M(IgM)、羊白介素2(IL-2)、羊白介素6(IL-6)ELISA试剂盒均购自上海纪宁生物科研有限公司;健康3月龄洼地绵羊购自山东省洼地绵羊繁育技术研究推广中心。
1.2 试验设计
将90只3月龄雄性绵羊随机分成3 组(对照组、试验Ⅰ组、试验Ⅱ组),每组设3个重复,每个重复10只羊,经预试期15d后,对照组饲喂基础日粮(日粮组成与营养水平见表1),试验Ⅰ组、Ⅱ组分别在基础日粮中添加500mg/kg、10 0 0mg/kg的微生态制剂,各处理组分栏饲养,定期清扫粪便和消毒,试验正式期60d。
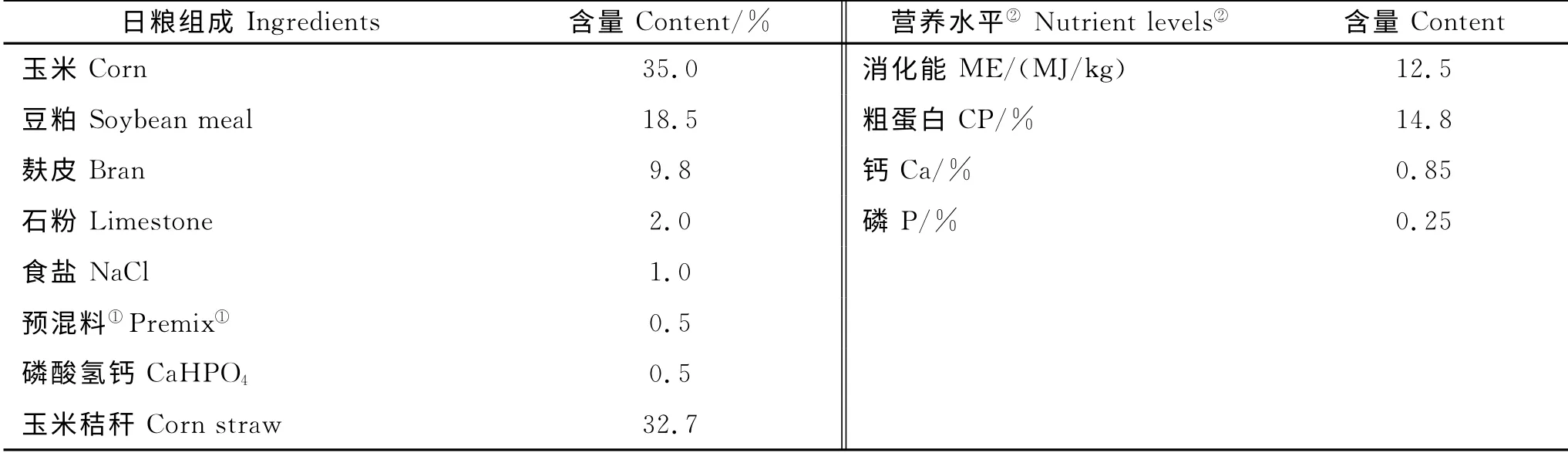
表1 基础日粮组成和营养水平Table 1 Composition and nutrient levels of basal diets
1.3 检测指标与方法
1.3.1 生产性能的测定 试验期间每日记录各处理组的采食量,计算平均日采食量;试验开始与结束时所有试验羊均空腹称重,计算平均日增重;料重比=日采食量/日增重。
1.3.2 营养物质消化率的测定 在试验期结束前连续4d每日定时收集每只羊部分粪样,将4d收集的粪样混合。参照徐凤霞等[6]的方法分别测定日粮和粪样中的干物质、粗蛋白、粗脂肪、粗纤维、无氮浸出物的含量,计算各营养物质消化率。
1.3.3 免疫功能的检测
1.3.3.1 免疫器官指数的测定 试验结束后对试验羊进行屠宰,摘取脾脏,计算脾脏指数。
1.3.3.2 血清免疫球蛋白含量的测定 试验结束后分别对每只羊采集并分离血清,分别参照IgG、IgA、IgM ELISA 试剂盒说明书中的操作方法测定各组试验羊血清中的IgG、IgA、IgM 含量。
1.3.3.3 细胞因子含量的测定 试验结束后分别对每只羊采集并分离血清,分别参照IL-2、IL-6 ELISA 试剂盒说明书中的操作方法测定各组试验羊血清中的IL-2、IL-6含量。
1.3.4 屠宰性能的测定 试验结束后对试验羊进行屠宰,参照文献[7]中的方法计算各处理组的屠宰率、净肉率、GR 值、眼肌面积。
1.3.5 肉品质的测定 参照文献[7]中的方法分别测定肉色、大理石纹、屠宰45min后背最长肌肉的pH(pH1)、屠宰24h后背最长肌肉的pH(pH24)、剪切力、滴水损失、熟肉率。
1.4 数据统计与分析
试验数据均采用SPSS 13.0软件进行统计处理和方差分析,数据以平均值±标准差表示,以P<0.05为差异显著。
2 结果与分析
2.1 微生态制剂对肉羊生产性能的影响
由表2可知,试验Ⅰ组、Ⅱ组与对照组相比,在平均日采食量、平均日增重、料重比方面均差异显著(P<0.05);试验Ⅰ组与Ⅱ组之间在平均日采食量方面差异显著(P<0.05),在平均日增重和料重比方面差异均不显著(P>0.05)。表明肉羊基础日粮中添加500mg/kg和1 000mg/kg微生态制剂均能提高肉羊的平均日增重,减低料重比,提高肉羊的生产性能,且500mg/kg的添加剂量和1 000 mg/kg的添加剂量之间差异不明显。

表2 微生态制剂对肉羊生长性能的影响Table 2 Effect of microbial ecological agents on sheep growth performance
2.2 微生态制剂对肉羊营养物质消化率的影响
由表3可知,试验Ⅰ组、Ⅱ组与对照组相比,在干物质消化率、粗脂肪消化率、粗纤维消化率方面均差异显著(P<0.05);试验Ⅱ组与Ⅰ组相比,在粗蛋白、粗纤维方面差异均显著(P<0.05),其它方面均差异不显著(P>0.05)。表明肉羊基础日粮中添加500mg/kg和1 000mg/kg微生态制剂均能提高肉羊的营养物质表观消化率,且1 000mg/kg的添加剂量优于500mg/kg的添加剂量。
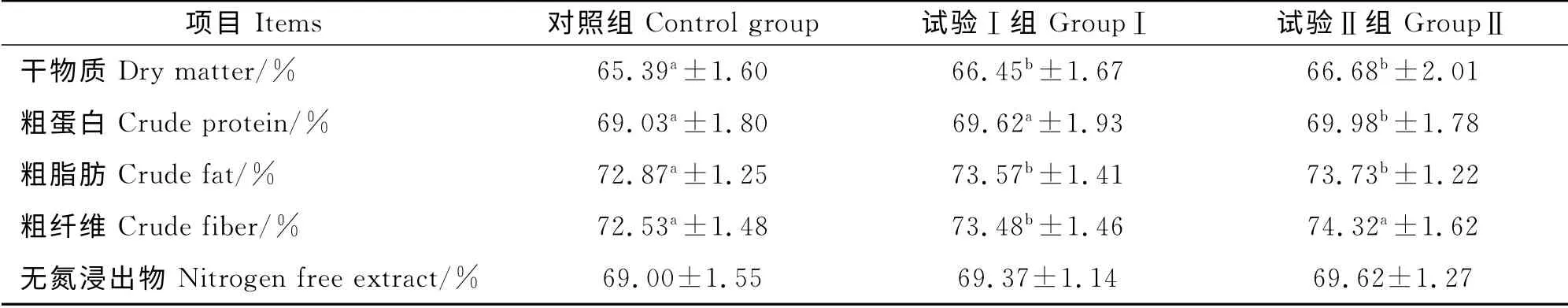
表3 微生态制剂对肉羊营养物质消化率的影响Table 3 Effect of microbial ecological agents on sheep nutrient digestibility
2.3 微生态制剂对肉羊免疫功能的影响
由表4可知,试验Ⅰ组与对照组相比,在脾脏指数、IgG 含量、IL-6 含量方面均差异显著(P<0.05);试验Ⅱ组与对照组相比,在脾脏指数、IgG 含量、IgA 含量、IL-2含量、IL-6含量方面差异均显著(P<0.05);试验Ⅰ组与Ⅱ组之间,在脾脏指数、IgG含量、IgA 含量、IgM 含量、IL-2 含量、IL-6 含量方面差异均不显著(P>0.05)。表明肉羊基础日粮中添加500mg/kg和1 000mg/kg微生态制剂均能提高肉羊的免疫功能,且500 mg/kg 的添加剂量和1 000mg/kg的添加剂量之间差异不明显。

表4 微生态制剂对肉羊免疫功能的影响Table 4 Effects of microbial ecological agents on sheep immunity
2.4 微生态制剂对肉羊屠宰性能的影响
由表5可知,试验Ⅰ组与对照组相比,在屠宰率方面差异显著(P<0.05),其它检测指标方面差异均不显著(P>0.05);试验Ⅱ组与对照组相比,在屠宰率、净肉率、GR 值方面差异均显著(P<0.05),眼肌面积方面差异不显著(P>0.05);试验Ⅰ组与Ⅱ组之间,在屠宰率、净肉率、GR 值、眼肌面积方面差异均不显著(P>0.05)。表明肉羊基础日粮中添加500mg/kg和1 000mg/kg微生态制剂均能提高肉羊的屠宰性能,且500mg/kg的添加剂量和1000mg/kg的添加剂量之间差异不明显。

表5 微生态制剂对肉羊屠宰性能的影响Table 5 Effect of microbial ecological agents on sheep slaughter performance
2.5 微生态制剂对肉羊肉品质的影响
微生态制剂对肉羊肉品质的影响见表6。由表6知,试验Ⅰ组、Ⅱ组与对照组相比,在pH1、pH24、剪切力、滴水损失、熟肉率方面均差异显著;试验Ⅰ组与Ⅱ组在滴水损失方面差异显著(P<0.05),在肉色、大理石纹、pH1、pH24、剪切力、熟肉率检测指标方面均差异不显著(P>0.05)。表明肉羊基础日粮中添加500mg/kg和1 000mg/kg微生态制剂均能改善肉羊肉品质,且500 mg/kg 的添加剂量和1 000mg/kg的添加剂量之间差异不明显。
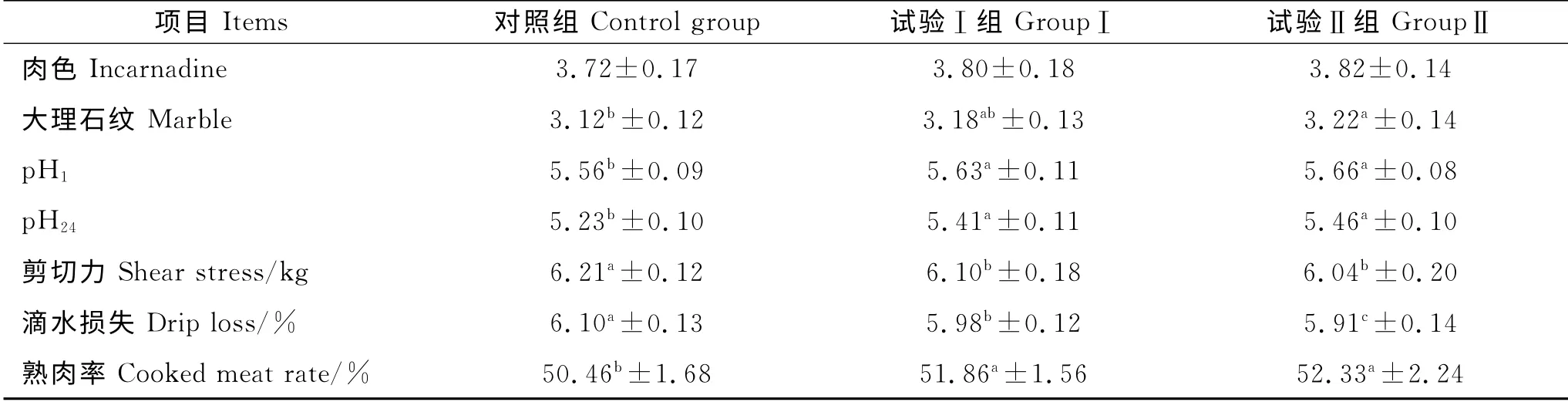
表6 微生态制剂对肉羊肉品质的影响Table 6 Effect of microbial ecological agents on sheep meat quality
3 讨论
3.1 微生态制剂对肉羊生长性能的影响
饲粮中添加微生态制剂对肉羊生长性能的影响与微生态制剂的品种、添加剂量、试验动物机体状况等密切相关,故研究学者对微生态制剂对肉羊生长性能影响的研究结果并不一致,Hemandez等[8]研究表明含主要成份为益生素的微生态制剂对肉羊的生长性能没有影响,而Haddad等[9]研究表明羔羊基础饲粮中添加酵母培养物可有效提高生长性能,杨华等[10]研究亦表明从羊瘤胃内分离出的芽孢杆菌可显著提高肉羊的育肥效果。本研究试验结果亦证实基础饲粮中添加微生态制剂可明显提高肉羊的日采食量和日增重,降低料重比。究其原因可能为微生态制剂之中的活菌以及活菌的代谢产物进入反刍动物瘤胃后,改善了瘤胃内微生物的微生态平衡,增加了有益菌的数量,抑制了有害菌的数量,进而提高生长性能。且本研究发现500 mg/kg 和1 000 mg/kg的添加剂量之间无显著性差异,究其原因可能为微生态制剂中提供的有益菌数量能够满足动物机体所需要的水平后,再添加微生态制剂也不能更好的改善动物机体的微生态平衡,故建议生产中添加500mg/kg即可。
3.2 微生态制剂对肉羊营养物质消化率的影响
微生态制剂可通过调节瘤胃pH,改善瘤胃内环境和瘤胃发酵状况,提高瘤胃内有益菌的生长和纤维素酶水解活性,使瘤胃内更易于降解纤维,进而提高营养物质的消化率[11]。本研究结果亦证实基础饲粮中添加微生态制剂可明显提高肉羊干物质、粗蛋白、粗脂肪、粗纤维表观消化率,且在提高粗蛋白和粗纤维表观消化率方面,1 000 mg/kg的添加剂量与500 mg/kg的添加剂量之间差异显著。该试验结果与提高生长性能方面存在一定的差异,究其原因可能为1 000mg/kg的添加剂量提高的粗蛋白和粗纤维表观消化率未能完全转化在提高动物生长性能方面,致使在日增重和料重比检测指标方面中,500mg/kg和1 000 mg/kg二种添加剂量之间差异性不显著。
3.3 微生态制剂对肉羊免疫功能的影响
动物免疫器官的发育状况直接影响到机体的免疫水平,其指数是衡量机体免疫功能的主要指标。免疫球蛋白是具有抗体活性的一类球蛋白,其含量变化与动物机体健康状况和免疫力密切相关。细胞因子在免疫应答的调节和效应中起着重要作用,细胞因子含量的检测是基础免疫研究的有效手段。故本研究选择免疫器官指数、免疫球蛋白含量、细胞因子含量作为检测指标,全面研究探讨微生态制剂对肉羊免疫功能的影响。而在免疫器官指数、免疫球蛋白和细胞因子的选择中,脾脏是机体最大的外周免疫器官,其不仅可以产生抗体、补体等免疫物质,而且还能清除血液中病原菌、异物以及衰老细胞;IgG 和IgA 具有抑菌、抗病毒等免疫活性,IgM 具有激活补体等功能,IgG、IgA、IgM 含量的高低能直接反应机体体液免疫的强弱;IL-2主要由TH1 型细胞分泌产生,能够刺激T 淋巴细胞增值,调节B 淋巴细胞、单核巨噬细胞、自然杀伤细胞功能,促进抗体和细胞因子的产生,IL-6可诱导B 细胞分化、免疫球蛋白的分泌和CTL 细胞分化,IL-2和IL-6是主要的细胞免疫检测指标。故本研究选择脾脏指数、IgG、IgA、IgM 含量和IL-2、IL-6含量分别从免疫器官、体液免疫、细胞免疫三方面研究肉羊免疫功能的变化,试验研究结果表明微生态制剂在改善肉羊免疫器官,调节体液免疫与细胞免疫方面均具有明显的积极作用。
3.4 微生态制剂对肉羊屠宰性能的影响
屠宰性能检测指标可以直观、有效地评价肉羊的产肉量和养殖经济效益,是衡量肉羊产肉性能最直观、简单有效的方法,也是肉羊生长性能指标最重要的检测依据之一。本研究首次进行了微生态制剂的不同添加水平对肉羊屠宰性能影响的试验研究,结果显示,基础日粮中添加1 000mg/kg微生态制剂能显著提高肉羊的屠宰率、净肉率和GR 值,添加500mg/kg微生态制剂也具有提高肉羊的屠宰率、净肉率和GR 值的趋势,但只有在提高屠宰率方面达到了显著性水平,其它检测指标未达到显著水平,表明微生态制剂可以促进肉羊的能量代谢,提高能量利用率,提高胴体质量。考虑到综合养殖成本,建议生产中仍选择500 mg/kg的添加剂量作为最适添加剂量。
3.5 微生态制剂对肉羊肉品质的影响
随着人们生活质量的不断提高,对动物源性产品的要求亦越来越高,致使肉品质检测指标在肉羊养殖中越来越受到重视,故本研究探讨了微生态制剂不同添加水平对肉羊肉品质的影响。肉的食用品质主要通过pH、系水力和肉嫩度来评定。pH 是测量肉新鲜度的主要指标,正常肉羊肉的pH 变化范围为5.46~5.76之间,但对于快速生长的肉羊,其肉质的pH 偏高[12],本试验也表现出了这一现象,且本试验中微生态制剂的2个添加组pH24较pH1的下降幅度较小,表明肉的生化变化较缓慢,肉质较好。肉嫩度可以反应肉中各种蛋白质的结果特性,通常用剪切力来表示,本试验中微生态制剂的2个添加组饲料转化率提高,试验羊生长较快,脂肪沉积量增加,剪切力增大,与日增重和料重比等检测指标相一致。系水力直接影响着肉的颜色、风味、营养价值,通常用滴水损失和熟肉率来表示,系水力高的肉多汁、鲜嫩,系水力低的肉表面干硬、营养成份随水分流出,肉质下降。本试验中微生态制剂添加组可显著降低肉滴水损失,增加熟肉率,可显著提高羊肉的系水力,改善肉的多汁性,提高肉品质。
4 结论
肉羊基础饲粮中添加500mg/kg和1 000mg/kg微生态制剂均能提高肉羊的生长性能、营养物质消化率、免疫功能、屠宰性能和肉品质,增加养殖经济效益,且在营养物质消化率方面1 000mg/kg的添加剂量著优于500mg/kg的添加剂量,但综合考虑到其它检测指标和养殖成本,生产中仍建议选择500mg/kg作为最适添加剂量。
[1]Chen W C,Quigley E M.Probiotics,prebiotics and synbiotics in small intestinal bacterial overgrowth:opening up a new therapeutic horizon[J].Indian J Med Res,2014,140(5):582-584.
[2]张 坤,周全州,王宏伟.动物微生态制剂的研究进展[J].中国饲料添加剂,2014(4下):4-7.
[3]杨 华,毛加宁,方绍华,等.微生态制剂对奶牛产奶性能的影响[J].黑龙江畜牧兽医,2013,(1):107-108.
[4]Raeth-Knight M L,Linn J G,Jung H G.Effect of direct-fed microbials on performance,diet digestibility,and rumen characteristics of Holstein dairy cows[J].J Dairy Sci,2007,90(4):1 802-1 809.
[5]Malik R,Bandla S.Effect of source and dose of probiotics and exogenous fibrolytic enzymes(EFE)on intake,feed efficiency,and growth of male buffalo(Bubalusbubalis)calves[J].Trop Anim Health Prod,2010,42(6):1 263-1 269.
[6]徐凤霞,刘 美,李 兵.AIA 法测定小尾寒羊对花生秧及玉米面的消化率的研究[J].饲料博览,2004(3):33-34.
[7]宋增廷,姜 宁,张爱忠,等.谷胱甘肽对肉羊生长性能、屠宰性能及肉品质的影响[J].畜牧与兽医,2008,40(11):14-17.
[8]Hemandez R,Conzalez S S,Pinos-Rodrigues J M,et al.Effect of yeast culture on nitrogen balance and digestion in lambs fed early,and mature orchard grass[J].J Appl Anim Res,2009,35(1):53-56.
[9]Haddad S G,Goussous S N.Effect of yeast culture supplementation on nutrient intake digestibility and growth performance of Awassi lambs[J].J Anim Feed Sci Tech,2005,118(3-4):343-348.
[10]杨 华,吴信明.一株羊瘤胃内产纤维素酶芽孢杆菌的分离鉴定[J].黑龙江畜牧兽医,2013(10):100-101.
[11]Jeyanathan J,Martin C,Morgavi D P.The use of direct-fed microbials for mitigation of ruminant methane emissions:a review[J].Animal,2014,8(2):250-261.
[12]Priolo A,Micol D,Agabriel J,et al.Effect of grass or concentrate feeding systems on lamb carcass and meat quality[J].Meat Sci,2002,62(2):179-185.

