DRD1基因敲除小鼠繁殖模式分析及鉴定
张 宝,魏曙光,范乾瑞,李文浩,李生斌
(西安交通大学医学院卫生部法医学重点实验室,环境与疾病相关基因教育部重点实验室,陕西西安710061)
多巴胺(Dopamine,DA)是儿茶酚胺及苯乙胺家族的一类化学物质,对于人及动物的机体尤其是大脑具有重要的作用。大脑中,由神经细胞分泌的多巴胺作为一种神经递质,具有调节运动、认知、情感、奖赏、神经血管等多种机能[1]。多巴胺受体分布于脊椎动物中枢神经系统中,是一类G 蛋白偶联受体。其中,D1 受体由DRD1基因编码,是中枢神经系统中表达最多的多巴胺受体,调控神经元的生长,介导一些行为应激,同时调控多巴胺D2 受体介导的生理活动。近年来,多巴胺D1 受体功能的研究成为热门,对于该基因敲除小鼠的应用研究也日益增长。本试验通过对敲除杂合子小鼠进行饲养繁殖,以获得DRD1 基因敲除纯合小鼠,为研究多巴胺D1受体功能建立模型,为动物繁育研究提供思路。本文对DRD1基因敲除小鼠的饲养、繁殖及鉴定方法进行了探讨。
1 材料与方法
1.1 试验动物
DRD1基因敲除小鼠由美国芝加哥大学(University of Chicago)徐明教授馈赠引进,饲养于西安交通大学医学部实验动物中心。
1.2 小鼠的饲养和繁殖
小鼠均饲养于西安交通大学医学部实验动物中心的层流动物房内,室内温度为18~22 ℃,相对湿度50%~60%,光照明暗交替12h/d。进出动物房须穿无菌隔离衣、戴口罩、帽子、手套,每天进入层流动物房1次,观察小鼠生长发育情况。鼠盒、垫料均经过高压消毒(131 ℃、5 min),饲料是由北京科澳协力饲料有限公司提供的Co60照射灭菌的饲料,饮水经制水机处理为纯净无菌水。饲料、水自由采食,给与充足,垫料每2~3d更换一次。依照无特定病原体动物(specific pathogen free,SPF)级动物饲养标准进行。仔鼠的性成熟期为60d左右,母鼠妊娠期为21d左右。
1.3 小鼠的基因型鉴定
引进小鼠均为DRD1基因敲除杂合子,最初繁殖采用1雄1雌配对的方式进行饲养,依据孟德尔遗传定律,其子代将出现野生型(DRD1+/+)、敲除杂合子(DRD1+/-)以及敲除纯合子(DRD1-/-)3种基因型,故需要对子代进行鉴定。本课题组采用PCR 的方法进行基因型鉴定。
1.3.1 基因组DNA 提取 剪小鼠脚趾标记,小鼠10~13d时,采取尾尖0.3cm 左右大小组织,利用Chelex-100结合蛋白酶K 消化组织,提取基因组DNA,双蒸水或TE 溶解。测OD 值,4 ℃保存备用。
1.3.2 PCR 反应及琼脂糖凝胶电泳 引物设计参照文献[2],由上海生工合成:D1F 引物1:5'-TAAGCCACCGGAAGTGCTTTC-3';D1R 引物2:5'-AGTTGGTCACCTTGGACC-3';D1R-NEO 引物3:5'-AGCCCAGAAAGCGAAGGAG-3'(上游与D1F共用)。为节省时间和成本,减少单次间的试验误差,简便、快捷、准确地获得试验结果,采用混合引物扩增法。将3条引物按照2∶1∶1混合至10 μmol/L。扩增目的DNA 片断分别为209bp和446 bp。PCR 反应体系(下列组分构成20μL 的反应体系):10μL 2×Taq PCR Mix,4μL 混合引物,2μL模板DNA,灭菌ddH2O4μL 补足至20μL。扩增程序:预变性,95 ℃5min;95 ℃变性30s;55 ℃复性30s,72 ℃延伸35s,进行35个循环;72 ℃,延伸10min;4 ℃保存备用。
取PCR 反应终产物5μL 2%琼脂糖凝胶电泳120V 电泳40 min,凝胶成像系统中分析带型。电泳片段为:野生型209bp一条带(由D1F与D1R 扩增而成);敲除纯合子446bp 一条带(由D1F 与D1R-NEO 扩增而成);敲除杂合子446bp和209bp两条带,按此条带类型可以分析出各基因型小鼠。
1.4 DRD1敲除小鼠分娩数、总产数、平均每胎产数和成活数分析
试验设计四种繁殖方式:a.纯合子雄鼠和杂合子雌鼠交配;b.纯合子雌鼠和杂合子雄鼠交配;c.纯合子雄鼠和纯合子雌鼠交配;d.杂合子雄鼠和杂合子雌鼠交配。对三个月内四种不同交配方式生产仔鼠的分娩数、总产数、平均每胎产数和成活数的差别进行观察比较。

图1 DRD1基因敲除小鼠基因型鉴定1,3,5.敲除纯合子(KO);4.敲除杂合子;2,6,7.野生型(WT)Fig.1 The identification of DRD1knockout mice genotypeLane 1,3,5are DRD1knockout mice(KO);lane 4is heterozygotic mouse;lane 2,6,7are wild mice(WT)
2 结果
2.1 小鼠的繁殖情况
经过多代繁殖,雌雄小鼠均为DRD1敲除纯合子(DRD1-/-)配对成功,繁殖出子代幼鼠。母鼠妊娠期为19~21d,每胎平均约产4~6只仔鼠。
2.2 小鼠基因型鉴定结果
基因型鉴定结果见图1。由图1知,其中1、3、5号泳道出现446bp一条带,为敲除纯合子;4 号泳道出现446bp和209bp两条带型,为敲除杂合子;2、6、7号泳道出现209bp一条带,为野生型。
2.3 不同繁殖模式下DRD1 小鼠的分娩数、总产仔数、平均每胎产仔数和成活数比较
如图2所示,对相等数量小鼠四种不同的交配方式进行观察后发现,d 方法在仔鼠分娩数、总产数、平均每胎产数和成活数上处于最高水平;c方法在仔鼠分娩数、总产数、平均每胎产数和成活数上处于最低水平。其它两种方法a,b的各项数值介于二者之间。说明杂合子的繁殖能力平均高于DRD1-/-小鼠。进一步进行方差分析并进行Bonferroni post-hoc检验后发现,b和c两种方法与d方法相比,在总产数和成活数两方面均较差,且具有统计学意义(*p<0.05,**p<0.01);而a和b两种方法相比,平均的仔鼠成活数、分娩数、平均产数、总产数上a较b高,但是统计结果并无显著性区别。此外,DRD1-/-小鼠做父源或做母源对于大量繁殖DRD1-/-小鼠来讲没有明显差异。上述结果说明d 方法是利用杂合子交配的方式得到DRD1-/-小鼠,产仔数最多,最为有效的方式,但需要每代进行鉴定;而a,b 和c方法作为大量繁育DRD1-/-小鼠可选用的配种方式产仔数较少;c方法作为配种方式虽然产仔数少,但不需每代进行鉴定,相对经济简便。
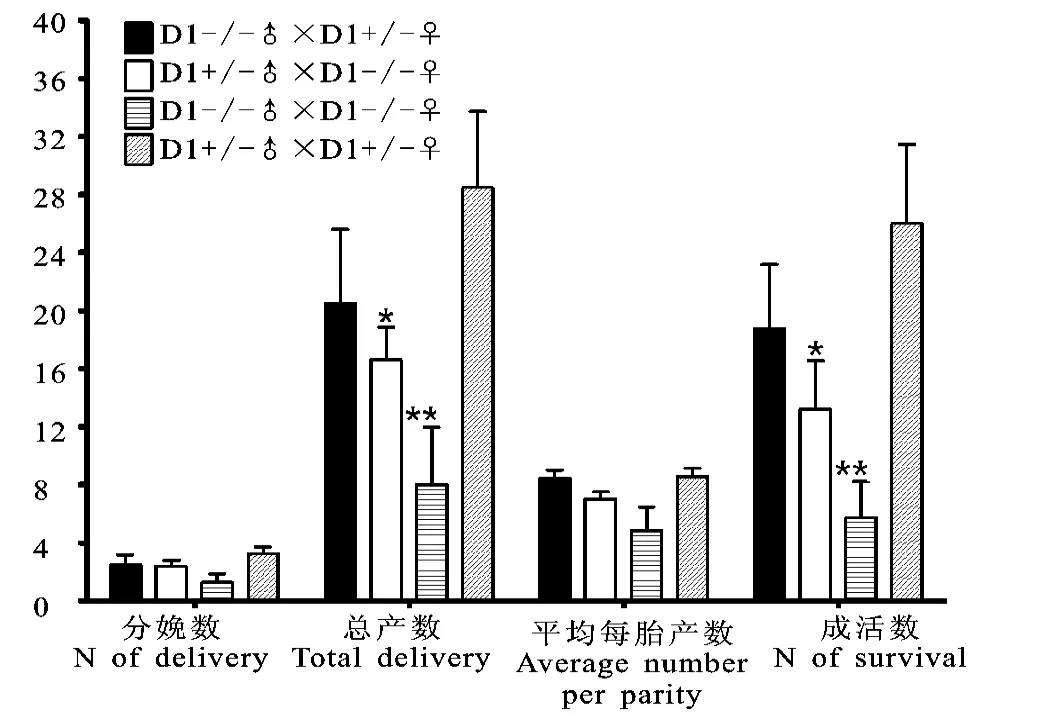
图2 不同交配方式对DRD1-/-小鼠繁殖的影响Fig.2 Different mating mode effect on reproduction of DRD1-/- mice
3 讨论
多巴胺是大脑中主要的儿茶酚胺类神经递质,由中脑质神经元和腹侧被盖区合成,它通过中脑边缘多巴胺通路调控情绪和动机行为,同时它通过与受体相结合发挥多种生物学效应,包括调控运动、认知、摄食、内分泌等多种功能[3-7]。多巴胺受体是由7个跨膜结构组成的G-蛋白藕联受体,它们激活诱导第二信使的形成,激活或抑制特定的信号通路。目前共发现有5种多巴胺受体亚型。其中,人多巴胺D1受体(DRD1)基因定位于5q35,全长约4kb,由两个外显子一个内含子转录446个氨基酸组成蛋白质,在脑内广泛表达,主要存在于伏隔核(Acb),视束(OT),脑皮层(Cx),杏仁核和尾壳核(Cpu)[8]。
多巴胺受体中,D1受体分布最为广泛,对其研究也是治疗神经性疾病的热点之一。研究发现,D1受体激动剂对于帕金森病程的减缓有一定的作用[9]。啮齿类和非人灵长类动物试验发现,DRD1适当激活是形成前额皮质相关认知功能的重要前提,其异常表达均会导致认知功能障碍[10-11]。Xu等研究报道,DRD1突变鼠运动能力未受影响,揭示多巴胺多个受体间具有复杂的相互调节作用[2]。对DRD1突变鼠进行水迷宫训练,发现DRD1突变鼠具有空间学习障碍,但不存在视觉或运动障碍[12]。
对于眼科领域的研究,在细胞水平和动物试验均发现DRD1 激活后可保护损伤的视神经元。揭示DRD1可促进视网膜的发育,可能成为治疗青光眼等眼科疾病的一个分子靶点[9]。通过细胞试验发现DRD1影响脑膜细胞,血管平滑肌细胞和淋巴细胞等多种类型细胞的增殖[13-14]。同时,文献报道DRD1基因与精神分裂症具有相关性,由于样本量或种族差异等原因,结果还不尽一致,需要大样本的后续研究[15-16]。
为了研究多巴胺D1受体相关疾病的需要,本实验室引进DRD1杂合子小鼠,严格按照SPF级要求,饲养于西安交通大学实验动物中心SPF 层流动物房中。依据孟德尔遗传定律,敲除杂合子小鼠交配子代出现3种基因型,即野生型(DRD1+/+)、敲除杂合子(DRD1+/-)及敲除纯合子(DRD1-/-)3种类型,需要进行鉴定。将鉴定出的野生型同野生型,纯合子同纯合子进行交配,子一代即可获得大量野生型(DRD1+/+)和纯合子(DRD1-/-)小鼠,用于试验研究。本研究采用PCR 方法对出生10d左右的小鼠进行基因型鉴定,说明其可作为基因敲除小鼠基因型鉴定的一种可靠快速的方法。通过对DRD1基因敲除小鼠不同繁殖模式下小鼠的分娩数、总产数、平均每胎产数和成活数比较,发现杂合子的繁育能力最强,纯合子之间进行交配繁育能力最低。此外,杂合子与DRD1-/-小鼠进行交配时,DRD1-/-小鼠做父方或做母方在繁殖能力上没有明显的统计学差异。
目前关于动物繁殖的研究大多是集中在下丘脑-垂体-性腺轴(HPG 轴)分泌的激素及其受体基因上[6,17-18]。多巴胺通过与受体结合而发挥生物学功能,主要通过调节促性腺激素释放激素、卵泡刺激素、黄体生成素和催乳素等激素的分泌而调控动物生殖[19-22]。本研究中饲养的DRD1 敲除小鼠表现繁殖能力下降,DRD1基因如何影响繁殖相关基因的表达与调控,如何影响激素水平的具体分子生物学机理还需要深入的研究。
本研究对DRD1基因敲除鼠的成功鉴定,为建立基因敲除鼠模型及探讨疾病的发生机制和基因治疗提供理论依据。分析不同配种类型下小鼠的繁殖数据,DRD1敲除杂合子小鼠较敲除纯合子小鼠繁育能力强,提示DRD1 基因可能影响动物繁育能力,本研究结果为动物繁育研究提供新的研究思路。
[1]侯莉娟,刘晓莉,乔德才.运动疲劳对大鼠纹状体单胺类递质含量及多巴胺受体表达的影响[J].中国康复医学杂志,2010,25(7):639-642.
[2]Xu M,Moratalla R,Gold L H,et al.Dopamine D1Receptor Mutant Mice are Deficient in striatal expression of dynorphin and in dopamine-mediated behavioral-responses[J].Cell,1994,79(4):729-742.
[3]Gingrich J A,Caron M G.Recent Advances in the Molecular Biology of Dopamine Receptors[J].Annual Review of Neuroscience,1993,16(1):299-321.
[4]Almey A,Milner T A,Brake W G.Estrogen receptors in the central nervous system and their implication for dopamine-dependent cognition in females[J].Horm Behav,2015,74:125-138.
[5]Yoshimi K,Kumada S,Weitemier A,et al.Reward-Induced Phasic Dopamine Release in the Monkey Ventral Striatum and Putamen[J].PLoS One,2015,10(6):e0130443.
[6]Roelands B,De Pauw K,Meeusen R.Neurophysiological effects of exercise in the heat[J].Scand J Med Sci Sports,2015,25(S1):65-78.
[7]Gingrich J A,Caron M G.Recent advances in the molecular biology of dopamine receptors[J].Annu Rev Neurosci,1993,16:299-321.
[8]David M.Jackson Anita Westlind-Danielsson.Dopamine receptors:Molecular biology,biochemistry and behavioural aspects[J].Pharmacology & Therapeutics,1994,64(2):291-370.
[9]李 铤,马晓璇,张 堃,等.多巴胺D1 受体在视神经保护中的研究进展[J].中华临床医师杂志,2012,6(23):7 669-7 671.
[10]Murphy B L,Arnsten A F,Goldman-Rakic P S,et al.Increased dopamine turnover in the prefrontal cortex impairs spatial working memory performance in rats and monkeys[J].Proc Natl Acad Sci U S A,1996,93(3):1 325-1 359.
[11]Zahrt J,Taylor J R,Mathew R G,et al.Supranormal stimulation of D1dopamine receptors in the rodent prefrontal cortex impairs spatial working memory performance[J].J Neurosci,1997,17(21):8 528-8 535.
[12]李 凡,舒斯云,包新民.多巴胺受体的结构和功能[J].中国神经科学杂志,2003(6):405-410.
[13]Schrell U M,Fahlbusch R,Adams E F,et al.Growth of cultured human cerebral meningiomas is inhibited by dopaminergic agents.Presence of high affinity dopamine-D1receptors[J].J Clin Endocrinol Metab,1990,71(6):1 669-1 671.
[14]Yasunari K,Kohno M,Kano H,et al.Vascular dopamine-I receptors and atherosclerosis[J].J Atheroscler Thromb,1997,4(2):59-64.
[15]Kojima H,Ohmori O,Shinkai T,et al.Dopamine D1receptor gene polymorphism and schizophrenia in Japan[J].Am J Med Genet,1999,88(2):116-119.
[16]Zhu F,Yan C X,Wang Q,et al.An association study between dopamine D1receptor gene polymorphisms and the risk of schizophrenia[J].Brain Res,2011,1420:106-113.
[17]Prasad P,Ogawa S,Parhar I S.Role of serotonin in fish reproduction[J].Front Neurosci,2015,5(9):195.
[18]Weems P W,Goodman R L,Lehman M N.Neural mechanisms controlling seasonal reproduction:principles derived from the sheep model and its comparison with hamsters[J].Front Neuroendocrinol,2015,37:43-51.
[19]Nargund V H.Effects of psychological stress on male fertility[J].Nat Rev Urol,2015,12(7):373-382.
[20]Su S,Sun X,Zhou X,et al.Effects of GnRH immunization on the reproductive axis and thymulin[J].J Endocrinol,2015,226(2):93-102.
[21]Le Tissier P R,Hodson D J,Martin A O,et al.Plasticity of the prolactin(PRL)axis:mechanisms underlying regulation of output in female mice[J].Adv Exp Med Biol,2015,846:139-162.
[22]Abrieux A,Duportets L,Debernard S,et al.The GPCR membrane receptor,DopEcR,mediates the actions of both dopamine and ecdysone to control sex pheromone perception in an insect[J].Front Behav Neurosci,2014,12(8):312.

