四株纳豆枯草芽孢杆菌的分离筛选与鉴定及其对瘤胃发酵的影响
李吉楠,孙 鹏,赵圣国,李发弟,王加启,卜登攀
(1.甘肃农业大学动物科学技术学院,甘肃 兰州 730070;2.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京 100193)
纳豆枯草芽孢杆菌 (Bacillus subtilis natto,BSN)属细菌科、芽孢杆菌属,大都为革兰氏阳性菌,有鞭毛,能运动,生长温度为5~55℃,芽孢椭圆形或柱状,中生或偏中生,孢子耐热性强[1].BSN具有调节肠道微生物平衡、提高免疫力、提高消化酶活性、促进养分消化吸收、分泌多种活性物质、对环境耐受力强等优点,近年来作为饲用益生菌在畜禽生产中得到广泛应用[2].1999年6月中国农业部公布了12种可直接饲喂动物的饲料级微生物添加剂,枯草芽孢杆菌就是其中的1种[3].随着对BSN的不断研究,其在奶牛上的应用也越来越多,尤其是对瘤胃发酵的影响.Peng等[4]的研究表明在奶牛日粮中添加BSN可以提高产奶量和饲料转化率,增加乳脂产量和乳糖含量,并有降低乳蛋白率的趋势,并且随着纳豆枯草芽孢杆菌发酵物添加浓度的增加,瘤胃丙酸浓度增高,乙酸浓度降低.Mc Gilliard等[5]在给奶牛日粮中添加含芽孢杆菌的微生物添加剂时,奶牛产奶量有所提高.栾广春等[6]研究证明纳豆枯草芽孢杆菌能够显著提高荷斯坦奶牛的产奶量、改善乳脂率、提高乳蛋白率、增加牛奶中干物质含量和降低牛奶中体细胞数.Sun等[7]在奶牛日粮中添加纳豆枯草芽孢杆菌,并不影响IgE,IgA,IgM的分泌,但是能显著增加IgG和细胞因子IFN-γ的分泌,有利于激活免疫系统,提高机体免疫力.在奶牛日粮中添加纳豆枯草芽孢杆菌固体发酵物后总挥发酸、丙酸、戊酸显著升高,乙酸以及乙酸/丙酸显著降低[8].本文分别从无菌大豆、接种稻草的无菌大豆、接种市售纳豆的无菌大豆、接种实验室储存菌株纳豆枯草芽孢杆菌NY3的无菌大豆中筛选出蛋白酶和纤维素酶活性菌较高的4株菌株,拟通过体外批次发酵试验,评价4株菌对瘤胃发酵参数的影响,旨在为纳豆枯草芽孢杆菌的研究及其在反刍动物上的应用提供科学依据,并对其发挥作用的机理做出假设.
1 材料与方法
1.1 试验材料
1.1.1 菌种筛选 黄豆:从超市购买的黄豆浸泡24h后等量分装至三角瓶中,121℃高压蒸汽灭菌30min;稻草:粉碎后用98℃烘箱烘干30min,利用芽孢杆菌耐热的特性除去稻草上的杂菌;市售纳豆:北京产燕京牌纳豆;实验室储存菌株纳豆枯草芽孢杆菌NY-3.菌种培养基:斜面培养基,种子培养基,液体发酵培养基,酪蛋白平板,羧甲基纤维素钠平板,配制方法参考奚晓琦[9]、孙妍[10]等的研究.
1.1.2 瘤胃液供体动物 北京中地种畜有限公司试验基地选取3头健康且装有永久性瘤胃瘘管的荷斯坦奶牛作为瘤胃液供体牛(BW=(558±10)kg,DIM=(136±37)d,胎次=3).奶牛每天饲喂3次(7∶00,13∶00和19∶00),自由饮水.
1.1.3 试验日粮 试验日粮选择与瘤胃液供体奶牛相同的全混合日粮,日粮组成和营养水平如表1所示.
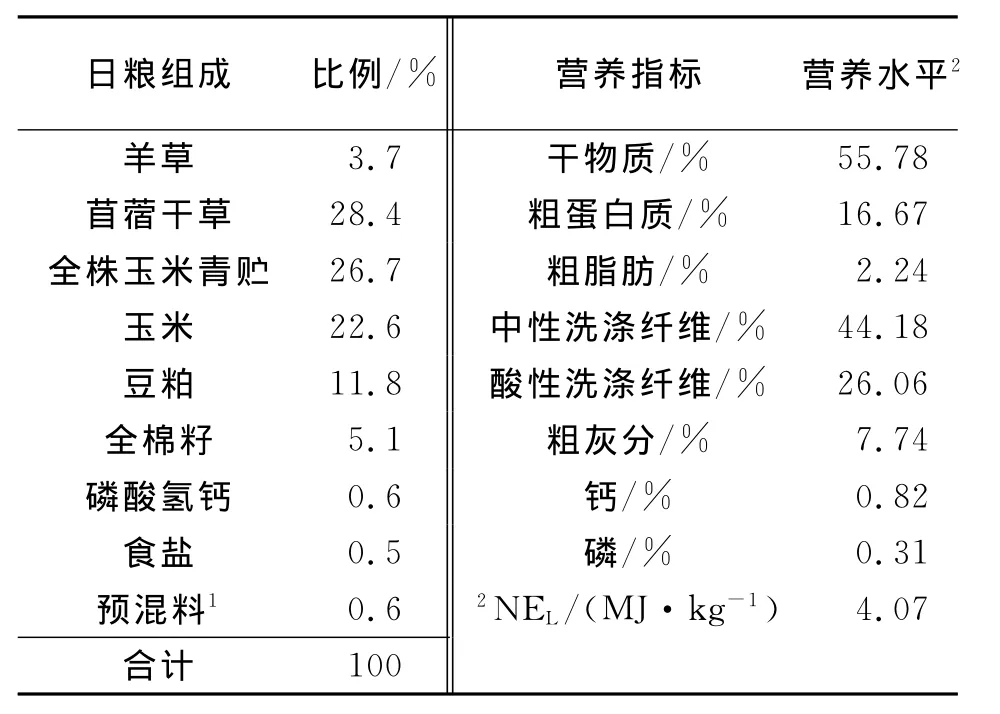
表1 基础饲粮组成及营养水平(干物质基础)Tab.1 Composition and nutrient levels of dietary(DM basis)
1.2 试验方法
1.2.1 四株不同来源菌株的培养与初筛 取适量黄豆,清水浸泡24h后平均分为4份,经121℃高压蒸汽灭菌30min后,一份接种适量稻草(DC组),一份不接种任何外来菌种(DD组),一份接种市售纳豆(ND组),一份接种实验室储存菌株NY-3(NY组),在39℃恒温培养箱中培养48h.在无菌条件下制备菌悬液,用8.5%的生理盐水10倍梯度稀释[11]涂布在酪蛋白平板、羧甲基纤维素钠平板,在37℃条件下培养24h后,用游标卡尺测量水解圈直径与菌落直径的比值(Hc值),选择Hc较大且具有枯草芽孢杆菌典型菌落特征的菌落进行平板划线分离至纯,编号为DD、DC、ND、NY.
1.2.2 16SrRNA菌种鉴定 对筛选出的菌株采用CTAB结合珠磨法[12]提取DNA,经PCR扩增后,送往北京六合华大科技股份有限公司测序.PCR扩增所使用的引物为27f(5′-AGAGTTTGATCCTGGCTCAG-3′) 和 1492r(5′-GGTTACCTTGTTACGACTT-3′)[13],反应体系设定为50μL体系(Gen Star 2×Taq PCR Star Mix with loading Pye 25μL;DNA2μL;PCR Forward Primer 47F1μL;PCR Reverse Primer 1492R1μL;灭菌去离子水21 μL).PCR扩增程序为94℃预变性3min;94℃变性30s,66℃退火30s,-0.5℃/循环,72℃延伸30 s,10个循环;94℃变性30s,57℃退火30s,72℃延伸30s,25个循环;72℃延伸10min.
1.2.3 体外发酵所用枯草芽孢杆菌培养物的制备取斜面培养基上保存的两环菌种,接种于装有30mL种子培养基的250mL锥形瓶中,37℃、180r/min培养24h.取体积分数2%的种子液接种于装有400mL发酵培养基的1 000mL锥形瓶中,37℃、180r/min培养24h.用稀释涂布平板法进行菌落计数.
1.2.4 体外发酵试验 试验采用5×2二因素设计,因素一为5种不同的添加菌株(空白,DC菌株、DD菌株、ND菌株、NY菌株),因素二为不同时间点(0、24h).试验期为24h,每个处理的每个时间点设置3个平行,试验重复发酵两期.
试验前向每个发酵瓶(血清瓶)中称取0.5g TMR基础日粮作为发酵底物,再向每个发酵瓶中添加60mL 39℃预热的 Menke[14]瘤胃缓冲液,试验中取发酵后的菌液100mL,5 000 g离心10min后,弃去上清液,将菌体沉淀添加到发酵瓶中,使每个发酵瓶中每种菌株的添加剂量均为1.5×1011cfu左右.采集瘤胃液后用四层纱布过滤并迅速向每个发酵瓶加30mL,同时持续充CO230s以赶走瓶中空气,盖紧橡胶塞及铝盖并用压杆器压紧瓶口,将发酵瓶放到恒温震荡培养箱中恒温发酵,设定发酵温度为39℃,转速为50r/min.
1.3 样品采集与测定
发酵24h后将发酵瓶放在冰中终止发酵(0h的添加完瘤胃液后立即取样),从发酵瓶中采集发酵液,立即用pH 计(Sartorius,PB-10)测定发酵液的pH值.将样品分装后于-40℃冷冻保存,用于VFA和NH3-N等指标的测定.
1.3.1 发酵液中NH3-N浓度的测定 发酵液中NH3-N浓度利用靛酚比色法[12]测定.瘤胃液中的氨与次氯酸钠及苯酚试剂在亚硝基铁氰化钠催化下反应生成蓝色靛酚,通过测定蓝色靛酚的吸光度可以得到样品中氨的浓度.
1.3.2 发酵液中VFA浓度的测定 VFA浓度利用气相色谱(Agilent 6890NGC system,Agilent,A-merica)以外标法测定[12].色谱条件如下:以氮气作为载气,色谱柱:DB-FFAP(15m×0.32mm×0.25μm).柱温:70 ℃,3 ℃/min至125 ℃,再以30℃/min至180℃,保持5min.进样口温度:250℃.检测器温度:280℃.恒压:25kPa.分流比:1∶20.进样量:2μL.
1.4 数据处理
对数据使用Excel 2007进行初步整理后,采用SAS 9.2软件中的GLM模型进行统计分析,显著水平为α=0.05,采用Tukey方法进行多重比较.
2 结果与分析
2.1 菌株初筛结果
观察筛选出的菌株的菌落形态并与模式菌株纳豆枯草芽孢杆菌菌株N1比较,结果如表2所示,从表可以看出4株枯草芽孢杆菌菌落形态与模式菌株相似.筛选菌落在酪蛋白平板和羧甲基纤维素钠纤维素钠平板上均产生透明的水解圈(图1),每组菌株筛选出水解圈最大的菌株3株,命名为DD组(DD1、DD2、DD3)、DC 组(DC1、DC2、DC3)、ND 组(ND1、ND2、ND3)、NY 组 (NY3-1、NY3-2、NY3-3).
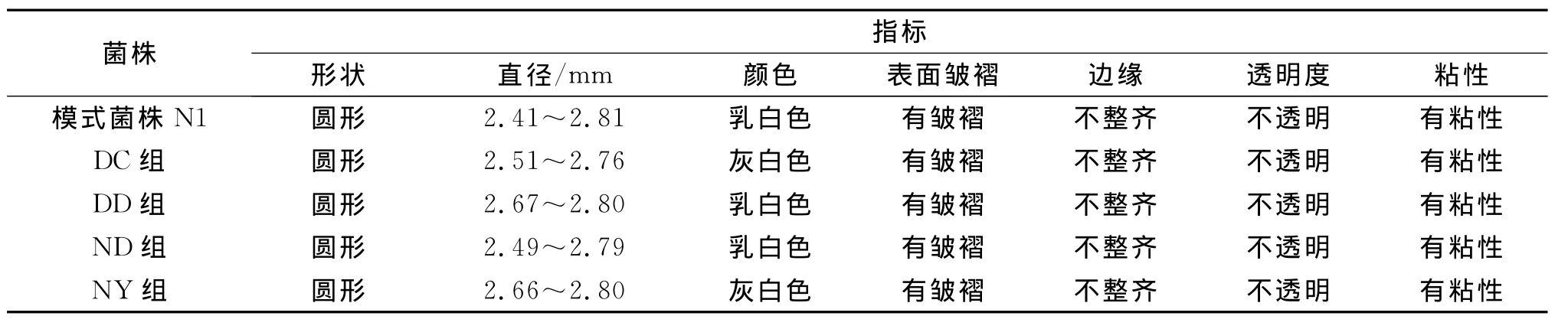
表2 分离筛选芽孢杆菌的菌落特性Tab.2 Lawn characters of screened Bacillus
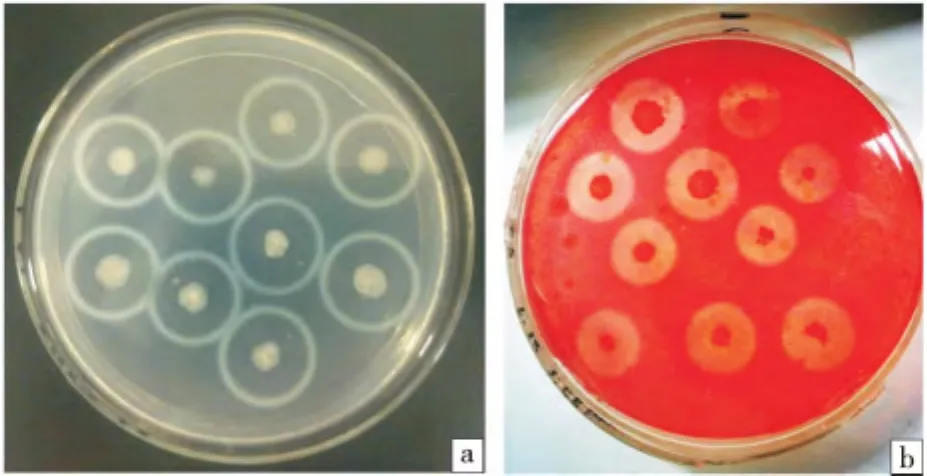
图1 筛选出的枯草芽孢杆菌在酪蛋白平板(a)和羧甲基纤维素钠平板(b)上的水解圈Fig.1 The hydrolytic circles of screened Bacillus subtilis natto on Casein-plate(a)and CMC-plate(b)
2.2 菌株16SrRNA菌种鉴定结果
从水解圈较大的DD组、DC组、ND组、NY组中各选择2株菌株的16SrRNA扩增序列通过CLUSTAL X软件与GenBank中的已知序列进行DNA序列的相似性分析比对,结果,检测菌株与纳豆枯草芽孢杆菌(AY864812:Bacillus subtilis subsp.natto)的相似度达99.9%以上(图2),表明4组菌均为纳豆枯草芽孢杆菌.
2.3 菌落计数结果
选择 DC1、DD1、ND2、NY3-1四株菌株用稀释涂布平板法进行菌落计数,结果分别为1.50×109、1.53×109、1.00×109、1.92×109cfu/mL.
2.4 不同来源枯草芽孢杆菌添加对瘤胃微生物发酵参数的影响
从表3可以看出,与对照组相比添加枯草芽孢杆菌并不影响瘤胃液pH值,但显著提高了氨氮浓度和VFA浓度,其中ND组和NY组的氨氮浓度显著高于DC组和DD组.与对照组相比,DC组的乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸及总挥发酸分别提高20.62%,22.78%,87.59%,24%,91.10%,94.50%,24.71%(P<0.05);DD组的乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸及总挥发酸分别提高15.04%,19.05%,63.87%,17.11%,61.38%,65.73%,18.4% (P<0.05);ND组乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸及总挥发酸分别提高17.07%,24.63%,98.54%,18.37%,102.75%,96.12%,22.61%(P<0.05);NY 组乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸及总挥发酸分别提高11.68%,21.54%,72.99%,11.31%,76.61%,71.12%,16.59%(P<0.05).总之,与对照组相比,乙酸、丁酸产量DC组最高(P<0.05),NY组最低(P<0.05),DD和 ND组间差异不显著;丙酸、戊酸产量DC组和ND组最高(P<0.05)但二者之间差异不显著(P>0.05),DD组最低(P<0.05),异丁酸、异戊酸各组间差异显著(P<0.05),总挥发酸(TVFA)DC和 ND组显著高于DD、NY组(P<0.05).与对照组相比,DC组的乙酸/丙酸差异不显著(P>0.05),但是DD、ND组和NY组均有显著降低,分别降低1.6%,3.32%,4.95%(P<0.05).
3 讨论与结论
3.1 纳豆枯草芽孢杆菌的分离筛选与鉴定

图2 DC组、DD组、ND组、NY组菌株与纳豆枯草芽孢杆菌16SrDNA基因片段序列比对结果Fig.2 Contrast results of 16SrDNA gene sequence among DC,DD,ND,NY and Bacillus subtilis natto strain(AY864812)
枯草芽孢杆菌广泛的存在于自然界中,其在增殖过程中能产生大量活性物质,如γ-多聚谷氨酸[15]、纳豆激酶[16]、吡嗪酰胺[17]和蛋白酶、纤维素酶等各种消化酶类.其中,蛋白酶和纤维素酶等消化酶类能促进消化道生长发育,提高饲料消化利用率[18],提高畜禽的生长性能和生产性能[19].本试验亦是根据其能够产生纤维素分解酶和蛋白分解酶的特性采用酪蛋白平板法和羧甲基纤维素钠平板法分离得到了高产蛋白酶和纤维素酶的纳豆枯草芽孢杆离筛选出蛋白酶和纤维素酶活性较高的菌株DD、DC、ND、NY,奚晓琦[9]、孙妍[10]也采用相同的方法得到了高产蛋白酶和纤维素酶的纳豆枯草芽孢杆菌.纳豆芽孢杆菌接种在非选择性分离培养基(LB培养基),可利用芽孢杆菌耐热的特性,采用80水浴15min除去营养细胞和基质中的杂菌后,根据培养基上菌落形态对纳豆芽孢杆菌芽孢进行计数.菌落的计数方法有显微镜直接计数法,平板菌落计数法,光电比浊计数法[20],由于平板菌落计数法可以获得活菌的信息而被本试验所采用.
传统生理生化试验的菌种鉴定方法由于试验周期长,准确性差而逐渐被基因的序列测定取代,聚合酶链反应(PCR)和DNA碱基序列测定技术的结合为细菌的分类和鉴定提供了一种快速、准确的方法[21].rRNA基因被称为细菌的“活化石”,为高度保守基因,基因序列具有细菌属、种的特征,因而基因的序列测定已作为细菌分类和鉴定的“金标准”[22].本试验通过 CLUSTAL X 软件与 GenBank中的已知纳豆枯草芽孢杆菌(AY864812:Bacillus subtilis subsp.natto)序列进行DNA序列的相似性分析比对,检测菌株与纳豆枯草芽孢杆菌AY864812的相似度达99.9%以上.
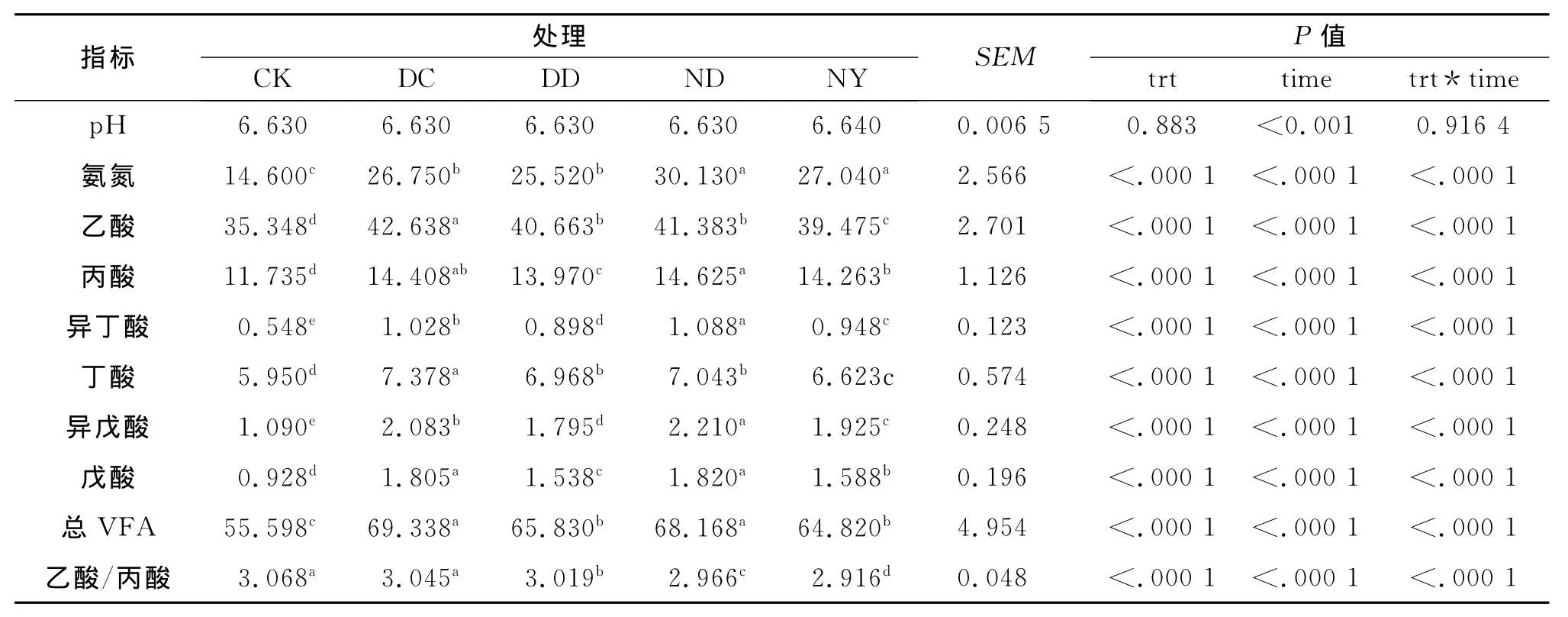
表3 不同来源的四株枯草芽孢杆菌对体外瘤胃发酵的影响Tab.3 Effect of different sources of Bacillus sbutilis natto on rumen fermentation in rumen mixed cultures in vitro
3.2 纳豆枯草芽孢杆菌对瘤胃液pH及氨氮的影响
对枯草芽孢杆菌在动物上应用的早期研究主要是其对单胃动物的影响[23-24],枯草芽孢杆菌的芽孢主要以营养细胞的活性形式在动物体的消化过程中存在,并在消化道内萌发繁殖最终通过粪便排出[25].BSN在瘤胃液发酵过程中芽孢数呈先增高后降低的趋势,能耐受奶牛瘤胃液环境,并能影响瘤胃发酵,但不能在奶牛胃肠道中定植[26].本试验中添加不同的菌株对瘤胃pH值的影响不显著,这与丁洪涛等[27]的研究一致.但邓露芳通过体外产气法[28]评价纳豆芽孢杆菌对瘤胃液体外发酵的影响,研究证明纳豆枯草芽孢杆菌能降低瘤胃pH,在通过人工瘤胃持续发酵体系[29]研究添加不同浓度BSN对瘤胃微生物发酵的影响中证明BSN能控制人工瘤胃内pH值的下降幅度,维持在6.58~6.90之间,从而更有利于瘤胃纤维分解菌的生长繁殖[30],Sun对奶牛饲喂纳豆枯草芽孢杆菌后发现瘤胃中pH有所降低[8].一般瘤胃中的pH值是食糜中VFA与唾液中缓冲盐相互作用、以及瘤胃上皮对VFA吸收及随食糜流出等因素综合作用的结果[31].而影响瘤胃pH的最主要因素是瘤胃中挥发性脂肪酸产生的速度和数量[32]多数研究认为微生态菌制剂有利于稳定瘤胃pH,从而可以降低瘤胃酸中毒的危害,加之,在体外试验中所用缓冲液强大的缓冲能力,使本试验中pH值差异不显著.此外,瘤胃液中的CO2对瘤胃pH值有很大影响,瘤胃液被采集后,应立即进行测定,否则部分CO2被释放后,可造成瘤胃pH值的测定有较大的误差[31].
瘤胃中的氨态氮(NH3-N)是反应瘤胃氮代谢水平的重要指标,氨氮浓度与日粮中蛋白质在瘤胃中的降解程度有关,通过测定瘤胃中氨氮浓度可以间接反应瘤胃微生物分解饲料粗蛋白产生氨氮和利用氨氮合成微生物体蛋白的平衡情况,瘤胃NH3-N浓度与日粮降解氮对微生物氮的转化效率间呈曲线负相关[31],氨氮浓度的适宜范围为5~30mg/dL,如果超出此范围,说明瘤胃氨氮利用处于失衡状态[12].本试验所有处理的氨氮浓度均处于适宜范围之内,并且添加BSN均能显著的提高瘤胃液中氨态氮的浓度,这表明日粮中添加BSN对瘤胃氮代谢和微生物蛋白的形成有一定的负面影响,由于瘤胃原虫对细菌的吞食作用是降低瘤胃微生物蛋白质合成量的重要因素[33],BSN可能促进了瘤胃原虫的生长从而抑制了瘤胃微生物蛋白的合成,邓露芳[34]用纳豆枯草芽孢杆菌BSN2饲喂奶牛时,检测到瘤胃液中NH3-N浓度增加,同时原虫数量也增加,从而印证这一假设.Sun[8]也得到相同结果,Ghorbani等[35]在奶牛日粮中添加丙酸杆菌时,检测到瘤胃中原虫数量大增,从而加速了瘤胃细菌的N循环,进而增加瘤胃液中氨氮浓度.
3.3 纳豆枯草芽孢杆菌对瘤胃液VFA的影响
挥发性脂肪酸(VFA)既是碳水化合物在瘤胃的终产物,也是瘤胃微生物生长所需的重要碳架和能量来源,主要包括甲酸、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和己酸等,可为机体提供所需可消化能的70%~80%[31].本试验中各种VFA浓度与对照组相比均有不同程度的升高,这与邓露芳的体外发酵试验结果相一致,但乙酸浓度显著提高与Peng[4],Sun[8]研究结果相反.在各种 VFA 中,乙酸是反刍动物代谢所需能量的主要来源,丙酸是反刍动物重要的葡萄糖前体.试验中VFA浓度增加的可能原因一方面是枯草芽孢杆菌的活菌体可以分泌纤维素酶、蛋白酶和淀粉酶等胞外酶[36],从而提高动物消化道中相应酶的活性,进而促进碳水化合物分解,提高饲料消化利用率[37];另一方面添加枯草芽孢杆菌能够增加瘤胃细菌的数量,尤其是溶纤维丁酸弧菌、黄色瘤胃球菌和白色瘤胃球菌等纤维分解菌,以及两种典型的淀粉分解菌—牛链球菌和嗜淀粉瘤胃杆菌的数量[34].纤维素分解菌的增加可以使乙酸比例升高,淀粉分解菌的代谢终产物多为丙酸[38]其大量繁殖可以使丙酸产量增加[39],此外,枯草芽孢杆菌的添加能够增加瘤胃中原虫的数量,原虫可直接利用饲料底物中的植物纤维和淀粉,使其转化为挥发性脂肪酸[31],尤其是能导致瘤胃中丁酸产量的增加[40].
饲料的种类和微生物的区系不同,发酵产生乙酸与丙酸比(乙/丙)也不同,瘤胃液乙/丙可反映饲料在瘤胃中的发酵模式,通常情况下,当日粮中的纤维素和半纤维素相对于可溶性碳水化合物和淀粉的含量上升时,乙酸/丙酸比例也上升.日粮中的添加剂通过选择性抑制某些类型的细菌和原虫增殖来改变发酵类型,人们一直在寻找能使丙酸比例增加的添加剂.丙酸是葡萄糖异生作用的主要前体物质[38],对糖异生作用贡献为32%~73%[41].本次试验中,与对照组相比,DC组的乙/丙差异不显著,DD组、ND组和NY组的乙/丙均有显著降低使瘤胃发酵模式变为丙酸型发酵.这表明不同接种来源的枯草芽孢杆菌均能提高瘤胃中VFA的浓度,但提高程度不同,对瘤胃发酵类型的改变也不同.
动物采食日粮后,瘤胃中发酵产生的VFA迅速增加,同时瘤胃上皮对VFA吸收及向后部消化道流出速度也随之加快,从而引起瘤胃中VFA的浓度开始下降[42].然而本试验为静态批次培养,其产生的VFA不能够被瘤胃壁吸收,也不能通过后部消化道排出,因此随培养时间的延长,本试验记录的VFA的产量逐渐升高.这也可能是本试验中乙酸变化与其他体内试验不同的原因.
经酪蛋白平板和羧甲基纤维素钠(CMC-Na)平板初筛及16srRNA测序鉴定后,确定分离筛选出的四株菌株DC、DD、ND、NY均为纳豆枯草芽孢杆菌;日粮中添加枯草芽孢杆菌并不改变体外静态批次发酵瘤胃液的pH;纳豆枯草芽孢杆菌导致瘤胃内环境NH3-N浓度升高,对瘤胃微生物氮代谢有一定的负面影响作用,这可能与其促进了瘤胃原虫生长有关;纳豆枯草芽孢杆菌提高了瘤胃液中挥发性脂肪酸各成分含量,提高了瘤胃微生物对碳水化合物的消化代谢能力,但不同接种来源的枯草芽孢杆菌提高VFA的程度不同;除DC菌株外,其余的枯草芽孢杆菌均能降低乙酸/丙酸,从而改变瘤胃发酵类型,使其向丙酸型发酵.
[1] 布坎南R E,吉布斯N E.伯杰氏细菌学鉴定手册[M].北京:科学出版社,1984
[2] Sun P,Wang J Q and Zhang H T.Effects of supplementation of Bacillus subtilis natto Na and N1strains on rumen development in dairy calves[J].Animal Feed Science and Technology,2011,164:154-160
[3] 胡东新,潘康成.微生态制剂及其作用机理[J].中国饲料,2001(3):14-16
[4] Peng H,Wang J Q,Kang H Y et al.Effect of feeding Bacillus subtilis natto fermentation product on milk production and composition,blood metabolites and rumen fermentation in early lactation dairy cows[J].J Animal Physiology and Animal Nutrition,2012,96:506-512
[5] McGilliard M L,Stallings C C.Increase in milk yield of commercial dairy herds fed a microbial and enzyme supplement[J].Journal of Dairy Seience,1998,81(5):1353-1357
[6] 栾广眷,王加启,卜登攀,等.纳豆芽孢杆菌对泌乳期奶牛产奶量、牛奶品质的影响[J].东北农业大学学报.2008,39(9):58-61
[7] Sun P,Wang J Q and Zhang H T.Effects of Bacillus subtilis natto on performance and immune function of preweaning calves[J].Journal of Dairy Science,2010,93(12):5851-5855
[8] Sun P,Wang J Q,and Deng L F.Effects of Bacillus subtilis natto on milk production,rumen fermentation and ruminal microbiome of dairy cows[J].Animal,2012,8:1-7
[9] 奚晓琦,王加启,卜登攀,等.产蛋白酶和纤维素酶纳豆芽孢杆菌(Bacillus sbutilis)的筛选及其生物特性研究[J].中国畜牧兽医,2011,38(1):33-38
[10] 孙妍,王加启,奚晓琦,等.产蛋白酶和纤维素酶纳豆芽孢杆菌益生菌株的筛选及其生长特性研究[J].东北农业大学学报,2011,42(3):39-43
[11] 黄青云.畜牧微生物学[M].3版.北京:中国农业出版社,2005
[12] 王加启.反刍动物试验研究方法[M].北京:现代教育出版社,2011
[13] Qin H B,Yang H J,Qiao Z J,et al.Identification and Characterization of a Bacillus subtilis strain HB-1isolated from Yandou,a fermented soybean food in China[J].Food Control,2013,31:22-27
[14] Menke K H,Steingass H.Estimation of energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J].Anim Feed Sci Technol,1988,28:91-97
[15] Ogawa Y,Yamaguchi F,Yuasa K,et al.Efficient production ofγ-polyglutamic acid by Bacillus subtilis(natto)in jar fermenters[J].Bioscience,Biotechnology and Biochemistry,1997,61(10):1684-1687
[16] Sumi H,Hamada H,Tsushima H,et al.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto:a typical and popular soybean food in the Japanese diet[J].Cellular and Molecular Life Sciences,1987,43(10):1110-1111
[17] Besson I,Creuly C,Gros J B,et al.Pyrazine production by Bacillus subtilis in solid-state fermentation on soybeans[J].Applied Microbiology and Biotechnology,1997,47(5):489-495
[18] Samanya M,Yamauchi K.Histological alterations of intestinal villi in chickens fed dried var.Natto[J].Conparative Biochemistry and Physiology-Part A:Molecular and Integrative Physiology,2002,133(1):95-104
[19] 张海涛,王加启,卜登攀,等.日粮中添加纳豆芽孢杆菌对断奶后犊牛生长性能的影响[J].动物营养学报,2008,20(2):158-162
[20] 沈萍,陈向东.微生物学[M].2版.北京:高等教育出版社,2006:50-150
[21] 彭涛,温博海,蹇锐,等.分支杆菌临床分离株的16S-23SrRNA基因转录间隔区的序列分析[J].中国人兽共患病杂志,2004,20(9):777-781
[22] 温博海.立克次体16SrRNA基因分析[J].中国人兽共患病杂志,1999,15(6):18-20
[23] Hoa T T,Duc L H,Isticato R,et al.Fate and dissemination of Bacillus subtilis spores in amurine model[J].Appl Environ Microbiol,2001,67(9):3819-3823
[24] Jayaraman S,Thangavel G,Kurian H R,et al.Bacillus subtilis PB6improves intestinal health of broiler chickens challenged with Clostridiumperfringens-induced necrotic enteritis[J].Poult Sci,2013.92(2):370-374
[25] Leser T D,Knarreborg A,Worm J,et al.Germination and outgrowth of Bacillus subtilis and Bacillus lichenif or miss pores in the gastrointestinal tract of pigs[J].J Appl Microbiol,2008,104(4):1025-1033
[26] 董淑慧,王加启,彭华,等.纳豆芽孢杆菌在奶牛瘤胃和十二指肠存活规律[J].中国农业大学学报,2011,16(5):104-109
[27] 丁洪涛,夏冬华,秦珊珊,等.枯草芽孢杆菌对奶牛体外瘤胃发酵的影响[J].饲料研究,2012,(1):57-59
[28] 邓露芳,王加启,姜艳美,等.产气法评价纳豆芽孢杆菌对瘤胃液体外发酵的影响[J].西北农林科技大学学报:自然科学版,2008,36(9):33-39
[29] 邓露芳,王加启,姜艳美,等.纳豆芽孢杆菌对瘤胃微生物发酵的影响[J].畜牧兽医学报,2008,39(8):1062-1068
[30] 陈喜斌,冯仰廉.日粮降解氮转化为瘤胃微生物氮效率影响因素研究[J].中国畜牧杂志,1995(4):3-5
[31] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004
[32] 张蓉,刁其玉.不同碳水化合物对犊牛消化生理功能的研究进展[J].乳业科学与技术,2007(5):216-218
[33] 赵广永,冯仰廉.绵羊瘤胃水平衡、瘤胃发酵与微生物蛋白合成[J].中国动物营养学报,1993,5(2):62-63
[34] 邓露芳.日粮添加纳豆枯草芽孢杆菌对奶牛生产性能、瘤胃发育及功能微生物的影响[D].北京:中国农业科学院研究生院,2009
[35] Ghorbani G R,Morgavi D P,Beauchemin K A,et al.Effects of bacterial direct-fed microbials on ruminal fermentation,blood variables,and the microbial populations of feedlot cattle[J].J Anim Sci,2002,80(7):1977-1985
[36] Tietyen J L,Nevins D J,Shoemaker C F,et al.Hypocholesterolemic potential of oat bran Treated with an endo-β-D-glucanase fromBacillus subtilis[J].J Food Sci,1995,60(3):558-560
[37] Hosoi T,Ametani A,Kiuchi K,et al.Improved growth and viability of lactobacilli in the presence of Bacillus subtilis(natto),catalase,or subtilisin[J].Can J Microbiol,2000,46(10):892-897
[38] Drackley J K,Biology of dairy cows during the transition period:the final frontier[J]Journal of Dairy Science 1999,82(11):2259-2273
[39] 张海涛,王加启,卜登攀,等.影响犊牛瘤胃发育的因素研究[J].乳业科学与技术,2008,129(2):86-89
[40] Eugène M,Archimède H,Michalet-Doreau B,et al.Effects of defaunation on microbial activities in the rumen of rams consuming a mixed diet(fresh Digitaria decumbens grass and concentrate)[J].Anim Res,2004,53:187-200
[41] Seal C J and Reynolds C K.Nutritional implications of gastrointestinal and liver metabolism inruminants[J].Nutrition Research Reviews,1993,6(1):185-208
[42] 尹召华,王梦芝,王洪荣,等.乙酸与丙酸比对体外瘤胃液挥发性脂肪酸发酵模式和微生物群体多样性的影响[J].动物营养学报,2011,23(12):2129-2135

