干旱胁迫下马铃薯差异表达基因的验证分析
王 洁,贺文辉,刘 英,张 宁,司怀军,王 蒂
(1.甘肃省干旱生境作物学省部共建国家重点实验室培育基地,甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
干旱严重影响农作物生产,是制约作物生产的环境因素之一.马铃薯是世界主要农作物之一,其产量和质量受干旱的影响非常明显.为了提高马铃薯的产量和品质,探明马铃薯抗旱的机制,选育抗旱优良品种、筛选优秀种质资源有着极其重要的意义.
国内外在干旱对马铃薯生长发育的影响、马铃薯抗旱性的调控方面进行了较多研究[1].近年来的生理研究表明,马铃薯抗旱能力相对较强[2],生产上推广的栽培品种由于遗传背景的差异,对干旱的耐受能力也不同[3].抗旱性是一个多基因控制的数量性状[4],加之对干旱胁迫下产量形成的生理基础了解不够,以及其它非生物胁迫的共同作用加大了干旱胁迫下改良作物抗旱性的复杂性.高通量测序不依赖基因组序列信息,因而成为研究植物胁迫响应基因差异表达的更好选择,尽管基因组序列不全给差异表达标签的注释带来一定困难,但所获得的表达谱信息能够真实反映胁迫响应机制.qRT-PCR技术具有准确性高、特异性好、假阳性低的优点,越来越多地被用于植物差异表达基因的检测.这些技术的发展极大地促进了干旱机理的研究[5].
本研究通过对干旱处理和对照马铃薯材料进行Solexa高通量测序,本研究应用qRT-PCR方法对Solexa高通量测序中log2(fold change)≥11倍的22个差异基因进行验证,研究干旱胁迫下马铃薯22个基因的表达变化,以期了解干旱胁迫下不同基因的表达情况,为马铃薯抗旱相关基因功能研究和解析抗旱机理提供一定的基础.
1 材料与方法
1.1 植物材料和干旱处理
采用马铃薯栽培品种‘陇薯3号’为试验材料.将马铃薯切成小块(确保每个小块包含2~3个芽眼)种于花盆(直径20cm,高19.5cm)中,每盆每天上午9点浇水800mL,待马铃薯幼苗长至40cm左右高时,对其进行胁迫处理.将生长整齐一致的马铃薯幼苗分为2组,一组加入20%PEG6000溶液模拟干旱处理1、6、12h,另一组正常供水作为对照.干旱胁迫处理结束后取马铃薯完全展开叶片、混合,液氮速冻,-80℃保存.
1.2 RNA提取和反转录
用RNAsimple Total RNA Kit提取对照和干旱处理马铃薯材料的总RNA,用超微量紫外可见分光光度计对提取的RNA进行纯度和浓度测定,琼脂糖凝胶电泳鉴定所提RNA的完整性.按照反转录试剂盒(TaKaRa公司的 PrimeScriptTMRT reagent Kit with gDNA Eraser)说明书将RNA反转录成cDNA.
1.3 实时定量PCR(qRT-PCR)检测
选取Solexa高通量测序中log2(fold change)≥11倍的22个差异基因,根据Spud DB Potato Genomics Resource上登记的基因序列设计特异性引物(表1),由上海Sangon生物公司合成.使用定量试剂盒(TaKaRa公司的SYBR Premix Ex TaqTMGC)进行qRT-PCR,反应体系为20μL,仪器为Stratagene实时荧光定量PCR仪(Mx3005P),引物的终浓度为10μmol/L,循环步骤为:预变性95 ℃、5s、1个 循 环;PCR 95 ℃、5s,60 ℃、34s,40个循环;解离95 ℃、15s,60 ℃、1min,95 ℃、15s,1个循环.efla基因作为内参基因,对处理和对照材料进行相对定量分析,每个样品3个重复.反应结束后确认qRT-PCR反应的扩增曲线和熔解曲线.
1.4 数据分析
检测干旱处理组和对照组的22个目的基因和每组的内参基因,将目的基因归一化,反应结束后得到每个反应体系内目的基因和内参基因的CT值.采用2-△△CT法[6]分别计算各目的基因相对表达量,其数值用于表示目的样本相对于参照样本目的基因的相对倍数.计量资料以表示,两组间均数比较采用t检验,P<0.05为差异有统计学意义.使用SPSS 19.0软件和 GraphPad Prism5软件进行统计和做图分析.

表1 qRT-PCR所用的特异性引物Tab.1 The special primers used by qRT-PCR
2 结果与分析
2.1 qRT-PCR的可靠性和稳定性
qRT-PCR的熔解峰图与熔解曲线的分析可以得出,各目的基因与内参基因的扩增产物在温度升至Tm处呈现出单一的峰,说明无非特异性产物和引物二聚体产生,扩增特异性高.各目的基因及内参基因的扩增曲线呈S形,无杂峰,40个循环完成时,扩增曲线均达到平台期.
2.2 干旱诱导的基因表达差异分析
2.2.1 干旱处理马铃薯转录因子的表达分析 检测6个转录因子的干旱处理组相对于对照组的各目的基因变化倍数见图1.AP2/ERF结构域转录因子、WRKY转录因子3、MYB转录因子和bHLH 转录因子在干旱胁迫1、6、12h均上调表达,并且AP2/ERF结构域转录因子、MYB 转录因子和bHLH转录因子表达量逐渐升高,而WRKY转录因子3的表达量在6h达到最大,表明AP2/ERF结构域转录因子、WRKY转录因子3、MYB转录因子和bHLH转录因子对干旱胁迫有一定的应答反应,并且12h干旱胁迫下表达量显著升高;热激转录因子HSFA9 HSFA9和类Myb转录因子在渗透胁迫1、6、12h均下调表达,并且热激转录因子HSFA9 HSFA9的表达量逐渐下降,而类Myb转录因子的表达量在渗透胁迫6h有所上升但上升幅度不大,表明热激转录因子HSFA9 HSFA9和类Myb转录因子的表达在渗透胁迫中受到抑制,并且其表达量均在渗透胁迫12h达到最小;这些基因明显受干旱胁迫影响较大[7],并且在渗透胁迫下能够快速做出相应的调整.
2.2.2 干旱处理马铃薯脯氨酸代谢相关基因的表达分析 4个脯氨酸代谢相关基因脯氨酸转运蛋白2、鸟氨酸氨甲酰基转移酶、吡咯啉-5-羧酸酯还原酶和△1-吡咯啉-5-羧酸合成酶在干旱处理1、6、12h均上调表达,并且脯氨酸转运蛋白2、吡咯啉-5-羧酸酯还原酶的表达量逐渐增大,而鸟氨酸氨甲酰基转移酶的表达量逐渐减小,△1-吡咯啉-5-羧酸合成酶的表达量在干旱胁迫6h达到最大(图2).表明脯氨酸转运蛋白2和吡咯啉-5-羧酸酯还原酶在干旱逆境下的表达模式相似[8];而鸟氨酸氨甲酰基转移酶在渗透胁迫1h就快速做出反应,表达量最大;△1-吡咯啉-5-羧酸合成酶在渗透胁迫6h应答反应最强烈.
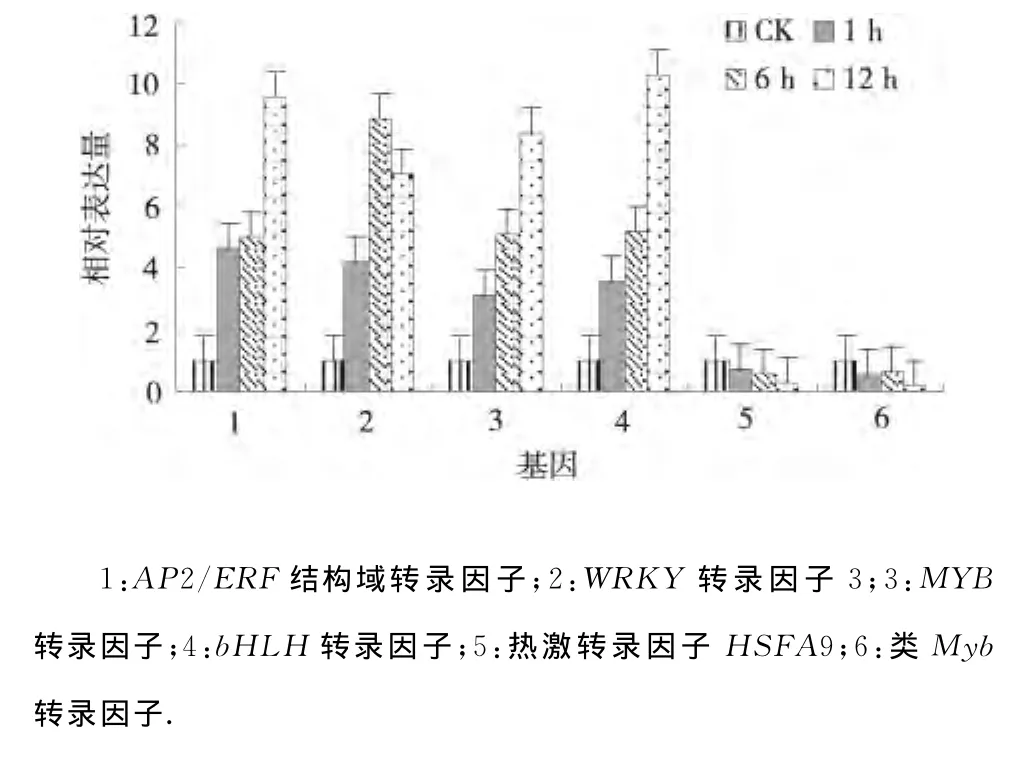
图1 干旱处理马铃薯转录因子的相对表达Fig.1 Relative expression of transcription factors under drought stress of potato
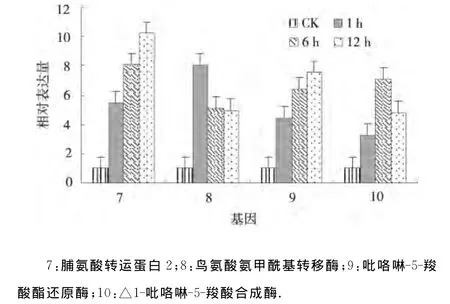
图2 干旱处理马铃薯脯氨酸代谢相关基因的相对表达Fig.2 Relative expression of genes related to proline metabolism under drought stress of potato
2.2.3 干旱处理马铃薯抗氧化防御系统基因的表达分析 抗氧化防御系统相关的基因[铜锌]超氧化物歧化酶和谷胱甘肽还原酶在渗透胁迫1、6、12h均上调表达,并且其表达量均在渗透胁迫6h达到最大,表明[铜锌]超氧化物歧化酶和谷胱甘肽还原酶均在干旱处理6h其应答反应最强烈.抗坏血酸过氧化物酶在渗透胁迫1、6、12h其表达模式为上调-下调-上调;过氧化氢酶在渗透胁迫1、6、12h均上调表达且表达量逐渐下降(图3).表明抗氧化防御系统基因在干旱应答中的形式各异,不同基因的应答机制各有不同,这些基因在干旱胁迫期间协同作用共同抵御逆境对植物自身的损害,以保证植物本身能够正常生长和发育.
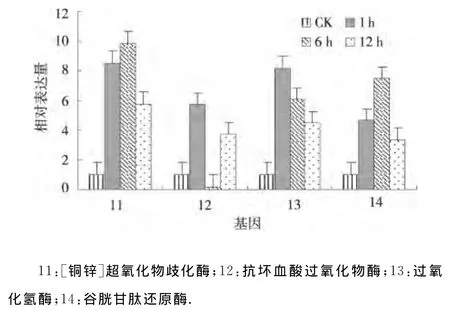
图3 干旱处理马铃薯抗氧化防御系统基因的相对表达Fig.3 Relative expression of genes related to antioxidant defense system under drought stress of potato
2.2.4 干旱处理马铃薯类黄酮生物合成基因的表达分析 4个与类黄酮生物合成相关的基因黄烷酮3-羟化酶、肉桂酸-4-羟化酶和查尔酮合酶2在渗透胁迫1、6、12h均上调表达,并且肉桂酸-4-羟化酶和查尔酮合酶2的表达量逐渐增大,而黄烷酮3-羟化酶的表达量逐渐减小;花青素还原酶在渗透胁迫1、6、12h其表达模式为上调-下调-上调(图4).表明黄烷酮3-羟化酶、肉桂酸-4-羟化酶、查尔酮合酶2、花青素还原酶参与了抗旱应答并且各自的抗旱机制各不相同[9].
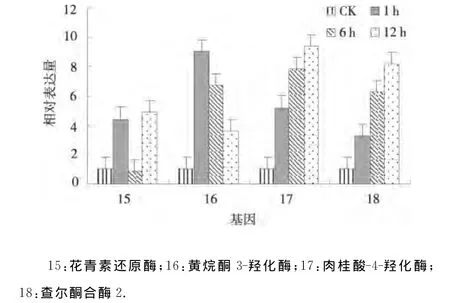
图4 干旱处理马铃薯类黄酮生物合成基因的相对表达Fig.4 Relative expression of genes related to flavonoids biosynthesis under drought stress of potato
2.2.5 干旱处理马铃薯信号转导相关基因的表达分析 信号转导相关的基因MAPK活化蛋白和PI-磷脂酶C在干旱处理1、6、12h均上调表达,并且MAPK活化蛋白的表达量逐渐增加,而PI-磷脂酶C在干旱处理6h的表达量达到最大;钙依赖性蛋白激酶1在干旱处理1、6、12h其表达模式为上调-下调-下调,并且在干旱处理12h表达量达到最低;CBL互作蛋白激酶1在干旱处理1、6、12h其表达模式为上调-上调-下调,并且在干旱处理12h表达量达到最低(图5).从以上结果可以看出:钙依赖性蛋白激酶1、CBL互作蛋白激酶1、MAPK活化蛋白、PI-磷脂酶C均在干旱胁迫中及时作出应答,但每个基因的应答模式各有不同[10].
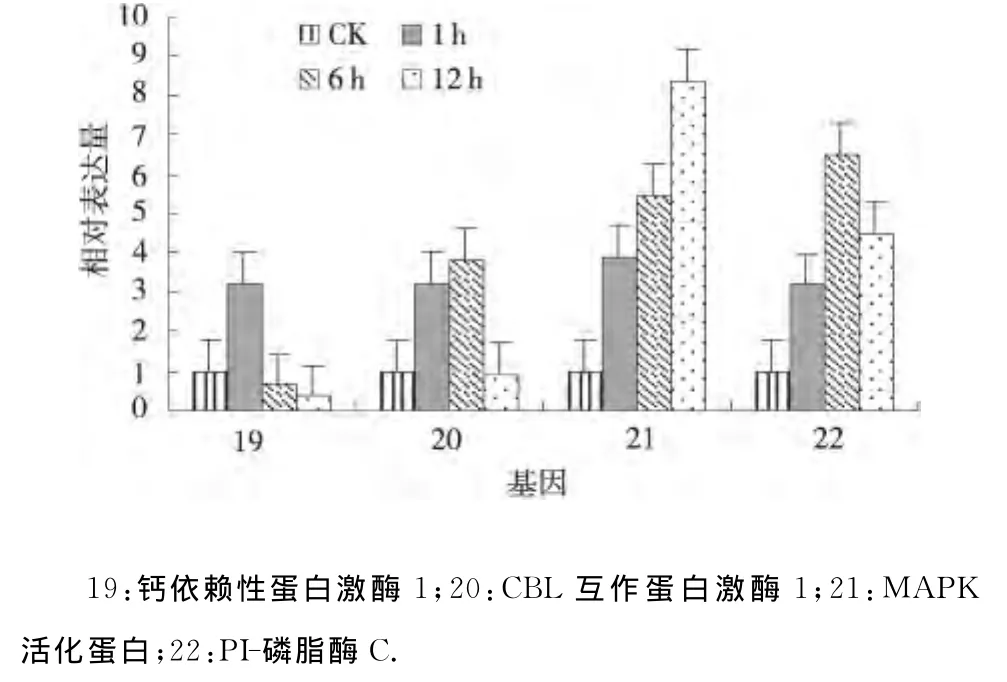
图5 干旱处理马铃薯信号转导相关基因的相对表达Fig.5 Relative expression of genes related to signal transduction under drought stress of potato
3 讨论
本试验研究了22个包括转录因子、脯氨酸代谢、抗氧化防御系统、类黄酮生物合成以及信号转导相关基因在干旱胁迫下不同时间点的表达,结果表明各基因在不同胁迫时间下的表达不完全相同,说明随着干旱胁迫时间的延长,马铃薯有不同的策略来应对干旱,保证自身正常的生长和发育.
在被检测的6个转录因子中,其中有4个(AP2/ERF结构域转录因子、WRKY转录因子3、MYB转录因子和bHLH 转录因子)在干旱处理1、6、12h均上调表达,而有2个(热激转录因子HSFA9和类Myb转录因子)在干旱处理1、6、12h均下调表达,这可能是因为在干旱逆境时转录水平调控方式存在差异[11],其对干旱逆境的忍受机理不相同,同时说明转录因子在植物生长和发育期间起着重要的转录水平调控作用[12].4个脯氨酸代谢基因在干旱处理1、6、12h均上调表达,在胁迫下大多数植物中脯氨酸累积主要受二氢吡咯-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)的活性调节[12],水分胁迫下植物主要通过谷氨酸途径合成脯氨酸,谷氨酸合成途径的初始底物为L-Glu,L-Glu在二氢吡咯-5-羧酸合成酶的催化作用下,生成谷氨酸-γ-半醛(GSA),GSA 再自发环化形成P5C,P5C经△1-二氢吡咯-5-羧酸还原酶(P5CR)还原生成脯氨酸[13].在被检测的4个抗氧化防御系统基因中,[铜锌]超氧化物歧化酶、过氧化氢酶和谷胱甘肽还原酶在干旱处理1、6、12h均上调表达,而抗坏血酸过氧化物酶在干旱处理1h和12h均上调表达,6h为下调表达,说明在水分胁迫条件下,抗氧化酶系统清除活性氧的能力与水分胁迫的方式与强度密切相关[14],已有试验证明[15-17]转入抗氧化基因可以提高作物的抗逆性.在被检测的4个类黄酮生物合成基因中,黄烷酮3-羟化酶、肉桂酸-4-羟化酶、查尔酮合酶2在干旱处理1、6、12h均上调表达,而花青素还原酶在干旱处理1、6、12h表现为上调-下调-上调,说明类黄酮在马铃薯抗旱中确实发挥着重要作用,但是因干旱胁迫的程度不同,类黄酮发挥作用的机制也不同[18].在被检测的4个马铃薯信号转导基因中,MAPK活化蛋白和PI-磷脂酶C在干旱处理1、6、12h均上调表达,而钙依赖性蛋白激酶1在干旱处理1、6、12h表现为上调-下调-下调,CBL互作蛋白激酶1在干旱处理1、6、12h表现为上调-上调-下调,这是因为干旱胁迫能诱导MAPK和CDPK基因转录水平的升高,但能同时诱导MAPK和CDPK蛋白的积累,这表明MAPK和CDPK基因在翻译后水平和转录水平上均受干旱胁迫因子的调控[19].
关于基因表达的方式的报道很多[20],可以将这样的研究按时间尺度划分为2类:以小时为研究尺度的,主要研究基因表达短时期变化,可以称之为短期小尺度研究;以天为研究尺度的,如1、5d等,主要研究基因表达长时期变化,可以称之为长期大尺度研究.基因表达的方式非常复杂,各种方式都存在.本研究以小时为尺度,研究干旱胁迫不同时间点基因表达情况.研究发现,在22个差异表达基因当中,上调基因居多,说明在干旱应答反应中正调控作用处于主导地位.用qRT-PCR检测的22个基因的表达结果与Solexa高通量测序的结果一致,说明Solexa高通量测序筛选的干旱相关基因结果整体上是可靠的,所筛选的差异表达基因在抗旱中的作用及相互关系值得进一步研究.
[1] 范敏,金黎平,刘庆昌,等.马铃薯抗旱机理及其相关研究进展[J].中国马铃薯,2006,20(2):23-24
[2] 贾琼,张东玉,蒙美莲,等.PEG 6000渗透胁迫对马铃薯生理特性的影响[J].中国马铃薯,2009,23(5):236-267
[3] 焦志丽,李勇,吕典秋,等.不同程度干旱胁迫对马铃薯幼苗生长和生理特性的影响.中国马铃薯,2011,25(6):329-333
[4] Daniele E,Isabelle L,Sylvain L,et al.Identification of drought-responsive compounds in potato through a combined transcriptomic and targeted metabolite approach[J].Journal of Experimental Botany,2010,61(9):2327-2343
[5] 王贺正,马均,李旭毅,等.水分胁迫对水稻籽粒灌浆及淀粉合成有关酶活性的影响[J].中国农业科学,2009,24(4):174-178
[6] 张斌,秦岭,范仲学,等.作物抗旱分子机制研究进展[J].山东农业科学,2011,(12):22-26
[7] 袁红雨,朱小佩,杨会敏,等.茶树CsCBF1基因克隆和转录活性分析[J].西北植物学报,2013,33(9):1717-1723
[8] 刘欣,李云.转录因子与植物抗逆性研究进展[J].中国农学通报,2006,22(4):61-61
[9] 许祥明,叶和春,李国凤.脯氨酸代谢与植物抗渗透胁迫的研究进展[J].植物学通报,2000,17(6):536-542
[10] 周桂,李杨瑞,韦雪雪,等.干旱胁迫下甘蔗叶类黄酮及相关酶活性的变化[J].干旱地区农 业研究,2009,27(6):185-188
[11] 万东石,李红玉,梁厚果,等.植物体内干旱信号的传递与基因表达[J].西北植物学报,2003,23(1):151-157
[12] 马廷臣,陈荣军,曾汉来,等.全基因组分析PEG胁迫下水稻根系转录因子表达变化[J].作物学报,2009,35(6):1030-1037
[13] Dai Gao-xing,Peng Ke-qin,Xiao Lang-tao,et al.Effect of drought stress simulated by PEG on malonaldehyde,proline contents and superoxide dismutase activity in low potassium tolerant rice seed-lings[J].Chinese Journal of Rice Science,2006,20(5):557-559
[14] 焦蓉,刘好宝,刘贯山,等.论脯氨酸累积与植物抗渗透胁迫[J].中国农学通报,2011,27(7):216-221
[15] 赵贵林,陈强,李雪梅,等.水稻脯氨酸代谢关键酶对水分胁迫的响应[J].干旱地区农业研究,2011,29(3):80-83
[16] 党青,韩刚,孙德祥,等.干旱胁迫下杨柴的抗氧化防御系统研究[J].西北林学院学报,2008,23(4):1-4
[17] 胡国霞,马莲菊,陈强,等.植物抗氧化系统对水分胁迫及复水响应研究进展[J].安徽农业科学,2011,39(3):1278-1280,1282
[18] 赵雅静,翁伯琦,王义祥,等.植物对干旱胁迫的生理生态响应及其研究进展[J].福建稻麦科技,2009,27(2):45-50
[19] 范敏,金黎平,屈冬玉,等.干旱胁迫对马铃薯类黄酮和类胡萝卜素合成关键酶基因表达的影响[J].园艺学报,2008,35(4):535-542
[20] 王静英,李永春,尹钧,等.干旱胁迫下植物的信号转导及基因表达研究进展[J].中国农学通报,2008,24(1):271-275

