海洋真菌Eurotium amstelodami SCSIO 151 二酮哌嗪吲哚生物碱类次生代谢产物的研究
罗明和,黄洪波,卢来春,鞠建华*
1第三军医大学大坪医院野战外科研究所 药剂科,重庆 400042;2 中国科学院热带海洋生物资源与生态重点实验室中国科学院海洋微生物中心 广东省海洋药物重点实验室 中国科学院南海海洋研究所,广州 510301
随着现代生物技术和发酵技术的发展,微生物以其能克服动植物天然产物资源的不可持续性及不破坏生态环境的巨大优势日益成为天然产物的重要源泉。海洋真菌由于其生态环境的独特性,且相对海洋放线菌次生代谢产物更加丰富产量更高,已成为天然产物的新聚焦点[1-3]。近年来由于医药、化妆、精细化工等对结构新颖,活性显著的天然产物的巨大需求使海洋真菌天然产物化学获得了迅猛发展[4]。到目前为止已经从海洋真菌中获得1000 多个新的次生代谢产物[5]。这些次生代谢产物包含抗菌、抗肿瘤、免疫抑制剂等生物活性[4]。其中,以海洋真菌次生代谢产物为先导化合物的plinabulin(NPI-2358)正在进行治疗非小细胞肺癌的二期临床研究[6]。
本课题组在对我国南海来源真菌的活性次生代谢产物的持续研究中,发现了一系列新的活性次生代谢产物,包括细胞毒活性的环肽和细胞松弛素、免疫抑制剂活性的霉酚酸类化合物及氯代及溴代蒽醌类化合物[7-10]。本文首次报道一株海洋真菌SCSIO 151 的分子生物学鉴定及其大米发酵产物中二酮哌嗪吲哚生物碱的分离鉴定。
1 材料与方法
1.1 仪器与材料
Bruker DRX 500 核磁共振仪(500/125 MHz,TMS 为内标);Bruker amazon SL 离子肼质谱仪;安东帕高精度数字式旋光仪MCP 300;Varian ProStar高效液相色谱仪(配PDA 检测器);慧德易QuikSep-50 型制备高效液相色谱仪;YMC-pack ODS-A 色谱柱(250 × 10 mm,5 μm);HYG-C 三层多功能摇床;HS-GF254硅胶薄层板(烟台江友硅胶开发有限公司);色谱纯乙腈(安徽时联公司),其它试剂均为国产分析纯。
海洋真菌SCSIO 151 是从中国南海北部(115°17.868'E,19°42.407' N)1808 米的深海沉积土中分离纯化得到,菌种保存于中国科学院海洋微生物研究中心。
PDA 培养基:去皮马铃薯(200 g/L),切成小块,加水煮沸30 min,砂布过滤,取滤液加葡萄糖(20 g/L),海盐(30 g/L),2% 琼脂粉,115 ℃灭菌30 min,冷却后备用。PDB 培养基:PDA 培养基配方中不加琼脂粉,115 ℃灭菌30 min,冷却后备用。大米培养基:大米100 g,酵母粉0.2%,海盐3%,121℃灭菌30 min,冷却后备用。
1.2 方法
1.2.1 海洋真菌SCSIO 151 的分子生物学鉴定
1.2.1.1 18S rDNA 序列PCR 扩增
用真菌18S 通用引物,ITS1:(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4:(5'-TCCTCCGCTTATTGATATGC-3')[11],进行PCR 扩增。PCR 反应体系(20 μL):DNA 模板1 μL,10 × Buffer 2 μL,dNTPs(2.5 mmol/L)1.6 μL,ITS1 primer (10 μmol/L)0.4 μL,ITS4 primer (10 μmol/L)0.4 μL,HiFi (5U/μL)0.2 μL,ddH2O 14.4 μL。PCR 反应条件为:94℃预变性4 min;94 ℃变性1 min,58 ℃退火45 s,72℃延伸40 s,30 个循环;72 ℃延伸10 min;4 ℃保温。
1.2.1.2 扩增产物的序列测定
用凝胶回收试剂盒(OMEGA)纯化PCR 产物,克隆至pCR2.1 载体(INVITROGEN)上,18S rDNA序列由生工生物工程(上海)股份有限公司测定。将测得的18S rDNA 序列进行BLAST 分析(http://blast.ncbi.nlm.nih.gov/)。
1.2.1.3 系统发育树的构建
通过CLUSTAL X 软件对海洋真菌菌株SCSIO 151 及真菌中最相似菌株的18S rDNA 序列进行比对,使用软件MEGA4.0 中的Neighbor-joining 法构建系统进化树[12,13]。
1.2.2 菌株的发酵培养
用250 mL 锥形瓶,每瓶加入50 mL PDB 培养基,从平板上接入海洋真菌SCSIO 151 的菌丝体,于28 ℃、200 rpm 摇床上培养2d 后分别转入含400 g大米培养基的2 L 锥形瓶中,室温培养28 d。
1.2.3 发酵产物的提取和分离
发酵产物(2 kg)采用等体积的乙酸乙酯萃取3次,经减压浓缩后得粗提物总浸膏3 g。粗提物使用正相硅胶柱层析,氯仿-甲醇体系梯度(100∶0,98∶2,96∶4,94∶6,92∶8,90∶10,8∶2,5∶5,V/V)洗脱,得到Fr.1~Fr.8 共8 个馏份。其中馏份Fr.2-3 合并后使用常压硅胶柱层析,乙酸乙酯-石油醚梯度(10∶90,20∶80,30∶70,40∶60,50∶50,V/V)洗脱,得到Fr.(2-3)-(3-4)。Fr.(2-3)-3 用制备高效液相色谱(CH3CN/H2O 75%~100% 梯度洗脱20 min,流速10 mL/min)于16.73min 纯化得到化合物3(25 mg)。Fr.(2-3)-4 用制备高效液相色谱CH3CN/H2O 65%,流速10 mL/min,横梯度洗脱20 min,在12.2 min 得到化合物4(30 mg)。再对Fr.4 进行高效液相色谱制备(CH3CN/H2O 65%~100% 梯度洗脱20 min,流速10 mL/min)纯化,得到化合物2(tR=18.9 min,20 mg),1(tR=21.2 min,25 mg)。Fr5继续过一硅胶柱层析,氯仿-甲醇体系梯度(100∶0,99∶1,98∶2,97∶3,96∶4,94∶6,92∶8,90∶10,V/V)洗脱,并对洗脱得到的馏份Fr5-6 高效液相色谱制备(CH3CN/H2O 65%~100% 梯度洗脱20 min,流速10 mL/min)纯化得到化合物5(tR=15.97min,30 mg)。
2 结果与讨论
2.1 菌株鉴定
18S rDNA 序列分析表明菌株SCSIO 151 与真菌Eurotium amstelodami 18S rDNA 序列相似性为100%,所以鉴定为Eurotium amstelodami SCSIO 151,其菌落形态见图1,系统发育树见图2。

图1 菌株SCSIO 151 在PDA 培养基上的形态图Fig.1 Phenotype of strain SCSIO 151 on PDA-medium plate

图2 基于18S rDNA 序列构建的SCSIO 151 与其他真菌菌种NJ 分子系统进化树Fig.2 Neighbour-joining tree based on 18S rDNA sequences showing relationships between strain SCSIO 151 and closely related members of fungi
2.2 结构鉴定
化合物1 白色粉末,(+)HR-ESI-MS 给出准分子离子峰m/z 392.2328 ([M+H]+,calcd.for 392.2333),推测其分子式为C24H29N3O2,不饱和度为12。13C NMR 中显示有10 个季C,7 个CH,2 个CH2,5 个CH3。在1H NMR 中,低场区含有3 个芳香质子7.05,d (J=7.0 Hz),7.14,t (7.0),7.19,d(7.0),暗示可能含有一个1,2,3-三取代苯环单元;另外还有5 个烯氢质子;一个脂肪CH2;5 个甲基信号。13C NMR 中的δC165.7,160.2 两个酰胺羰基,结合1H NMR δH7.54 的NH 活泼氢信号在HMBC 谱中与δC165.8、160.2 相关,推断可能存在一个环二肽单元。在1H-1H COSY 谱中,δH:3.64,d (7.0)与5.49,m 互相偶合,同时HMBC 中,H-21/C-22;H-22/C-21,23,24;H-24/C-22,23,25;H-25/C-22,23,24 相关;另有6.12,dd (17.5,10.5)与5.24,d(17.5);5.27,d (10.5)偶合,HMBC 中:H-18,19/C-15,16;H-17/C-15,16,19;H-16/C-15,17,19 相关,综合这两组信号提示分子中含有两个异戊烯基单元。仔细分析化合物1 的NMR 数据提示化合物1是一个二酮哌嗪吲哚生物碱。通过对比文献,确定化合物1 为variecolorin G[14],结构鉴定数据如下。
化合物2 白色粉末,(+)HR-ESI-MS 显示与化合物1 分子式相同为C24H29N3O2,是彼此的同分异构体。仔细比对化合物2 与1 的1H/13C NMR 数据发现两者基本一致,所不同的是化合物2 的1H NMR 的苯环芳氢信号为7.04,d (8.0);6.90,s;6.82,d (8.5)是一个1,2,4 -三取苯环。对比文献最后确定化合物2 为isoechinulin A[15],结构鉴定数据如下。
化合物3 通过HR-ESI-MS 发现其分子式为C24H27N3O2,相对化合物2 少了两个质量数,不饱和度多1。1H NMR 中化合物3 相对2 多了两个烯氢质子,少了一个甲基,一个CH 氢信号,这些提示C12与C20 可能为双键。这与13C NMR 中多了两个烯碳,同时一个甲基和一个次甲基碳信号消失相对应。通过查阅比对文献,最后确定化合物3 为isoechinulin B[15],结构鉴定数据如下。
1H NMR (500 MHz,CD3OD)δ:7.29 (1H,d,J=5.6 Hz,H-8),7.26 (1H,s,H-4),7.18 (1H,t,J=8.5 Hz,H-5),6.95 (1H,d,J=8 Hz,H-6),6.09(1H,dd,J=17,11 Hz,H-16),5.37 (1H,m,H-22),5.09,5.11 (each 1H,J=17.5,10.5,H-17),5.48,5.04 (each1H,s,H-20),3.43 (1H,d,J=7.3 Hz,H-21),1.75 (3H,s,H-24,25),1.54 (3H,d,J=7.5 Hz,H-18,19);13C NMR (125 MHz,CD3OD)δ:159.3 (s,C-13),158.0 (s,C-10),146.0 (d,C-16),146.0(s,C-2),137.0 (s,C-12),136.8 (s,C-7a),135.5 (s,C-23),132.6 (s,C-3a),125.1 (s,C-9),125.0(d,C-7),124.3 (d,C-22),122.5 (s,C-5),119.5 (d,C-6),115.5 (d,C-4),112.6 (t,C-17),112.0 (d,C-8),103.8 (s,C-3),102.1 (t,C-20),40.3 (s,C-15),35.3 (t,C-21),28.2 (q,C-18,19),26.0 (q,C-25),18.0 (q,C-24);(+)HR-ESI-MS m/z 390.2179 (calcd.for C24H27O2N3,390.2176)。
化合物4 (+)HR-ESI-MS 给出分子离子峰m/z 324.1346([M+H]+,calcd.for 324.1343),确定其分子式为C18H17N3O3,不饱和度为12。化合物4 与1 有相同的紫外特征,都是二酮哌嗪吲哚生物碱。仔细比对化合物4 与1 的1D NMR 数据发现化合物4 少了一个异戊烯基单元,这与化合物4 中δ H:7.43 (2H,d,J=8 Hz,H-4,7),7.20 (1H,s,H-8),7.11 (1H,t,J=8 Hz,H-5)形成的1,2 二取代苯环相吻合,同时环二肽单元的化合物1 中的脂肪碳在化合物4 中转变为一个酮羰基。经文献查阅,最后鉴定化合物4 为neoechinulin E[16],结构鉴定数据如下。
1H NMR (500 MHz,DMSO-d6)δ:7.43 (2H,d,J=8 Hz,H-4,7),7.20 (1H,s,H-8),7.11 (1H,t,J=8 Hz,H-5),7.03 (1H,t,J=7.5 Hz,H-6),6.09(1H,dd,J=17.5,10.5 Hz,H-16),5.09,5.0(each1H,d,J=9.5 Hz,H-17),1.49 (6H,s,H-18,19);13C NMR (125 MHz,DMSO-d6)δ 160.4 (s,C-12),157.2 (s,C-13),152.2 (s,C-10),145.5 (d,C-16),144.8 (s,C-2),135.1 (s,C-7a),126.0 (s,C-3a),123.4 (s,C-9),121.0 (d,C-7),119.6 (d,C-5),119.4 (d,C-6),115.9 (d,C-4),111.9 (t,C-17),111.5 (d,C-8),103.6 (s,C-3),27.5 (q,C-18,19);(-)ESI-MS m/z 322.20。
化合物5 与化合物3 相似,(-)LR-ESI-MS 显示分子量为320.20[M-H]-。仔细比对核磁数据显示:化合物5 比化合物3 少了一个异戊烯基单元,苯环中形成了一个1,2 二取代苯环,提示吲哚单元的苯环区的异戊烯基在化合物5 中被H 取代。经文献查阅,数据比对显示与报道的波谱数据一致,故鉴定化合物5 为neoechinulin B[16],其结构鉴定数据如下。
1H NMR (500 MHz,DMSO-d6)δ:7.47 (1H,d,J=8.0 Hz,H-4),7.25 (1H,d,J=7.5 Hz,H-7),7.12 (1H,t,J=7.5 Hz,H-5),7.05 (1H,t,J=9 Hz,H-6),7.04 (1H,s,H-8),6.11 (1H,dd,J=17,11 Hz,H-16),5.29 (1H,s,H-20),4.98 (1H,s,H-20),5.08,5.05 (2H,dd,J=11,17.5 Hz,H-17),1.51(1H,s,H-18,19);13C NMR (125 MHz,DMSO-d6)δ:157.1 (s,C-13),155.8 (s,C-10),145.0 (d,C-16),144.4 (s,C-2),135.1 (s,C-12),134.8 (s,C-7a),125.8 (s,C-3a),124.5 (s,C-9),120.8 (d,C-7),119.5 (d,C-5),118.7 (d,C-6),111.6 (t,C-17),111.6 (d,C-8),103.1 (s,C-3),99.7 (t,C-20),27.4 (q,C-18,19);(-)ESI-MS m/z 320.20。
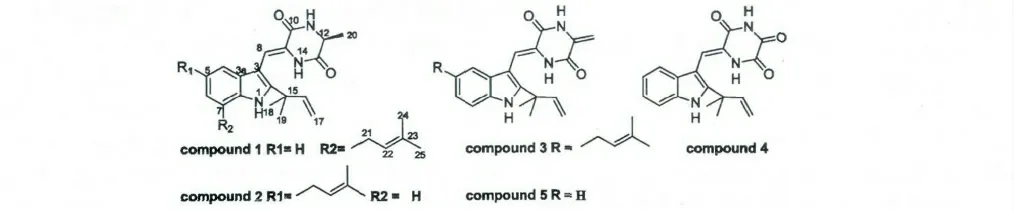
图3 化合物1~5 的化学结构Fig.3 Chemical structures of compounds 1-5
2.3 讨论
本文报道的吲哚类生物碱属于echinulin 家族,这类化合物最初报道有自由基清除[14]及抑制蚕幼虫生长活性[18]。目前发现的echinulin 类化合物主要来源于真菌次生代谢产物,其生源路径推测为色氨酸和丙氨酸首先通过环化,然后与甲羟戊酸反应形成异戊烯基取代,最后通过一系列的脱氢、氧化、脱水、取代反应得到一系列二酮哌嗪吲哚生物碱[14]。科学家们在对这类化合物的深入研究中,得到大量同系物,并发现了新的生物活性,其中,包括抑制细胞增殖[17]、抗菌[17]、抗硝化及细胞保护作用[19]。通过比对不同衍生物的生物活性显示:echinulin 家族类吲哚生物碱的丝氨酸结构单元对细胞毒活性及抗菌活性的发挥起了重要作用,当8,9位是单键时抗菌活性好,双键时细胞毒活性好[17];另外还发现8,9 位的双键与吲哚环及二酮哌嗪单元形成一个共轭体系时能诱导细胞产生NDPH,从而增强其抗氧化、抗硝化作用,推测8,9 位双键是这类化合物具有抗氧化、抗硝化活性的关键功能基团[19,20]。本文首次报道了海洋真菌Eurotium amstelodami 151 大米发酵生产echinulin 类生物碱。
1 Blunt JW,Copp BR,Keyzers RA,et al.Marine natural products.Nat Prod Rep,2013,30:237-323.
2 Haefner B.Drugs from the deep:marine natural products as drug candidates.Drug Discov Today,2003,8:536-544.
3 Bhadury P,Mohammad BT,Wright PC.The current status of natural products from marine fungi and their potential as antiinfective agents.J Ind Microbiol Biotechnol,2006,33:325-337.
4 Saleem M,Ali MS,Hussain S,et al.Marine natural products of fungal origin.Nat Prod Rep,2007,24:1142-1152.
5 Zhu WM(朱伟明),Wang JF(王俊锋).A review on studies of secondary metabolites from marine fungi.Mycosystema (菌物学报),2011,30:218-228.
6 Mita AC,Heist RS,Aren O,et al.Phase II study of docetaxel with or without plinabulin (NPI-2358)in patients with nonsmall cell lung cancer (NSCLC).J Clin Oncol,2010,28:7592.
7 Huang H,Wang F,Luo M,et al.Halogenated anthraquinones from the marine-derived fungus Aspergillus sp.SCSIO F063.J Nat Prod,2012,75:1346-1352.
8 Chen Z,Song Y,Chen Y,et al.Cyclic heptapeptides,codyheptapeptides C-E,from marine-derived fungus Acremonium persicinum SCSIO 115.J Nat Prod,2012,75:1215-1219.
9 Chen Z,Huang H,Chen Y,et al.New cytochalasins from the marine-derived fungus Xylariasp.SCSIO 156.Helv Chim Acta,2011,94:1671-1676.
10 Chen Z,Zheng Z,Huang H,et al.Penicacids A-C,three new mycophenolic acid derivatives and immunosuppressive activities from the marine-derived fungus Penicillium.sp.SOF07.Bioorg Med Chem Lett,2011,22:3332-3335.
11 White TJ,Bruns T,Lee S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics,pp.315-322 in M.A.Innis,Gelfand DH,Sninisky JJ,White TJ (Eds):PCR Protocols:a Guide to Methods and Applications.San Diego:Academic Press,1990.
12 Thompson JD,Gibson TJ,Plewniak F,et al.The ClustalX windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools.Nucleic Acids Res,1997,25:4876-4882.
13 Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular evolutionary genetics analysis (MEGA)software version 4.0.Mol Biol Evol,2007,24:1596-1599.
14 Wang WL,Lu ZY,Tao HW,et al.Isoechinulin-type alkaloids,variecolorins A-L,from halotolerant Aspergillus variecolor.J Nat Prod,2007,70:1558-1564.
15 Nagasawa H,Isogai A,Suzuki A,et al.Stuctures of isoechinulins A,B and C,new indole metabolites from Aspergillus ruber.Tetrahedron Lett,1976,19:1601-1604.
16 Marchelli R,Dossena A,Pochini A,et al.The structures of five new didehydropeptides related to neoechinulin,isolated from Aspergillus amstelodami.J Chem Soc Perkin 1,1977,(7):713-717.
17 Du FY,Li XM,Li CS,et al.Cristatumins A-D,new indole alkaloids from the marine-derived endophytic fungus Euroti-um cristatum EN-220.Bioorg Med Chem Lett,2012,22:4650-4653.
18 Nagasawa H,Isogai A,Sato S,et al.Isolation and structure elucidation of a new indole metabolite from Aspergillus ruber.Agric Biol Chem,1975,39:1901-1902.
19 Kuramochi K,Ohnishi K,Fujieda S,et al.Synthesis and biological activities of neoechinulin A derivatives:new aspects of structure-activity relationships for neoechinulin A.Chem Pharm Bull,2008,56:1738-1743.
20 Kimoto K,Aoki T,Shibata Y,et al.Structure-activity relationships of neoechinulin A analogues with cytoprotection against peroxynitrite-induced PC12 cell death.J Antibiot,2007,60:614-621.

