酱香白酒酿造环境曲霉的分离及Aspergillus hennebergii酶分泌胁迫条件
黄永光, 徐 岩
(1.江南大学 教育部工业生物技术重点实验室,江苏 无锡 214122;2.酿酒科技杂志社,贵州 贵阳 550007)
酱香白酒酿造环境曲霉的分离及Aspergillus hennebergii酶分泌胁迫条件
黄永光1,2, 徐 岩*1
(1.江南大学 教育部工业生物技术重点实验室,江苏 无锡 214122;2.酿酒科技杂志社,贵州 贵阳 550007)
以茅台镇酱香白酒酿造过程关键环节样品为载体,对曲霉的生态结构分布进行分析;以新鲜麸皮为培养基模拟固态发酵方法对影响筛选优势菌株Aspergillums henneberguii的生长及分泌糖化酶、蛋白酶的主要发酵胁迫条件进行了分析。结果分离得到曲霉103株,分别鉴定为10个种属种,即A.niger、A.oryzae、A.terreus、A.tubingensis、A.flavus、A.henneberguii、A.fumigatus、A.niveus、A.candidus和Monascus;发酵基质初始水分在50%和初始pH在3.5~4.0条件下有利于Aspergillums henneberguii的生长和酶的分泌;Aspergillums henneberguii的适宜生长温度范围为30~35℃,酶分泌温度为32~35℃;高乙醇体积质量(>8%)对Aspergillums henneberguii的生长和产酶存在抑制,低乙醇体积质量(2%)反而有利于其生长和酶的分泌;(NH4)2SO4有利于Aspergillums henneberguii糖化酶的分泌,NaNO2和酵母浸膏有利于其生长和蛋白酶的分泌;乳糖和麦芽糖对Aspergillums henneberguii的生长和产酶有利,山梨糖、蔗糖、果糖可促进菌株糖化酶的分泌;单独添加硫酸钠有利于Aspergillums henneberguii的生长和酶的分泌;新鲜麸皮富含碳源、氮源、无机盐、微量元素等,为Aspergillums henneberguii菌体生产及制酶的优质天然载体。Aspergillums henneberguii的应用可满足传统固态白酒酿造过程的双边发酵和风味形成机制需求。
酱香白酒酿造;曲霉生态分布;Aspergillus henneberguii;酶分泌;胁迫条件
传统酱香型白酒固态发酵独特的酿造工艺经过长期驯化形成了其独特的微生态群落结构[1-3],其中曲霉菌起着举足轻重的作用,除分泌多种主要功能酶类[4-5],降解发酵原料中的淀粉和蛋白质,促进原料降解利用外,还能代谢产生多种风味成分[2-3,6],赋予酒体风味和醇厚感。如Aspergillums niger等曲霉菌能分泌糖化酶、蛋白酶等多种酶类以及有机酸等多种代谢产物[6]。A.niger等曲霉菌是固态发酵过程双边发酵机制的关键微生物,对发酵具有重要影响。由于研究技术手段、取样方式及时间等条件限制,致使至今对其生态结构和功能认识还不能实现全面的突破。已有报道表明,酱香型白酒酿造过程存在A.niger、A.oryzae、A.terreus、A.flavus、A.fumigatus、A.niveus和Monascus等曲霉[1-3,5-6]。
以茅台镇酱香白酒酿造过程关键工艺环节物料及其酿造环境样品为载体,分析酿造过程曲霉生态结构及其种类分布,并从固态发酵双边发酵机制调控着眼,重点分析了发酵胁迫条件对A. hennebergii的生长及其主要功能酶糖化酶、蛋白酶分泌的影响。对研究传统固态法白酒酿造过程重要功能曲霉在一定程度上代替或改善微生物群落结构,推进传统酿造的纯种糖化发酵的现代化发展和提高生产效率创新方法具有重要意义[7-8]。
1 材料与方法
1.1 样品
根据已有对传统固态法白酒酿造生态中微生物的研究报道[9-10],选择酿造大曲、酒醅、曲房稻草等载体作为曲霉菌分离源样品,采集于贵州茅台镇MTGF、JSL、HXJY、LYCJY、XJGS等规模以上白酒生产企业正常生产过程。
1.2 主要试剂及仪器
试剂:硝酸钠、碳酸氢铵、尿素、酵母膏、蛋白胨、可溶性淀粉、葡萄糖、乳糖、麦芽糖、麸皮、蔗糖等试剂均为分析纯,购自国药集团。
孟加拉红培养基(组分g/L):蛋白胨 5.0,葡萄糖10.0,磷酸二氢钾1.0,硫酸镁0.5,琼脂 20.0,孟加拉红0.033,氯霉素0.1;121℃灭菌20 min。
PDA培养基(组分g/L):马铃薯(去皮)200,琼脂20.0,葡萄糖20.0,氯霉素 0.1;121℃灭菌20min。
麸曲培养基:称取10 g新鲜麸皮于250 mL锥形瓶中,加水10 mL,121℃灭菌20 min。
菌株保存:挑取新鲜孢子,于装有体积分数30%无菌甘油的EP管内摇匀,-20℃冰箱保存。
PCR仪(PC300):Eppendorf Master personal;电泳仪:美国Bio-rad;荧光定量PCR仪CFX96:美国Bio-rad;冷冻高速离心机3K15:美国Sigma-Aldrich公司;电热恒温水浴锅:上海华连医疗器械有限公司;超低温冰箱:Thermo Electron Corporation;酶标仪:Thermo Electron Corporation;贝克曼Avanti J-E高效多用途离心机:美国Beckman有限公司;细胞破碎仪FastPrep H-24:美国MP-Biomedicals。
1.3 曲霉分离鉴定
曲霉菌的分离根据文献[10]进行;计数方法根据GB/T 4789.15-2010方法[12-13]进行;菌株按文献[10,14]方法进行鉴定。
1.4 发酵胁迫因子分析
1.4.1 初始水分对A.hennebergii生长及产酶的影响 以新鲜麸皮为培养基,初始水分含量分别控制体积质量为35%、40%、45%、50%、55%、60%、65%。
1.4.2 初始pH对A.hennebergii生长及产酶的影响 以新鲜麸皮为培养基,水分体积质量50%,调节初始 pH分别为 2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5。
1.4.3 培养温度对A.hennebergii生长及产酶的影响 以新鲜麸皮为培养基,含水体积质量为50%,初始pH 4.0,培养温度分别为25、30、35、40、45、50℃。
1.4.4 不同初始乙醇浓度对A.hennebergii生长及产酶的影响 以新鲜麸皮为培养基,含水体积质量为50%,初始pH 4.0,分别按乙醇与发酵基质体积质量的2%、4%、6%、8%、10%加入无水乙醇进行实验。
1.4.5 不同氮源对A.hennebergii生长及产酶的影响 以新鲜麸皮为培养基,含水体积质量50%,初始pH 4.0,加入相应氮源(质量分数0.2%)。
1.4.6 不同碳源对A.hennebergii生长及产酶的影响 以新鲜麸皮为培养基,含水体积质量50%,初始pH 4.0,加入相应的碳源(质量分数0.2%)。
1.4.7 不同无机盐对A.hennebergii生长及产酶的影响 以新鲜麸皮为培养基,含水体积质量50%,初始pH 4.0,加入相应的无机盐(盐离子摩尔质量浓度10 mmol/g)。
以上所有实验均做3个平行实验,培养基均经121℃灭菌20 min,冷却至室温,按6.2×105个/g接种A.hennebergii,于30℃培养48 h,测定酶活和生物量[15]。
1.5 酶活及生物量测定
蛋白酶酶活测定:采用Folin-酚法,具体参照文献[16];糖化酶酶活:按Michael Somogyi的方法进行测定[17-18];生物量的测定:采用荧光定量方法[14,19];蛋白酶活力定义为:在40℃下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位。糖化酶酶活定义为:在40℃下每分钟水解可溶性淀粉产生1 mg葡萄糖,定义为一个酶活力单位。
2 结果与讨论
2.1 茅台镇传统酱香白酒酿造生态中的曲霉菌
根据曲霉菌在培养基上的不同生长形态特征,从样品中共分离得曲霉菌103株。通过形态分类后对其ITS rDNA区域测序并在NCBI比对鉴定,所分离曲霉菌归属为10个菌种,即Aspergillums niger、Aspergillus oryzae、Aspergillus terreus、Aspergillus tubingensis、Aspergillus flavus、Aspergillus henneberguii、Aspergillus fumigatus、Aspergillus niveus、Aspergillus candidus和Monascus,见表1。
从表1可知,曲霉主要集中在制曲过程的第二次翻仓中前期曲胚、贮存期成品曲、堆积酒醅、曲房稻草中,而窖期发酵酒醅中相对较少。这可能与曲霉嗜低温、高湿度、孢子易迁移、好氧等特征有关,同时也与被采样企业的酿造环境生态、生产环境等分不开。一般年均气温偏高、湿度偏大、空气流动速度相对较低的环境有利于曲霉的生长和富集。
作者分离得曲霉A.niger、A.oryzae、A.terreus、A. tubingensis、A.flavus、A.henneberguii、A.fumigatus、A. niveus、A.candidus,与已报道的茅台酒酿造微生物研究[20-23]结果相比,存在一定的差异。其中,A.niger、A.oryzae、A.terreus、A.flavus、A.nidulans、A.henneberguii、Monascus主要存在于制曲环境,A.nidulans、A.fumigatus、A.flavus、Monascus、A.niger、A.oryzae、A.terreus、A.tubingensis、A.flavus、A.henneberguii、A.fumigatus多存在于制酒环境中;A.niger、A.oryzae、A.terreus、A.flavus、A.fumigatus多存在于空气环境中。与以往研究报道不同的是,本次在多个企业采集样品中均分离到 A.tubingensis、A.hennebergii,这与以往对茅台酒酿造微生物研究结果是有所差异的。本次分离所得曲霉属多样性较丰富,体现了茅台镇作为中国传统固态法酱香型白酒酿造微生态典型环境中曲霉的多样性特征[24],可能原因与采样种类较丰富和茅台镇采集环境的特殊性有关,但本次未分离到文献[20-23]报道的A.parasiticus,A.viridinutans、A.sydowii、A.wentti,这可能与采样覆盖面仍然未达到更全面的原因。本研究证实了A.niger、A.tubingensis、A.hennebergii、A.oryzae、A.terreus、A.fumigatus为茅台镇酱香白酒酿造环境中的优势曲霉。
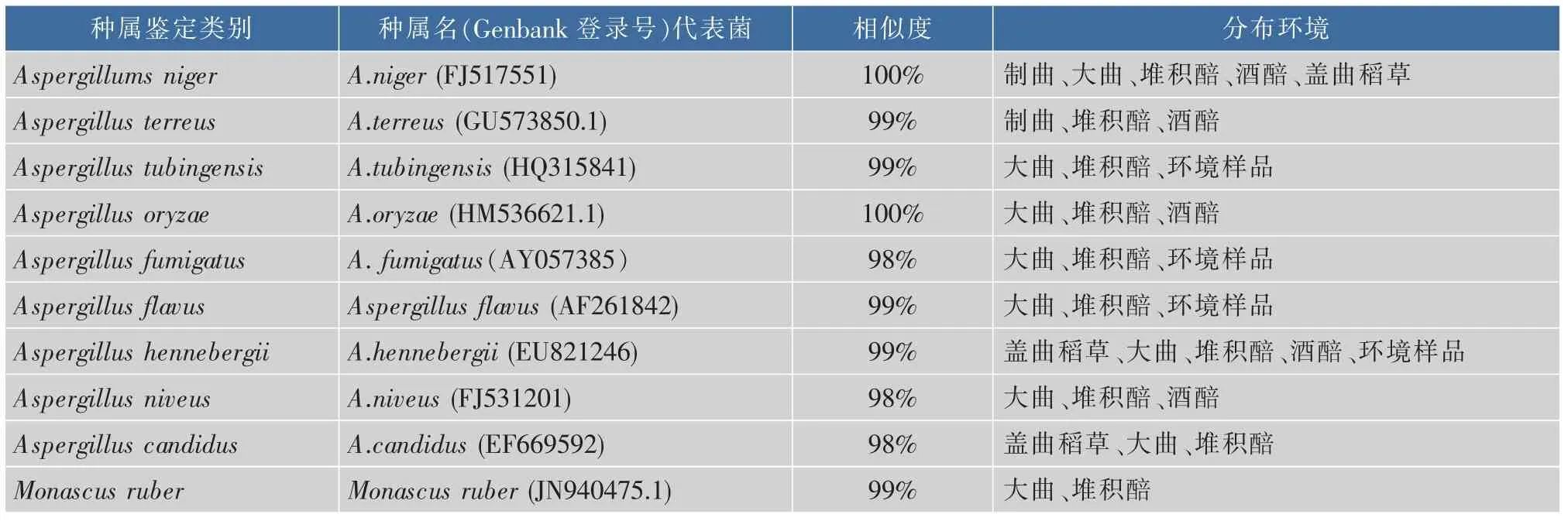
表1 茅台镇酱香白酒酿造生态中的曲霉及其分布情况Table 1 Aspergillus and their distribution in Jiangxiang liquor fermentation environment in Maotai village
2.2 分离曲霉的主要功能酶分泌特性表征比较
对分离得曲霉中的发酵型主要功能酶分泌优势菌株进行麸曲培制,分析其分泌糖化酶、蛋白酶酿造功能酶特性并进行比较,其分泌酶酶活的比较分析结果见表2。
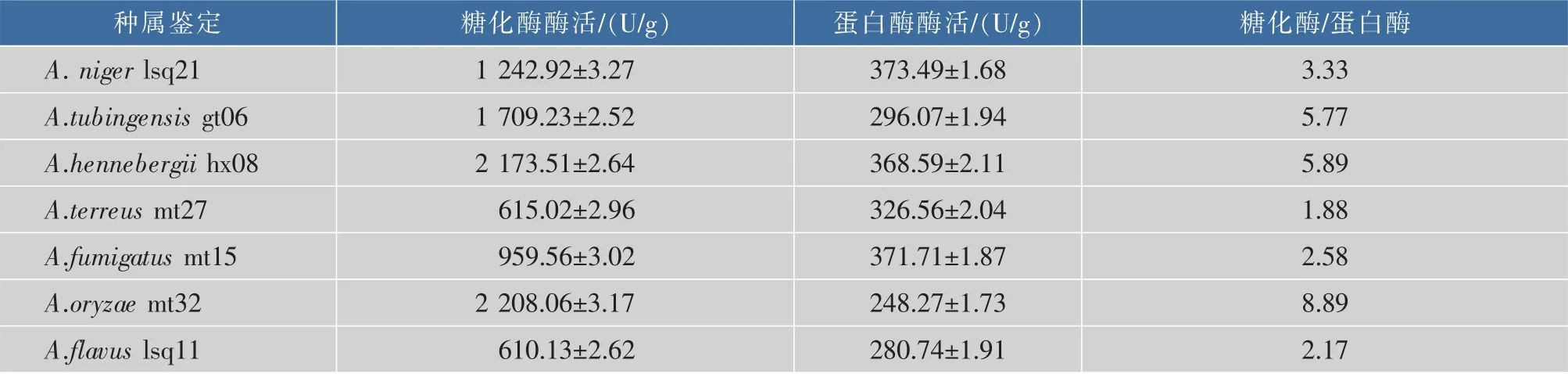
表2 部分分离优势曲霉菌株分泌糖化酶、蛋白酶特性比较结果Table 2 Characteristics of glucoamylase and protease secreted by some of the prodominant Aspergillus strains
从表2可知,A.niger、A.oryzae、A.tubingensis、 A.hennebergii分泌糖化酶的能力较强;A.niger、A. terreus、A.tubingensis、A.hennebergii、A.fumigatus分泌蛋白酶特性较好;从固态酿造发酵双边糖化机制衡量,A.niger、A.tubingensis、A.hennebergii最适宜传统固态法白酒酿造生产应用,其分泌糖化酶、蛋白酶的量及其酶活比例能较好满足双边发酵和风味形成需求,不会出现太高、太低的现象。同时,从白酒发酵环境的基态条件和酿造动力需求角度分析,A.niger、A.tubingensis、A.henneberguii分泌糖化酶、蛋白酶较其他曲霉分泌酶更能满足传统白酒生产需求,其具有耐酸、耐温和耐乙醇等性能[25-27]。A. hennebergii更具备了双边发酵的机理调控前提,可以创新性应用于传统固态法白酒发酵微生物生态体系与双边发酵功能调控中。
2.3 主要酿造胁迫因子对酿造功能酶分泌的影响表征
2.3.1 初始水分对A.hennebergii生长及产酶的影响 培曲过程通过曲胚中水和传质媒介共同作用改变营养、生物热在曲胚内部的分布并形成适宜的梯度,满足微生物的生长。麸曲发酵的初始水分对A.hennebergii生长和分泌糖化酶、蛋白酶的影响结果见图1。

图1 初始水分体积分数对A.hennebergii生长及产酶的影响Fig.1 Effect of initial moisture content on the growth and enzyme production of A.hennebergii
图1表明,初始水分体积质量在40%~60%之间,A.hennebergii都能生长和实现酶的分泌,但最适生长水分体积质量则为50%左右,生物量和蛋白酶的最高量均出现在水分体积质量为50%时;水分体积质量为55%时,糖化酶分泌相对滞后,但从糖化酶分泌量的趋势分析,水分体积质量超过55%后快速下降。综合考虑,选择50%的初始水分体积质量更有利于A.hennebergii菌株的生长、产酶及酶活发挥。固态培曲发酵过程高水分容易产生曲的团烧和生酸,不利于生物量的形成和产酶,导致酶的分泌和生物量大幅度下降;低水分条件有利于初期曲胚含氧量的富集和培菌初期菌丝的快速生长,升温快,但中后期保温、保湿效果差,菌丝易老化,反而不利于菌的生长和酶的分泌。
2.3.2 初始pH对A.hennebergii生长及产酶的影响 曲霉在生长、代谢过程不但会产生一些酸类物质,改变生态环境的酸度,同时其生长也受到环境酸度条件的胁迫,影响其生长和酶的分泌。在本研究设定初始pH条件下,A.hennebergii的生长及其酶分泌结果见图2。
从图2可知,随着pH值的增加,曲品的酶活增加,适宜的产酶初始条件为:pH 3.5,蛋白酶酶活为459.63 U/g,生物量为2.31×107个/g;pH 4.0,糖化酶酶活为2 775.25 U/g。A.hennebergii酶活升高一方面与其生物量的增加有关,另一方面与酶的最适pH也有关。A.hennebergii只有在其最适宜的pH下才能实现生物量的最大富集,菌丝才能分泌大量的生物酶;同时只有在最适宜的pH下,酶的活性才能得到充分体现。在适宜的pH临界点酶的分泌量和酶的活性都会受到影响。从图2可知,A.hennebergii在新鲜麸皮载体上的最适产酶初始pH为3.5~4.0。

图2 初始pH对A.hennebergii生长及产酶的影响Fig.2 Effect of initial pH on the growth and enzyme production of A.hennebergii
2.3.3 培养温度对A.hennebergii生长及产酶的影响 不同的曲霉菌株对生长环境温度的应激性不一样,导致其生长温度和分泌酶的温度范围也不一样。温度对A.hennebergii生长及其酶分泌的影响见图3。

图3 培养温度对A.hennebergii生长及产酶的影响Fig.3 Effect of temperature during starter culture on the growth and enzyme production of A.hennebergii
由图3可知,菌株A.hennebergii的最适宜生长温度范围为30~35℃,实验结果也表明其在28~40℃均能生长,超过40℃对菌体的生长速率产生一定的影响,但仍然能分化产孢;在45℃下生长速率停止,基本不生长、不产孢,菌体出现软化、明显的衰退和死亡现象。A.hennebergii的最适产酶温度为32~34℃。
2.3.4 不同初始乙醇体积质量对A.hennebergii生长及产酶的影响 A.hennebergii菌株分离筛选于白酒酿造过程,因此考察了不同初始乙醇体积质量对菌株生长和产酶的影响,结果见图4。
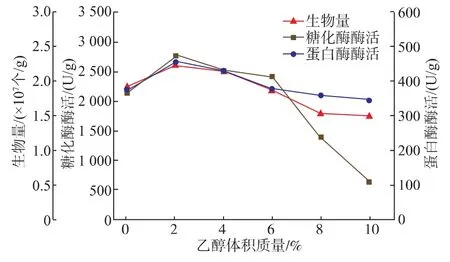
图4 初始乙醇体积质量对A.hennebergii生长及产酶的影响Fig.4 Effect of initial alcohol content on the growth and enzyme production of A.hennebergii
从图4可知,高乙醇体积质量 (>8%)对A.hennebergii的生长和产酶均存在抑制,低乙醇体积质量(2%)有利于其生长和酶的分泌,其机制尚不完全清楚。高乙醇体积质量对糖化酶的分泌影响较蛋白酶大,乙醇体积质量超过8%后糖化酶的分泌呈现大幅度下降。乙醇体积质量达到8%后菌株的生长放缓,菌体浓度下降,相应条件下曲的酶活也呈现下降态势。
2.3.5 不同氮源对A.hennebergii生长及产酶的影响 按1.4节所述氮源应用方法进行实验和分析,A.hennebergii的生长及产酶结果见图5。
由图5可看出,不同氮源对A.hennebergii生长及产酶存在差异;生物量与酶的分泌存在一定的正相关,但不完全严格相关,(NH4)2SO4有利于糖化酶的分泌,NaNO2和酵母浸膏有利于菌株的生长和蛋白酶分泌。分析结果表明,空白样即新鲜麸皮为载体培制麸曲,其菌株生物量与分泌主要酿造酶——糖化酶和蛋白酶与试验应用氮源效果相比,差异不大,麸皮完全可作为A.hennebergii生产菌体和制酶的优质天然载体。
2.3.6 不同碳源对A.hennebergii生长及产酶的影响 对A.hennebergii生长及酶分泌进行分析测定,结果见图6。
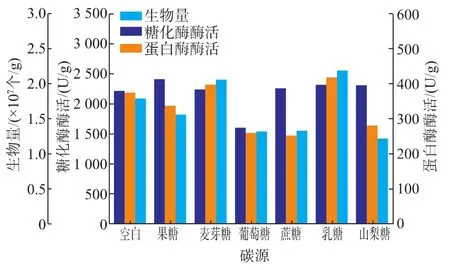
图6 碳源对A.hennebergii生长及产酶的影响Fig.6 Effect of carbon source on the growth and enzyme production of A.hennebergii
由图6可看出,乳糖和麦芽糖对A.hennebergii的生长和产酶有利,山梨糖、蔗糖、果糖可促进其糖化酶的分泌,新鲜麸皮载体空白样的生物量、酶分泌虽然在单一指标上不是很高,但从糖化酶、蛋白酶整体分泌的趋势上是有优势的,从传统固态法白酒酿造过程的双边发酵和风味形成机制上分析,新鲜麸皮作为载体是可以满足的,其原因可能为新鲜麸皮富含碳源、氮源、无机盐、微量元素等,能够满足A.hennebergii生长,但当加入不同的单体营养成分时,由于其量的富集虽然可能一定程度上有利于生物量的积累,但同时也导致底物过剩,改变了酶分泌代谢途径,影响胞外酶的富集,具体的代谢机制仍需进一步研究。
2.3.7 不同无机盐对A.hennebergii生长及产酶的影响 按1.4节所述无机盐设计方法进行实验,A.hennebergii的生长及产酶结果见图7。从图7可知,在新鲜麸皮培养基中单独添加不同的钾、钠、磷、镁、锌等盐,对A.hennebergii的生长和产酶影响存在差异。整体结果比较而言,硫酸钠有利于A.hennebergii的生长和酶的分泌,其次为空白新鲜麸皮;较空白新鲜麸皮的效果而言,部分盐的添加还存在对菌生长和酶分泌的抑制现象,如NaCl、NH4NO3、KCl、NaH2PO4,就其原因可能为不同盐离子浓度的富集在一定程度上改变了细胞膜的电荷平衡,从而影响其生长和细胞的通透性,一定程度上可能引起A.hennebergii酶分泌的代谢途径及其胞质的酶渗透性改变;同时,不同离子的富集在一定程度上也会导致发酵环境条件的改变,如pH条件、新鲜麸皮中营养因子被A.hennebergii利用的效率等,从而进一步影响了A.hennebergii的生物量和曲中糖化酶及蛋白酶的富集。

图7 营养盐对A.hennebergii的生长及产酶影响Fig.7 Effect of nutritional salts on the growth and enzyme production of A.hennebergii
3 结语
从酱香白酒酿造主要工艺环节及其酿造环境样品中共分离曲霉103株,分别鉴定为10个种属种,即 A.niger、A.oryzae、A.terreus、A.tubingensis、A.flavus、A.hennebergii、A.fumigatus、A.niveus、A.candidus和Monascus。糖化酶、蛋白酶分析结果表明,A.niger、A.tubingensis、A.hennebergii更适宜传统固态发酵的双边发酵机制,为酿造过程糖化酶、蛋白酶分泌优势菌株,特别是曲霉A.hennebergii。
发酵基质初始水分在体积分数50%和初始pH在3.5~4.0条件下有利于A.hennebergii的生长和酶的分泌;A.hennebergii的适宜生长温度范围为30~35℃,酶分泌温度为32~34℃;高乙醇体积质量(>8%)对A.hennebergii的生长和产酶存在抑制,对糖化酶的分泌影响较蛋白酶大,低乙醇体积质量(2%)反而有利于其生长和酶的分泌。
氮源实验结果表明,(NH3)4SO4有利于A.hennebergii糖化酶的分泌,NaNO2和酵母浸膏有利于其生长和蛋白酶的分泌;乳糖和麦芽糖对A.hennebergii的生长和产酶有利,山梨糖、蔗糖、果糖可促进菌株糖化酶的分泌。
在新鲜麸皮培养基中单独添加硫酸钠有利于A.hennebergii的生长和酶的分泌,其次为空白新鲜麸皮;新鲜麸皮富含碳源、氮源、无机盐、微量元素等,为A.hennebergii菌体生产及制酶的优质天然载体,能满足传统固态白酒酿造过程的双边发酵和风味形成机制需求。
[1]Xu Y,Ji K.Moutai(Maotai):production and sensory properties.Alcoholic beverages:sensory evaluation and consumer research [J].Cambridge:Woodhead Publishing,2012:315-330.
[2]余伟民,曾志,吴生文,等.红曲霉对特香型白酒风味风格物质影响[J].中国酿造,2012,31(3):87-91. YU Weimin,ZENG Zhi,WU Shengwen,et al.Influence of Monascus on the style and flavor components of special-flavor liquor [J].China Brewing,2012,31(3):87-91.(in Chinese)
[3]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:93-627.
[4]Lessard M H,Belanger G,St-Gelais D,et al.The composition of camembert cheese-ripening cultures modulates both mycelial growth and appearance[J].Applied and Environmental Microbiology,2012,78(6):1813-1819.
[5]Le Dréan G,Mounier J,Vasseur V,et al.Quantification of Penicillium camemberti and P.roqueforti mycelium by real-time PCR to assess their growth dynamics during ripening cheese[J].International Journal of Food Microbiology,2010,138(1-2):100-107.
[6]Zheng X W,Tabrizi M R,Nout M J R,et al.Daqu-A traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing,2011,117(1):82-90.
[7]杨帆,林琳,王和玉,等.拟青霉固态发酵代谢产物分析[J].酿酒科技,2011,205(7):41-43,46.YANG Fan,LIN Lin,WANG Heyu,et al.Analysis of metabolites of Paecilomyces varioti by solid fermentation[J].Liquor-Making Science&Technology,2011,205(7):41-43,46.(in Chinese)
[8]Zhang X,Wu Z,Zhang S,et al.Phylogenetic analysis of 18S rDNA sequence of mold from Luzhou-flavor daqu[J].Journal of Appplied Environmental Biology,2012,17(3):334-337.
[9]黄永光,黄旭,黄平.茅台酒酿酒极端环境与极端酿酒微生物[J].酿酒科技,2006,12(150):47-50. HUANG Yongguan,HUANG Xu,HUANG Pin.Extreme liquor-making environment&extreme liquor-making microbesof maotai liquor[J].Liquor-making Science&Technology,2006,12(150):47-50.(in Chinese)
[10]Huang Y G,Wu Q,Xu Y.Isolation and identification of a black Aspergillus strain and the effect of its novel protease on the aroma of Moutai-flavoured liquor[J].Journal of the Institute of Brewing,2014,120(3):268-276.
[11]Wang H Y,Gao Y B,Fan Q W,et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J].Letters in Applied Microbiology,2011,53(2):134-140.
[12]中华人民共和国卫生部.GB/4789.15-2010食品微生物学检验霉菌和酵母计数[S].北京:北京标准出版社,2010.
[13]诸葛健,李华钟.微生物学[M].第二版.北京:科学出版社,2009:98-131.
[14]Chen B,Wu Q,Xu Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai-flavor liquor[J].International Journal of Food Microbiology,2014,179:80-84.
[15]Wu Q,Chen L,Xu Y.Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavor liquor[J]. International Journal of Food Microbiology,2013,166:323-330.
[16]Anson M.The estimation of pepsin,trypsin,papain,and cathepsin with hemoglobin[J].Journal of Genetic Physiol,1938,22:79-89.
[17]Michelin M,Ruller R,Ward R J,et al.Purification and biochemical characterization of a thermostable extracellular glucoamylase produced by the thermotolerant fungus Paecilomyces variotii[J].Journal of Industrial Microbiology&Biotechnology,2007,35(1):17-25.
[18]Michelin M,Silva T M,Benassi V M,et al.Purification and characterization of a thermostable α-amylase produced by the fungus Paecilomyces variotii[J].Carbohydrate Research,2010,345(16):2348-2353.
[19]Postollec F,Falentin H,Pavan S,et al.Recent advances in quantitative PCR(qPCR)applications in food microbiology[J].Food Microbiology,2011,28(5):848-861.
[20]范光先,王和玉,崔同弼,等.茅台酒生产过程中的微生物研究进展[J].酿酒科技,2006,148(10):75-77. FAN Guangxian,WANG Heyu,CUI Tongbi.Researching development of Maotai microorganisms[J].Liquor-Making Science &Technology,2006,148(10):75-77.(in Chinese)
[21]Xiu L,Kunliang G,Hongxun Z.Determination of microbial diversity in Daqu,a fermentation starter culture of Maotai liquor,using nested PCR-denaturing gradient gel electrophoresis[J].World Journal of Microbiology and Biotechnology,2012,28(6):2375-2381.
[22]杨代永,范光先,汪地强,等.高温大曲中的微生物[J].酿酒科技,2007,155(5):37-38. YANG Daiyong,FAN Guangxian,WANG Diqiang,et al.Microbes in high temperature starter[J].Liquor-Making Science& Technology,2007,155(5):37-38.(in Chinese)
[23]蒋红军.茅台酒生态环境中酿造微生物多样性的研究及展望[J].酿酒,2003,30(4):22-25.JIANG Hongjun.The prospect and study of the multiformities of the brewing microbe of the environments in maotai liquids[J]. Liquor Making,2003,30(4):22-25.(in Chinese)
[24]Li X R,Ma E B,Yan L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J]. International Journal of Food Microbiology,2011,146(1):31-37.
[25]Fei D B,Quan Y Y,Ye L L,et al.Studies on the characteristics of feed acid proteinase by Aspergillus niger strain 6042 and its application[J].Acta Agriculturae Zhejiangensis,1997,9(6):300-304.
[26]Adler-Nissen J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid[J].Journal of Agricultural and Food Chemistry,1979,27(1):256-262.
[27]Li Z,Bai Z,Wang D,et al.Cultivable bacterial diversity and amylase production in three typical Daqus of Chinese spirits[J]. International Journal of Food Science&Technology,2013,64(5):1-11.
Isolation of Aspergillus from Jiangxiang Liquor Fermentation Environment and Enzyme Secretion Stress Conditions of Aspergillus hennebergii
HUANG Yongguang1,2, XU Yan*1
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.Liquor-Making Science&Technology Publishing House,Guiyang 550007,China)
The ecological distribution of Aspergillus in the samples obtained at the key points of Jiangxiang liquor fermentation process in Maotai village and the effect of solid fermentationsimulated by fresh bran medium on the growth of predominant strain Aspergillums hennebergii and the main stress conditions of glucoamylase and protease secretion were analyzed in this paper.One hundred and three strains were obtained and identified as A.niger,A.oryzae,A.terreus,A.tubingensis,A.flavus,A.hennebergii,A.fumigatus,A.niveus,A.candidus and Monascus,respectively.The suitable conditions for the growth and protease secretion of Aspergillums hennebergii were 50%water content of the fermentation substrate and the pH value of 3.5-4.0.The suitable growth temperature of Aspergillums hennebergii was 30~35℃,whereas the suitable enzyme secretion temperature was 32~35 ℃.High alcohol contents(>8%,v/w)inhibited the growth and enzyme secretion of Aspergillums hennebergii,while low alcohol contents(2%,v/w),lactose,and maltose promoted its growth and enzyme secretion.The salt of(NH3)4SO4and NaNO2and yeast could promote its growth,glucoamylase and protease secretion.Moreover,sorbose,sucrose and fructose could promote its glucoamylse secretion.The individual addition of sodium sulphate could promote its growth and enzyme production.Fresh bran,which was rich in carbon source,nitrogen source,inorganic salts and trace elements,could provide high-quality natural carrier for Aspergillums hennebergii growth and enzyme production.The application of Aspergillums hennebergii can satisfy the need of bilateral fermentation and flavor forming mechanism in traditional solid fermentation of liquor.
Jiangxiang liquor fermentation,ecological distribution of Aspergillus,Aspergillus hennebergii,enzyme secretion,stress conditions
TS261.1
A
1673—1689(2015)08—0814—08
2014-09-11
国家863计划重点项目(2012AA021301);国家支撑计划重点项目(2008BAI63B06);中国白酒169计划项目。
黄永光(1976—),男,贵州石石千人,工学博士,研究员,硕士研究生导师,主要从事酿酒科学与产业经济、政策分析方面的研究。E-mail:gzhyg_03@163.com
*通信作者:徐 岩(1962—),男,浙江慈溪人,工学博士,教授,博士研究生导师,主要从事酿酒科学与酶技术方面的研究。E-mail:yxu@jiangnan.edu.cn

