重组枯草芽孢杆菌高产氨肽酶策略与提取工艺优化
孔 峰, 田亚平
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
重组枯草芽孢杆菌高产氨肽酶策略与提取工艺优化
孔 峰, 田亚平*
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
研究不同的产酶促进剂(渗透压调节剂、表面活性剂、有机酸盐)对重组枯草芽孢杆菌产氨肽酶的影响,并对氨肽酶的提取工艺进行优化。获得产酶促进剂优化组合为:氯化钾0.1 mol/L、吐温802.4 μL/mL、L-谷氨酸钠0.6%、酒石酸钾0.7%;优化培养条件为:装液量60 mL/250 mL、初始pH 7.5、接种体积分数5%、转速220 r/min、培养时间36 h。在上述优化条件下,该重组菌株产氨肽酶酶活达232.5 U/mL,是优化前的3.32倍。该重组氨肽酶发酵液经低速离心、双水相萃取、超滤浓缩提取后,回收率达67.23%,纯化倍数为8.29。
氨肽酶;发酵优化;提取工艺
氨肽酶作为一种外切型蛋白酶,可切除蛋白质和多肽链N-末端的氨基酸残基,因而具有提高蛋白质原料的水解度,脱除蛋白质水解液的苦味及制备多功能活性肽等作用,在食品、医药、发酵、饲料等方面具有广泛的应用前景[1-2]。
在酶制剂生产过程中,高产和高回收率往往是人们不断追求的目标。高产的策略往往可以从3方面入手:1)优良菌种的选育和工程菌构建;2)产酶过程的条件优化;3)添加产酶促进剂。优良菌种的选育和工程菌构建是酶制剂生产的前提,良好的菌种能够大大提高产酶量,如汪晓东[3]利用重组质粒与原生质体进行遗传转化,获得重组转化菌,产酶水平是出发菌的16倍。适合的培养条件对提高和稳定产酶水平有较大的作用,如须瑛敏[4]对氨肽酶野生菌培养条件进行优化后,氨肽酶的产量比优化前提高了4.58倍。在此基础上,添加适量的产酶促进剂,往往可以进一步提高产酶量和生产效率。
我们把能够促进产酶的物质统称为产酶促进剂,它包括诱导物、有机酸盐、表面活性剂、渗透压调节剂等。诱导物一般是酶的作用底物或底物类似物,也可以是酶反应产物或产物类似物,如木霉菌生产纤维素酶时,添加槐糖作为诱导物能有效地缩短产酶间隔时间[5];表面活性剂一般会增加细胞的通透性,使细胞内的酶易于分泌出来从而提高产酶。如刘军[6]等人研究发现,吐温80对嗜热脂肪芽孢杆菌发酵产胞外高温蛋白酶有一定促进作用,添加0.1%吐温80可使发酵液酶活提高12.7%;有机酸盐提高产酶的原因有很多,如有机酸盐可以作为细胞内某些酶或辅酶的前体物质,或者可以促进这些前提物质的合成[7-8];有机酸盐还可以作为小分子调节剂,它的有机酸根可以作为一种金属离子螯合剂[9],可以螯合某些重要的金属离子,进而影响酶合成的性能。如吴青[10]在对平菇液态发酵稻草秸秆产生木质素降解酶系的过程中,加入1 mmol/L醇酸盐能够提高漆酶酶活达2.05倍。
本课题组高新星[11]构建了一株产氨肽酶的重组枯草芽孢杆菌,曹松龙[12]对此菌的发酵培养条件进行了初步优化,作者在他们工作的基础上,利用产酶促进剂对重组枯草芽孢杆菌产氨肽酶的发酵条件进行优化;利用双水相萃取技术优化提取工艺,以提高氨肽酶的产量、简化提取工艺并提高氨肽酶的回收率和纯化倍数。
1 材料与方法
1.1 菌种
重组枯草芽孢杆菌:从枯草芽孢杆菌Zj016筛选得到氨肽酶的基因,并在枯草芽孢杆菌表达体系中实现高效表达。
1.2 主要试剂和仪器
酵母浸膏、K2HPO4、CoCl2、可溶性淀粉、甘油、聚乙 二 醇 600 (PEG600)、PEG1000、PEG2000、PEG4000、硫酸铵、牛血清白蛋白、考马斯亮蓝R250:均为分析纯。
BCD-208K型低温冰箱:青岛海尔股份有限公司;722型分光光度计:上海第三分析仪器厂;SHZ-22电热恒温水浴锅:上海医疗器械五厂;高速冷冻离心机himac CR22G:日本日立(HITACHI)公司。
1.3 实验方法
1.3.1 种子培养 取适量的保存菌液接种到种子培养基中,摇床培养:37℃、220 r/min培养10 h。
1.3.2 液态发酵培养 将培养好的种子培养液按体积分数5%的接种量接种到液体发酵培养基中,37℃、220 r/min摇床培养36 h。
1.3.3 制备粗酶液 菌种活化后接种到种子培养基中培养10 h,然后转接到发酵培养基中摇瓶培养36 h。离心后取上清液,4℃保存。
1.3.4 双水相萃取法 固定双水相萃取体系的总质量为10 g,将一定量确定浓度的PEG和硫酸铵溶液混合,加入2 mL的粗酶液,不足的部分以蒸馏水补充。萃取后,静置一段时间,当两相达到相分离后,分别测定上相和下相的体积、酶活力、蛋白质含量。相关计算公式如下:相比(R)=上相体积/下相体积;酶活力分配系数(Ke)=上相酶活力/下相酶活力;蛋白质分配系数 (Kp)=上相蛋白含量/下相蛋白含量;收率(Ye)=1/(1+RKe);纯化倍数=下相中氨肽酶比酶活/发酵液中氨肽酶比酶活。
1.3.5 蛋白质含量测定 采用考马斯亮蓝染色法,以牛血清蛋白作为标准蛋白,标准曲线方程为:
Y=1.001 5X+0.014 8 (R2=0.998)
式中,Y为波长405 nm处测定的吸光值;X为蛋白质质量浓度(μg/mL)。
1.3.6 L-亮氨酸氨肽酶的酶活力测定 采用紫外分光光度法(LNA法),于2 mL、50 mmol/L、pH 8.5的Tris-HCl缓冲液中加入1 mL稀释一定倍数的酶液,然后加入1 mL的L-亮氨酸-对硝基苯胺,混合均匀,50℃水浴反应10 min,于405 nm处测定吸光值。计算公式为:

式中,X为样品的酶活力 (U/mL);N为405 nm处测定的吸光值;Y为粗酶液的稀释倍数。
酶活力的定义:在特定条件下(50℃),每分钟催化L-亮氨酸-对硝基苯胺产生1 μmol的对硝基苯胺所需的酶量,即为一个酶活力单位(U)。
2 结果与讨论
2.1 发酵优化
2.1.1 渗透压调节剂对产酶的影响 在初糖浓度较低的培养基中,微生物生长环境中的渗透压较低,考虑到渗透压对氨肽酶的产生有可能有较大影响,以氯化钠、氯化钾、甘露醇、蔗糖作为渗透压调节剂,加入到发酵培养基中,常规培养为对照,种子液以4%的接种体积分数到发酵培养基中,37℃、220 r/min摇床培养36 h。
微生物对环境的渗透压有一定的适应范围,在此范围内,当微生物生长的环境中水活度下降时,细胞内的水分会流向环境,处于低水活度中的微生物细胞用于抵御细胞内水分流失的通常机制是,提高细胞内一种或多种相溶性物质的累积[13]。由图1~图4可知,4种渗透压调节剂对细胞生长有一定的影响,加入渗透压调节剂后,生物量比对照明显减小,这说明过高的渗透压会抑制细胞生长。当以氯化钠、氯化钾作为渗透压调节剂时,浓度分别在0.3、0.1 mol/L时酶活达到最大值,分别是102、110 U/mL,综合考虑,选择的氯化钾作为促进产酶的渗透压调节剂。

图1 甘露醇对产酶和生物量的影响Fig. 1 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of mannitol

图2 蔗糖对产酶和生物量的影响Fig. 2 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of sucrose
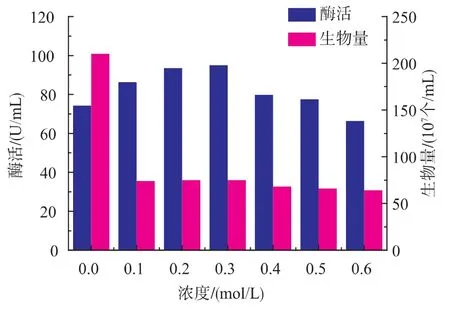
图3 氯化钠对产酶和生物量的影响Fig. 3 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of NaCl

图4 氯化钾对产酶和生物量的影响Fig. 4 ffects of aminopeptidase production by recombinant Bacillus subtilis in the present of KCl
2.1.2 表面活性剂对产酶的影响 在摇瓶培养中,向发酵培养基中分别加入吐温20、吐温80、曲拉通X-100、SDS等4种表面活性剂,以不添加表面活性剂的发酵培养作为对照,分别考察表面活性剂对重组枯草芽孢杆菌生长和产酶的影响。
表面活性剂一方面对难溶的疏水性有机物有增溶作用,加强了有机相和水相的传质作用,以提高微生物对有机物的利用。另一方面,表面活性剂具有改变细胞膜通透性的作用,加快了细胞内外的物质传递[14]。由图5~图8可知,4种表面活性剂对细胞的生长都有一定的抑制作用,随着浓度的增加,酶活均先增加后减小,其中,以吐温80作为表面活性剂时,酶活变化较为明显,当体积分数为2.0 μL/ mL时,酶活达到152 U/mL。综合考虑,选择吐温80作为促进产酶的表面活性剂。

图5 吐温80对产酶和生物量的影响Fig. 5 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of Tween-80
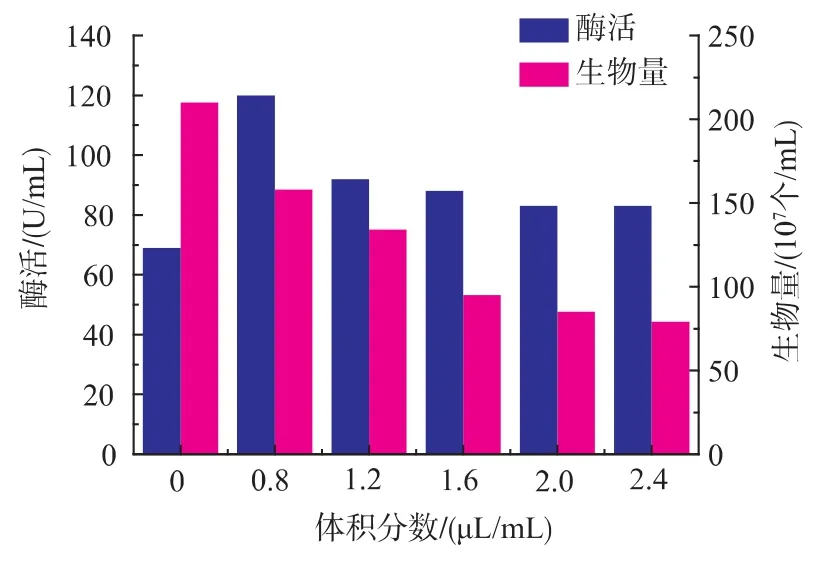
图6 吐温20对产酶和生物量的影响Fig. 6 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of Tween-20

图7 曲拉通X-100对产酶和生物量的影响Fig. 7 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of triton X-100
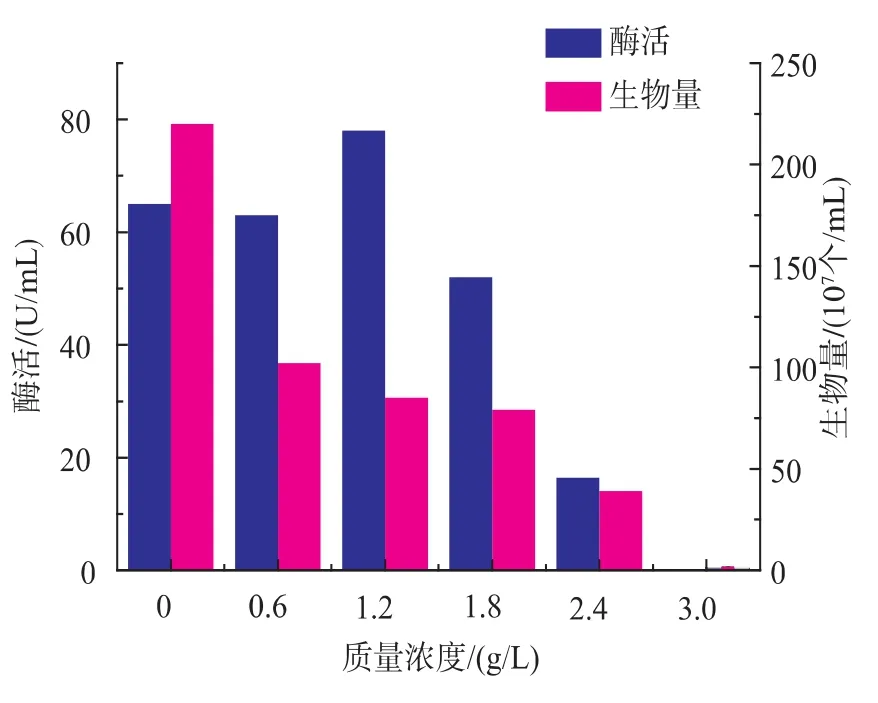
图8 SDS对产酶和生物量的影响Fig. 8 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of SDS
2.1.3 有机酸盐对产酶的影响 在摇瓶发酵培养中,向发酵培养基中分别加入柠檬酸钠、酒石酸钾、L-谷氨酸钠、乙二酸钠4种有机酸盐,以不添加有机酸盐的发酵培养作为对照,分别考察有机酸盐对重组枯草芽孢杆菌生长和产酶的影响。
一般来说,有机酸盐是通过提高微生物产酶性能来提高酶的合成,而不是仅通过提高微生物生长的群体优势来提高的。如图9~图12可知,4种有机酸盐均能促进酶的合成,其中,酒石酸钾和L-谷氨酸钠对酶合成的促进作用最好,当两者质量浓度分别为0.7、0.5 g/dL时,酶活力分别达到122、157 U/mL。
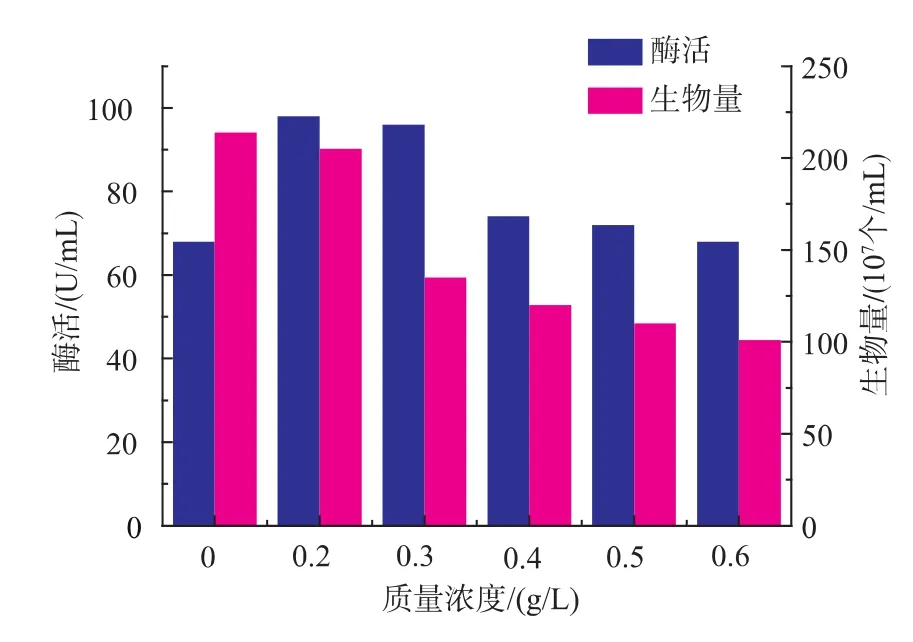
图9 柠檬酸钠对产酶和生物量的影响Fig.9 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of Sodium citrate

图10 酒石酸钾对产酶和生物量的影响Fig.10 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of potassium tartrate

图11 L-谷氨酸钠对产酶和生物量的影响Fig.11 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of L-sodium glutamate

图12 乙二酸钠对产酶和生物量的影响Fig.12 Effects of aminopeptidase production by recombinant Bacillus subtilis in the present of sodium oxalate
2.1.4 正交实验 为提高摇瓶发酵酶活,综合考虑单因素实验结果,以酶活为考察指标,以氯化钾浓度(A)、吐温80体积分数(B)、L-谷氨酸钠质量浓度(C)、酒石酸钾质量浓度(D)为考察因素,采用L9(34)正交实验,结果见表1。

表1 正交实验设计与结果Table 1 Results of orthogonal experiments
可以看出,氯化钾、吐温80、L-谷氨酸钠、酒石酸钾四种因素对发酵酶活的影响程度依次为:氯化钾>吐温80>L-谷氨酸钠>酒石酸钾。最优组合为:氯化钾0.1 mol/L、吐温80 2.4 μL/mL、L-谷氨酸钠0.6 g/dL、酒石酸钾0.7 g/dL。在此组合下发酵液酶活达到207.6 U/mL。4种促进产酶的方法中,空白对照组的酶活有些差异,出现这种情况的原因可能是系统误差。
2.1.5 发酵培养条件优化 在获得最优产酶促进剂组合后,对重组枯草芽孢杆菌产氨肽酶的发酵培养条件进行优化,获得最优培养条件为:最适培养温度37℃、最适装液量60 mL/250 mL、最适初始pH 7.5、最适转速220 r/min、最适接种体积分数5%、培养时间36 h。在此条件下对重组枯草芽孢杆菌进行培养,氨肽酶酶活达到232.5 U/mL。
2.2 提取工艺优化
本课题组原有对氨肽酶的提取工艺为:发酵液絮凝→过滤除菌→盐析→离心→超滤浓缩→冷冻干燥,该提取工艺所需提取步骤较多、提取时间较长、不便于连续操作和过程放大。为更好的适应工业化生产的要求,对氨肽酶的提取工艺进一步的优化,通过发酵液低速离心→双水相萃取→超滤浓缩→冷冻干燥等步骤,使提取工艺易于连续操作和过程放大,降低能耗,缩短提取时间。
2.2.1 双水相萃取条件确定
1)PEG相对分子质量对酶分离纯化的影响:以15%的硫酸铵为成相盐,分别以15%的PEG600、PEG1000、PEG2000、PEG4000作为成相聚合物,加入2 mL的粗酶液,构成10 g双水相萃取体系。考察不同相对分子质量的PEG对酶萃取的影响,当两相达到相分离后,两相界面出现白色膜状沉淀物,氨肽酶主要分配于下相,实验结果见表2。

表2 不同相对分子质量的PEG对酶分离纯化的影响Table 2 Effects of different PEG molecular weights on aqueous two phase extraction of aminopeptidase
由表2可以看出:随着PEG相对分子质量的增加,相比与蛋白质分配系数都逐渐下降,回收率逐渐上升。这主要是由于同一聚合物的疏水性随着相对分子质量的增加而增大,当PEG相对分子质量增加时,在质量浓度不变的情况下,其两端的羟基数减少,疏水性增加,亲水性的蛋白质不再向富含PEG相中聚集,而转向另一相,另一方面,随着PEG相对分子质量的增加,体系的黏度增加,不利于蛋白质分子在相与相之间的转移[15]。综合回收率和纯化倍数考虑,PEG相对分子质量为1 000时萃取效果较好。故选择PEG1000作为成相聚合物。
2)硫酸铵质量分数对酶分离纯化的影响:选用15%的PEG1000为成相聚合物,不同质量分数硫酸铵作为成相盐,加入2 mL粗酶液,构成10 g双水相萃取体系。考察不同质量分数的硫酸铵对酶萃取的影响,随着硫酸铵质量分数增加,两相界面出现的白色膜状沉淀物变多,氨肽酶主要分配于下相,结果见表3。

表3 不同质量分数的硫酸铵对酶分离纯化的影响Table 3 Effects of(NH4)2SO4concentrations on aqueous two phase extraction of aminopeptidase
双水相萃取体系的形成过程是PEG与硫酸铵相互争夺水分子的过程,随着硫酸铵质量分数的增加,水分子趋向分配于盐相,使得相比减小。由于硫酸铵质量分数的增加,使得蛋白质表面的水化层被破坏,发生蛋白质的盐析作用,使得酶回收率下降[16]。实验表明,随着硫酸铵质量分数的增加,相比逐渐减小,蛋白质分配系数逐渐增大。综合酶的回收率和酶的纯化倍数考虑,当硫酸铵的质量分数为18%时,有利于酶的分离纯化。
3)PEG1000质量分数对酶分离纯化的影响:选用18%硫酸铵作为成相盐,不同质量分数的PEG1000为成相聚合物,加入2 mL粗酶液,构成10 g双水相萃取体系。考察不同PEG1000质量分数对酶萃取的影响,结果见表4。
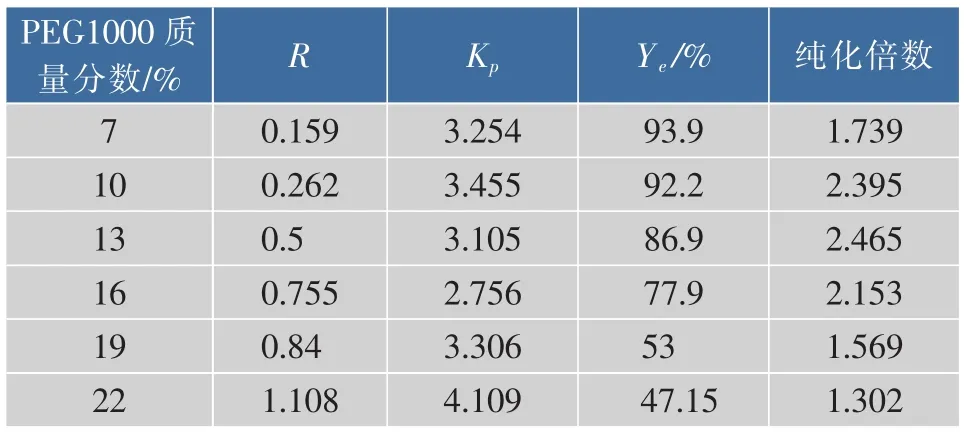
表4 不同质量分数的PEG1000对酶分离纯化的影响Table 4 Effects of PEG1000 concentrations on aqueous two phase extraction of aminopeptidase
在PEG1000/硫酸铵双水相萃取体系中,当PEG1000质量分数相对增加时,一方面,亲水集团增加,亲水性增强,疏水作用降低,表面张力减弱,相比变大,使得体系内蛋白质趋向分配于上相;另一方面,体系的黏度增加,两相间界面张力增加,蛋白质分子转移难度变大。两种因素的共同作用影响分离纯化效果[17]。如表4所示,随着PEG1000的质量分数的增加,相比也增加,酶的回收率减小,蛋白质分配系数先减小后增加。综合考虑酶的回收率和纯化倍数,当PEG1000的质量分数为10%时,分离纯化效果较好。
4)氯化钠质量浓度对酶分离纯化的影响:为考察不同质量浓度的氯化钠对分离纯化的影响,作者以18%硫酸铵作为成相盐,10%的PEG1000为成相聚合物,加入2 mL粗酶液,构成10 g双水相萃取体系,结果见表5。
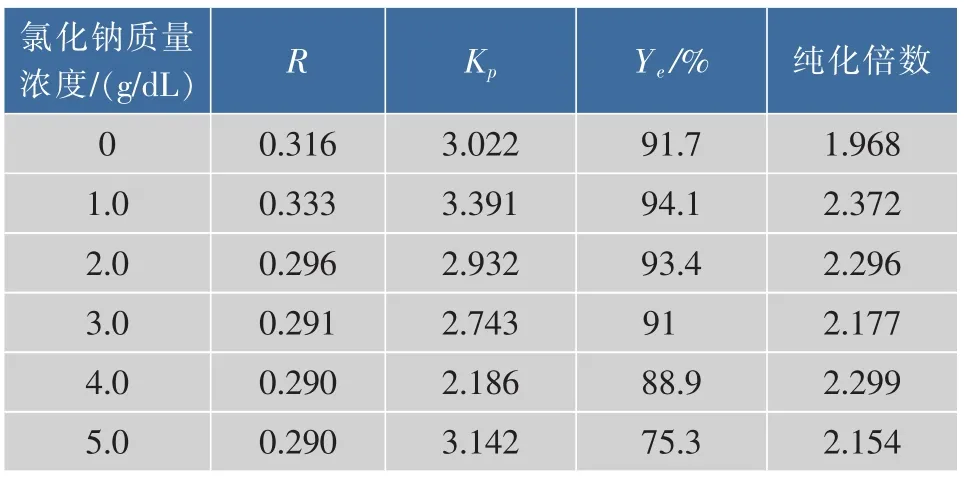
表5 不同质量浓度的氯化钠对酶分离纯化的影响Table 5 Effects of NaCl concentrations on aqueous two phase extraction of aminopeptidase
由于盐的正负离子在两相间的分配系数不同,而两相均须保持电中性,因而在两相中产生电位差,这对带电生物大分子的分配产生很大影响。适当提高离子强度可以加快分相速度,并提高目的产物的选择性[18]。从表5可以看出,随着氯化钠质量浓度的增加,相比、酶的回收率和蛋白质分配系数都先增加后逐渐减小,综合考虑,当氯化钠添加量为1 g/dL时,分离纯化效果较好。
5)pH对酶分离纯化的影响:作者以18%硫酸铵作为成相盐,10%的PEG1000为成相聚合物,加入2 mL粗酶液,构成10 g。用盐酸分别调节体系pH为6.5、7.0、7.5、8.0、8.5、9.0。考察不同pH环境对分离纯化的影响,结果见表6。

表6 不同pH对酶分离纯化的影响Table 6 Effects of different pH values on aqueous two phase extraction of aminopeptidase
体系中的pH一方面可以影响蛋白质中可解离基团的解离度,从而改变蛋白质的所带电荷和分配系数,另一方面可以影响盐的解离程度,改变两相间的电位差,从而影响蛋白质的分配系数[19-20]。从表6可以看出,体系pH对相比的影响较小,回收率随着pH值的变大而逐渐降低。蛋白质分配系数先减小后增加。综合来看,体系pH为8.0时,酶的收率为95.3%,纯化倍数达到3.234,此时的pH对分离纯化最为有利。
2.2.2 重组枯草芽孢杆菌氨肽酶提取工艺的优化结果 双水相萃取体系经放大后,应用到氨肽酶提取工艺中,发酵液最低速离心除去菌体和残留豆粕后,量取710 g发酵液上清液,加入氯化钠10 g、硫酸铵180 g、PEG1000 100 g,调节pH为8.0,构建1 000 g的双水相萃取体系进行氨肽酶的萃取,萃取后,下相萃取液在0.20 MPa的操作压力下,选择30 000的超滤膜进行超滤浓缩脱盐,控制酶液浓缩倍数为3倍,结果见表7。
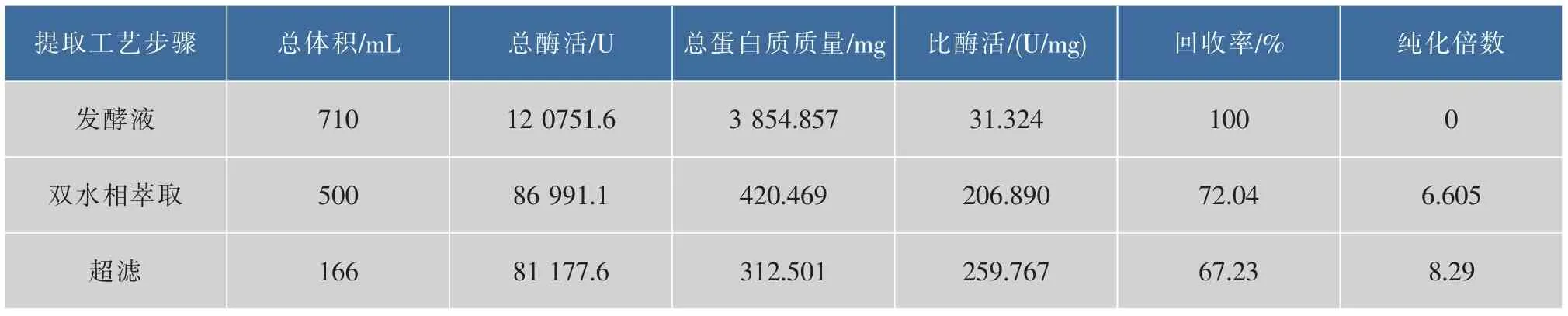
表7 氨肽酶提取工艺各步分离结果Table 7 Optimization results of the extraction of aminopeptidase
从表7可以看出,大多数杂蛋白质在双水相萃取下相中被有效地去除,氨肽酶的最后回收率为67.23%,纯化倍数为8.29。该方法相对于原来提取方法来说,操作步骤少、所需时间短、回收率有一定的增加、纯化倍数提高4.7倍。总体看来,该提取方法,即发酵液低速离心→双水相萃取→超滤浓缩→冷冻干燥能够有效地分离提纯氨肽酶。
3 结语
利用多种产酶促进剂提高重组枯草芽孢杆菌产氨肽酶的能力,并对发酵条件进行优化,经过单因素和正交实验获得产酶促进剂最优组合。发酵结果表明,产酶促进剂能够有效的促进重组枯草芽孢杆菌产氨肽酶,在最优条件下进行发酵培养时,氨肽酶酶活达到232.5 U/mL,是优化前的3.32倍。对原有的氨肽酶提取工艺进行优化后,氨肽酶的回收率和纯化倍数都有所增加,且能耗和提取时间都下降,工艺流程变得简单,易于过程放大。
近年来,随着生物技术的不断发展和创新,酶制剂的应用领域不断延伸,这使得酶制剂行业受到人们越来越广泛的关注。其中氨肽酶已在多个行业(食品、医药、发酵、饲料等)内有较为广泛的应用,对氨肽酶的需求量增加,因而提高氨肽酶的产量及简化氨肽酶提取工艺就变得越来越重要。
[1]田亚平,须瑛敏.一种枯草芽孢杆菌氨肽酶的纯化及酶学性质[J].食品与发酵工业,2006,32(3):7-10. TIAN Yaping,XU Yingmin.Purification and characteristic of a kind of aminopeptidase from Bacillus subtilis[J].Food and Fermentation Industries Editorial Staff,2006,32(3):7-10.(in Chinese)
[2]须瑛敏.氨肽酶脱苦效果的研究[J].食品与药品,2007,9(11):36-39. Xu Yingmin.Study on debittering effect of aminopeptidase[J].Food and drug,2007,9(11):36-39.(in Chinese)
[3]汪晓东.原生质体转化选育枯草芽孢杆菌产氨肽酶的研究[D].无锡:江南大学,2013.
[4]须瑛敏.枯草芽孢杆菌氨肽酶的研究[D].无锡:江南大学,2005.
[5]Loewenberg J R,Chapman C M.Sophorose metabolism and cellulose inducion in Trichoderma[J].Arch Microbiol,1977,113(1-2):61-64.
[6]刘军,陈向东,戴玄,等.表面活性剂对嗜热脂肪芽孢杆菌产高温蛋白酶的影响[J].微生物学杂志,2004,24(6):58-61. LIU Jun,CHEN Xiangdong,DAI Xuan,et al.Effect of surfactant on production of thermophilic protease from Bacillus stearothermophilus[J].Journal of Microbiology,2004,24(6):58-61.(in Chinese)
[7]Zhang Y S,Zhang Z Y,Suzuki K,et al.Uptake and mass balance of trace metals for methane producing bacteria[J].Biomass and Bioenergy,2003(25):427-433.
[8]KIDA K,SHIGEMATSU T,KIJIMA J,et al.Influence of Ni2+and Co2+on methanogenic activity and the amounts of coenzymes involved in methanogenesis[J].J Biosci Bioeng,2001(91):590-595.
[9]Shmiada M,Akamatsu Y,Hattori T,et al.Aproposedrole of oxalic acid in wood decay systems of wood-rotting basidiomycetes [J].FEMSM icrobiol Rev,1994,13:285-296.
[10]吴青.平菇液态发酵稻草秸秆产生木质素降解酶系及对直接湖蓝5B脱色的研究[D].芜湖:安徽师范大学,2012.
[11]Gao X,Cui W,Tian Y,et al.Over-expression,secretion,biochemical characterisation,and structure analysis of Bacillus subtilis aminopeptidase[J].Journal of the Science of Food and Agriculture,2013,93(11):2810-2815.
[12]曹松龙,田亚平.枯草芽孢杆菌氨肽酶超滤提取技术[J].食品与生物技术学报,2013(3):293-297. CAO Songlong,TIAN Yaping.Research of the ultrafiltration on the Bacillus subtilis aminopeptidase extraction[J].Journal of Food Science and Biotechnology,2013(3):293-297.(in Chinese)
[13]Brown A D In:Rose A H,et al.Advances on Microbial Physiology[M].London:Academic Press,1978:181-242.
[14]任石苟,李奠础.表面活性剂在发酵工业中的应用[J].化学与生物工程,2006,23(6):50-52. REN Shigou,LI Dianchu.Application of surfactants in the field of fermentation industry[J].Chemistry&Bioengineering,2006,23(6):50-52.(in Chinese)
[15]Ganapathi Patil,K.S.M.S.Raghavarao.Aqueous two phase extraction for purification of C-phycocyanin[J].Biochemical Engineering Journal,2007,34:156-164.
[16]孟玲,杨丹.双水相体系萃取植物酯酶的研究[J].沈阳化工学院学报,2006,12:256.MENG Ling,YANG Dan,ZHU Jianxing.Extraction of plant esterase by polyethylene glycol ammonium sulfate aqueous two-phase system[J].Journal of Shenyang Institute of Chemical Technolgy,2006,12:256.(in Chinese)
[17]李波,芦菲,张军合,等.双水相萃取法分离纯化α-淀粉酶的研究[J].食品工业科技,2006,8:78. LI Bo,LU Fei,ZHANG Junhe,et al.Study on partition and purification of α-amylase by aqueous two-phase technology[J]. Journal of Food Industry Science and Technology,2006,8:78.(in Chinese)
[18]余红英,孙远明,王炜军,等.双水相萃取直接从枯草芽孢杆菌发酵液中提取β-甘露聚糖酶[J].化学世界,2003,11:569-574. YU Hongying,SUN Yuanming,WANG Weijun,et al.Studies on the extractio n of β-mannanase by PEG/(NH4)2SO4aqueous two-phase system[J].Chemical World,2003,11:569-574.(in Chinese)
[19]冯菁,夏杰,陆兵,等.溶菌酶的双水相萃取法分离[J].华东理工大学学报,2005,12:1012. FENG Jing,XIA Jie,LU Bing,et al.Separation of human lysozyme from fermentation broth of Pichia pastoris by aqueous two-phase extraction[J].Journal of East China University of Science and Technology,2005,12:1012.(in Chinese)
[20]郑楠,刘杰.双水相萃取技术分离纯化蛋白质的研究[J].化学与生物工程,2006,23(10):7-9. ZHENG Nan,LIU Jie.Study on partition and purification of protein by aqueous two-phase technology[J].Chemistry& Bioengineering,2006,12:256.(in Chinese)
Strategy to Obtain High Yield of Aminopeptidase from Recombinant Bacillus subtilis and Its Extraction Process Optimization
KONG Feng, TIAN Yaping*
(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
This study aimed to investigate the effects of different enzyme accelerants on the production of aminopeptidase by recombinant Bacillus subtilis and develop an efficient extract process of aminopeptidase.The results indicated that the enzyme accelerants(KCl at 0.1 mol/L,Tween-80 at 2.4 μL/mL,L-glutamate at 0.6%,potassium tartrate at 0.7%)significantly increased the production of aminopeptidase.The cultural conditions were of 60 mL/250 mL of liquid,5% inoculation size,at 37℃,initial pH 7.5,shake flask rotation 220 r/min,and cultured time 36 h. Under these conditions,the aminopeptidase activity of recombinant Bacillus subtilis could reach 232.5 U/mL.Using the efficient extract process of aminopeptidase,the recovery and the purification fold of the L-leucine aminopeptidase could reach 67.23%and 8.29,respectively.
aminopeptidase,optimization of fermentation,extraction process
Q 55
A
1673—1689(2015)08—0864—09
2014-04-29
国家863计划项目(2011AA100905)。
*通信作者:田亚平(1964—),女,安徽淮南人,工学博士,教授,硕士研究生导师,主要从事生物活性物质方面的研究。E-mail:yapingtian@hotmail.com

