玉米黄素糖基化酶在大肠杆菌中的表达与纯化
汪靖超, 滕守振, 陈秀鹏, 杜桂彩, 郭群群, 李荣贵
(青岛大学 生命科学学院,山东 青岛 266071)
玉米黄素糖基化酶在大肠杆菌中的表达与纯化
汪靖超, 滕守振, 陈秀鹏, 杜桂彩, 郭群群, 李荣贵
(青岛大学 生命科学学院,山东 青岛 266071)
噬夏孢欧文氏菌合成类胡萝卜素涉及的一系列反应都是在相关酶的催化下完成的,其中催化玉米黄素转化为玉米黄素二葡萄糖苷的玉米黄素糖基化酶由基因crtX编码。PCR扩增出噬夏孢欧文氏菌crtX基因,构建重组质粒,转化大肠杆菌。经镍离子树脂亲和层析、DEAESepharose FF离子交换层析纯化,得到了电泳纯的重组噬夏孢欧文氏菌玉米黄素糖基化酶,该重组蛋白在体外具有催化玉米黄素转化为玉米黄素二葡萄糖苷的活性。
噬夏孢欧文氏菌;玉米黄素糖基化酶;活性
类胡萝卜素是一类重要天然色素的总称,目前已经发现了750多种天然类胡萝卜素[1]。类胡萝卜素包括两大类:胡萝卜素类和叶黄素类,所有类胡萝卜素均为含有40个碳的类异戊烯聚合物,呈现红色、橙红色和黄色等各种颜色。动物不能合成类胡萝卜素,类胡萝卜素在预防人体心血管疾病、预防眼睛疾病、预防骨质疏松、防癌抗癌、抗氧化以及增强免疫力等方面起着非常重要的作用[2-4]。
噬夏孢欧文氏菌(Erwinia uredovora)是一种非光合细菌,可在菌体中累积类胡萝卜素——玉米黄素二葡萄糖苷。玉米黄素二葡萄糖苷的合成过程涉及的一系列反应,这些反应都是在相关酶的催化下完成的,其中crtX基因编码玉米黄素糖基化酶(又名:玉米黄素葡萄糖基转移酶),催化玉米黄素转化为玉米黄素二葡萄糖苷[5]。作者利用聚合酶链式反应技术,扩增出噬夏孢欧文氏菌crtX基因,插入表达载体pET-15b,重组质粒转化大肠杆菌,得到了可高效表达重组玉米黄素糖基化酶的工程菌株;经镍离子亲和层析、DEAE-Sepharose FF离子交换层析,获得了电泳纯的重组玉米黄素糖基化酶,该酶在体外有转化玉米黄素为玉米黄素二葡萄糖苷的活性。这为我们进一步研究E.uredovora玉米黄素糖基化酶的结构及催化机理打下了基础,也为酶法合成玉米黄素二葡萄糖苷的应用研究提供了可能。
1 材料与方法
1.1 材料与试剂
Erwinia uredovora菌株:购买自美国模式菌种保 藏 中 心 (American Type Culture Collection,ATCC);试验所需分子生物学工具酶:康为世纪生物科技公司产品;镍离子螯合树脂:北京瑞达恒辉科技公司产品;DEAE-Sepharose Fast Flow:GE Healthcare公司产品;玉米黄素:Chromadex公司产品;玉米黄素二葡萄糖苷:药名康德公司产品,UDP-葡萄糖:Sigma公司产品;其他试剂均为国产分析纯。
1.2 仪器与设备
精密电子天平:美国双杰兄弟有限公司;PCR仪:eppendorf公司;Mini proteinⅡ蛋白质电泳仪:Bio-Rad公司;高效液相色谱系统 LC-20 AT:岛津公司;C18色谱柱:VP-ODS,150 mm×4.6 mm。
1.3 方法
1.3.1 提取E.uredovora基因组总DNA及crtX基因的扩增 提取E.uredovora基因组DNA的方法参照文献[5]的方法进行。根据已发表E.uredovora的crtX基因序列[5],设计出一对引物:引物1:5’-AAACATATGAGCCATTTGG-3’; 引 物 2:5’-AAACTCGAGTCATAATGCGGTTG-3’。其中,引物1中含有NdeⅠ酶切位点,引物2中含有XhoⅠ酶切位点。利用该引物PCR扩增E.uredovora的crtX基因。
1.3.2 转化大肠杆菌,构建基因工程菌菌株 扩增出的crtX基因首先连入pBS-T质粒,转化大肠杆菌DH5α,涂布于含IPTG、X-gal和氨苄青霉素的LB平板,37℃培养过夜。挑取白斑菌落,接种到LB液体培养基(含100 μg/mL氨苄青霉素)培养过夜。提取质粒载体pBS-TcrtX。NdeI和XhoI双酶切鉴定,回收crtX片段,并对其序列进行分析鉴定。
将回收的经过序列分析鉴定的crtX基因片段连接到质粒载体pET-15b上,考虑到NdeI的酶切效率较低,重组质粒载体pET-15bcrtX用XhoⅠ和XbaⅠ双酶切鉴定。鉴定后的重组质粒转化大肠杆菌BL21(DE3)。
1.3.3 重组玉米黄素糖基化酶的纯化 镍离子树脂亲和层析的方法参照文献[6]进行,合并含目的蛋白的洗脱液,离心浓缩管浓缩,上DEAE-Sepharose FF离子交换层析柱(1.0 cm×8.0 cm),用含0~1 000 mmol/L NaCl的缓冲液 (50 mmol/L Tris-Cl,pH 7.5,50 mmol/L EDTA,0.1 mmol/L PMSF)洗脱,流速为1.0 mL/min,对洗脱液中的蛋白质进行SDSPAGE分析。
1.3.4 重组玉米黄素糖基化酶的活性测定 以80 μL纯化的玉米黄素糖基化酶酶液,5 μL、2.7 mmol/L的玉米黄素丙酮溶液、15 μL、6.7 mmol/L的UDP-葡萄糖溶液 (50 mmol/L Tris-Cl,pH 7.5,1 mmol/L巯基乙醇)构建反应体系,避光反应5 h,氯仿/甲醇(体积比为2∶1)抽提,抽提液经HPLC分析。C18色谱柱:VP-ODS(SHIMADZU,150×4.6 mm),流动相A:甲醇/水(体积比95∶5),流动相B:甲醇/四氢呋喃(体积比7∶3);采用线性洗脱,流动相A洗脱5 min,第5~10分钟流动相B从0上升到100%,之后流动相B洗脱保持8 min;流速为1.0 mL/min;进样量为20 μL。
2 结果与分析
2.1 噬夏孢欧文氏菌crtX基因的扩增与重组表达质粒的构建
以提取的完整E.uredovora基因组为模板,PCR扩增出了大小约为1 300 bp的DNA片段,与已报道的crtX基因(1 296 bp)[5]的大小一致,见图1。
将PCR产物克隆到质粒载体pBS-T上构建了pBS-TcrtX,质粒pBS-TcrtX用NdeⅠ与XhoⅠ双酶切后,可切出1 300 bp的目的片段,大小与crtX基因相符。测序分析也显示与文献报道的噬夏孢欧文氏菌crtX基因序列[5]完全一致。将测序正确的crtX基因从pBS-TcrtX上切下,插入pET-15b构建了pET-15bcrtX。由于pET-15b上NdeI和XbaⅠ的酶切位点仅相隔97 bp,质粒pET-15bcrtX用XbaⅠ与XhoⅠ双酶切,切出片段的大小与插入的crtX基因大小差别不大。双酶切结果见图1。切下的片段大小约1 300 bp,大小与预期的一致,说明成功构建了重组表达质粒。
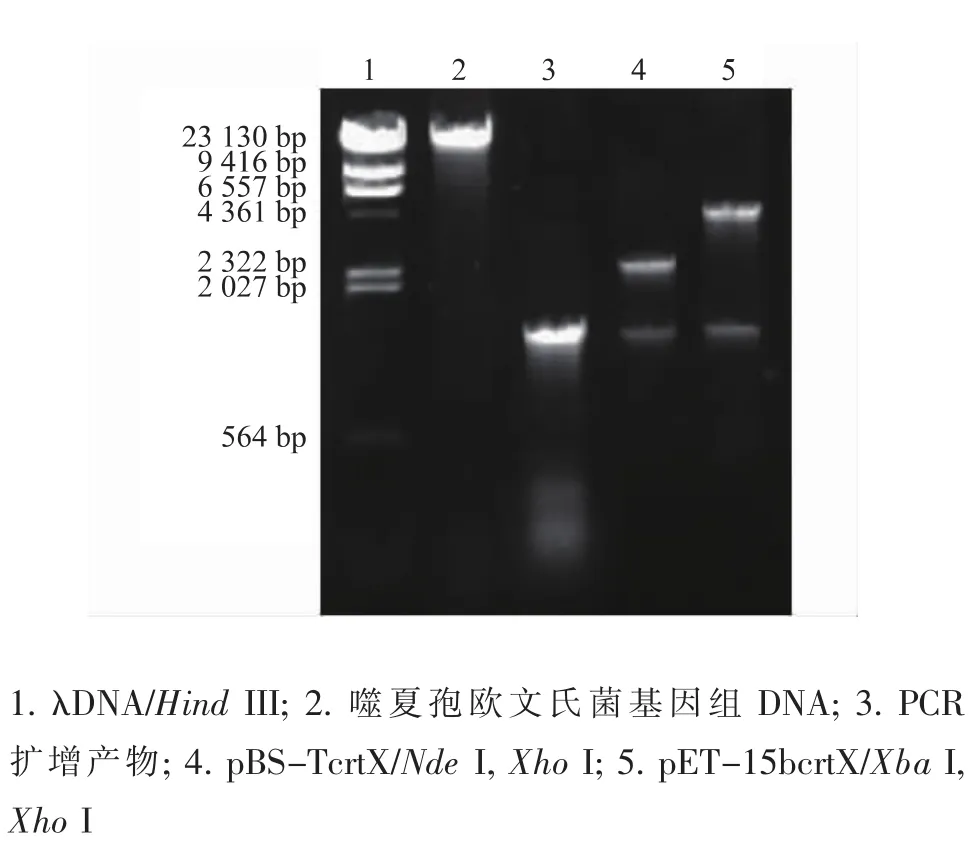
图1 噬夏孢欧文氏菌crtX的PCR扩增及重组质粒的双酶切分析Fig.1 PCR amplification of crtX and restriction digestion analysis of recombinant plasmids
2.2 重组蛋白的表达
噬夏孢欧文氏菌crtX基因的长度为1 296 bp[5],加上pET-15b质粒的His-tag编码区,重组蛋白是由451个氨基酸残基组成。将重组表达质粒pET-15bcrtX转化E.coli BL21(DE3),经IPTG诱导。细菌全蛋白的SDS-PAGE分析表明,与空白E.coli BL21(DE3)相比,工程菌菌体中出现了大量相对分子质量约为45 000的重组蛋白,与预期的重组蛋白相对分子质量大小吻合,也与文献[5]报道的噬夏孢欧文氏菌玉米黄素糖基化酶的相对分子质量大小相符,说明噬夏孢欧文氏菌crtX基因在大肠杆菌菌体内得到了高效表达,见图2。
2.3 重组蛋白的纯化
工程菌经IPTG诱导、超声波细胞破碎、高速离心后,上清液中的可溶性重组玉米黄素糖基化酶经镍离子树脂亲和层析和DEAE-Sepharose FF离子交换层析得到了纯化,纯化后的重组蛋白的相对分子质量在45 000左右。
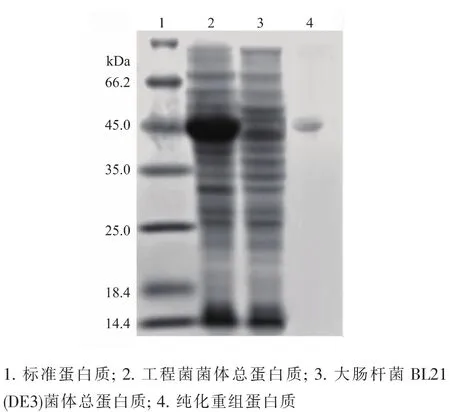
图2 重组玉米黄素糖基化酶在大肠杆菌中的表达Fig.2 Overexpression of zeaxanthin glycosylase in Escherichia coli
2.4 重组蛋白的活性测定
图3—4分别为玉米黄素标准品和玉米黄素二葡萄糖苷标准品的色谱图。以纯化的重组蛋白和玉米黄素标准品、UDP-葡萄糖构建反应体系,避光反应5 h,氯仿/甲醇抽提液经HPLC分析,结果见图5。参照标准品的色谱图,图5中吸收峰3为未反应的底物玉米黄素,吸收峰1为反应产物玉米黄素二葡萄糖苷。吸收峰2位于吸收峰3和吸收峰1之间,由于目前没有玉米黄素一葡萄糖苷商品化标准品的出售,我们推测吸收峰2应该是反应的中间产物玉米黄素一葡萄糖苷。这证明纯化的重组蛋白是有活性的,在体外可催化玉米黄素转化为玉米黄素二葡萄糖苷。以反应底物玉米黄素的消耗量计算,重组玉米黄素糖基化酶的酶活力为0.87 μg/h。

图3 玉米黄素标准品的色谱图Fig.3 HPLC chromatogram of zeaxanthin standards
图4 玉米黄素二葡萄糖苷标准品的色谱图Fig.4 HPLC chromatogram of zeaxanthin diglucoside standards

图5 重组玉米黄素糖基化酶催化玉米黄素反应的HPLC分析Fig.5 Zeaxanthin diglucoside assay by HPLC analysis
3 结语
噬夏孢欧文氏菌在细胞中累积玉米黄素二葡萄糖苷,所以菌体呈黄色。玉米黄素二葡萄糖苷通过异戊二烯化合物和萜类化合物途径合成,Misawa等[5]对噬夏孢欧文氏菌玉米黄素二葡萄糖苷合成的过程以及催化相关反应的酶类及其编码基因进行了分析:类胡萝卜素合成的前体物质法尼基焦磷酸(FPP)、异戊烯焦磷酸 (IPP)在基因crtE编码的GGPP合成酶催化下合成牻牛儿基牻牛儿焦磷酸(GGPP);牻牛儿基牻牛儿焦磷酸在基因crtB编码的八氢番茄红素合成酶的催化下形成无色的八氢番茄红素,八氢番茄红素是整个合成途径中的第一个类胡萝卜素分子;八氢番茄红素在基因crtI编码的八氢番茄红素脱氢酶作用下形成番茄红素;番茄红素在基因crtY编码的番茄红素环化酶的催化下形成β-胡萝卜素;然后β-胡萝卜素在基因crtZ编码的β-胡萝卜素脱氢酶作用下形成玉米黄素;玉米黄素在基因crtX编码的玉米黄素糖基化酶催化下最终形成玉米黄素二葡萄糖苷。汪靖超等[6-8]分别PCR扩增出噬夏孢欧文氏菌crtE、crtB、crtY等基因,构建重组质粒,转化大肠杆菌,IPTG诱导表达,经纯化,获得了相应的噬夏孢欧文氏菌GGPP合成酶、八氢番茄红素合成酶以及番茄红素环化酶等重组蛋白。Seo等[9]将Paracoccus haeundaensis的crtX基因导入质粒pSTV29,构建重组质粒pSTCRT-X,将该质粒转化已含有质粒pET-44a(+)-CrtEBIYZ的大肠杆菌E.coli BL21(DE3),得到了含有合成玉米黄素二葡萄糖苷所需全部基因:CrtE、CrtB、CrtI、CrtY、CrtZ和CrtX的大肠杆菌菌株,该大肠杆菌可在菌体细胞中累积玉米黄素二葡萄糖苷。
疏水性的类胡萝卜素与活性的糖分子缩合,可使类胡萝卜素分子极性增强,疏水性降低。玉米黄素二葡萄糖苷是已知的自然界中极性最强的一种类胡萝卜素,其水溶性比玉米黄素高63倍[10]。通过合成玉米黄素二葡萄糖苷,可使植物和细菌细胞免受过剩光能和活性氧造成的光氧化损害以及稳定细胞膜的作用[11-12]。但玉米黄素二葡萄糖苷在自然界的含量很低,属稀有类胡萝卜素,对其相关性质的研究也非常少,玉米黄素是人眼睛视网膜黄斑区域的主要色素,对眼睛的健康[13-14]、以及抑制肿瘤细胞增殖、增强免疫力等有很重要的作用[15]。但我们对玉米黄素二葡萄糖苷对人体或动物的健康的作用却知之甚少。利用基因工程技术,使大肠杆菌产生重组玉米黄素糖基化酶,就可以人工大量合成玉米黄素二葡萄糖苷这种自然界中的稀有类胡萝卜素,这将为其性质的研究创造了充分的条件。
[1]Choi S K,Osawa A,Maoka T,et al.3-β-Glucosyl-3′-β-quinovosyl zeaxanthin,a novel carotenoid glycoside synthesized by Escherichia coli cells expressing the Pantoea ananatis carotenoid biosynthesis gene cluster[J].Appl Microbiol Biotechnol,2013,97(19):8479-86.
[2]Nishino H,Tokuda H,Murakoshi M,et al.Cancer prevention by natural carotenoids[J].Biofactors,2000,13(1-4):89-94.
[3]Sugiura M,Nakamura M,Ogawa K,et al.High serum carotenoids associated with lower risk for bone loss and osteoporosis in post-menopausal Japanese female subjects:prospective cohort study[J].PLoS One,2012,7(12):e52643
[4]Talegawkar SA,Johnson EJ,Carithers TC,et al.Carotenoid intakes,assessed by food-frequency questionnaires(FFQs),are associated with serum carotenoid concentrations in the Jackson heart study:validation of the Jackson heart study Delta NIRI Adult FFQs[J].Public Health Nutr,2008,11(10):989–997.
[5]Misawa N,Nakagawa M,Kobayashi K,et al.Elucidation of the Erwinia uredovora carotenoid biosynthetic pathway by functional analysis of gene produce expressed in Escherichia coli[J].J Bacteriol,1990,172(12):6704-6712.
[6]汪靖超,孙东平,杜桂彩,等.噬夏孢欧文氏菌(Erwinia uredovora)类胡萝卜素合成相关基因crtE的克隆及其在大肠杆菌中的表达[J].食品科学,2007,28(7):276-279. WANG Jingchao,SUN Dongping,DU Guicai,et al.Cloning and expression of crtE from Erwinia uredovora in Escherichia coli [J].Food Science,2007,28(7):276-279.(in Chinese)
[7]李丽,吴柘,郭道森,等.噬夏孢欧文氏菌crtY基因在大肠杆菌中的表达及其产物的纯化[J].食品科学,2007,28(5):203-207. LI Li,WU Zhe,GUO Daosen,et al.Expression of crtY from Erwinia uredovora in Escherichia coli and purification of its gene product[J].Food Science,2007,28(5):203-207.(in Chinese)
[8]汪靖超,姜颖,杜桂彩,等.噬夏孢欧文氏菌类crtB基因的克隆及在大肠杆菌中的表达[J].青岛大学学报:自然科学版,2006,19(2):74-78. WANG Jingchao,JIANG Ying,DU Guicai,et al.Cloning and expression of gene crtB from Erwinia uredovora in Escherichia coli [J].Journal of Qingdao University:Natural Science Edition,2006,19(2):74-78.(in Chinese)
[9]Seo Y B,Choi S S,Nam S W,et al.Cloning and characterization of the zeaxanthin glucosyltransferase gene (crtX)from the astaxanthin-producing marine bacterium,Paracoccus haeundaensis[J].J Microbiol Biotechnol,2009,19(12):1542-1546.
[10]Hundle B S,O'Brien D A,Alberti M,et al.Functional expression of zeaxanthin glucosyltransferase from Erwinia herbicola and a proposed uridine diphosphate binding site[J].J Microbiol Proc Natl Acad Sci USA,1992,89(19):9321-5.
[11]Takaichi S,Maoka T,Akimoto N,et al.Major Carotenoid isolated from Paracoccus schoinia NBRC 100637 is adonixanthin diglucoside[J].J Nat Prod,2006,69(12):1823-1825.
[12]Tuveson R W,Larson R A,Kagan J.Role of cloned carotenoid genes expressed in Escherichia coli in protecting against inactivation by near-UV light and specific phototoxic molecules[J].J Bacteriol,1988,170(10):4675-4680.
[13]Ma L,Lin X M.Effects of lutein and zeaxanthin on aspects of eye health[J].J Sci Food Agric,2010,90(1):2-12.
[14]Krinsky N I,Landrum J T,Bone R A.Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye[J].Annu Rev Nutr,2003,23:171-201.
[15]Tabunoki H,Sugiyama H,Tanaka Y,et al.Isolation,characterization,and cDNA sequence of a carotenoid binding protein from the silk gland of Bombyx mori larvae[J].J Biol Chem,2002,277(35):32133-32140.
Expression and Purification of Zeaxanthin Glycosylase in E.coli
WANG Jingchao, TENG Shouzhen, CHEN Xiupeng, DU Guicai, GUO Qunqun, LI Ronggui
(College of Life Sciences,Qingdao University,Qingdao 266071,China)
Several carotenoids are synthesized by related enzymes in Erwinia uredovora,. Zeaxanthin diglucoside is synthesized by zeaxanthin glycosylase which was encoded by gene crtX.In this study,crtX of E.uredovora was amplified by PCR and cloned into expression vector.The recombinant plasmid was then transformed into E.coli BL21 (DE3)to construct the engineering bacterium.The recombinant zeaxanthin glycosylase was purified by Ni2+chelating affinity chromatography and a DEAE-Sepharose FF ion-exchange chromatography.The purified protein catalyze the formation of zeaxanthin diglucoside in vitro.
Erwinia uredovora,zeaxanthin glycosylase,activity
Q 785;Q 786
A
1673—1689(2015)08—0886—05
2014-06-16
山东省自然科学基金项目(Y2008D25)。
汪靖超(1973—),男,山东青岛人,理学硕士,讲师,主要从事食品生物技术方面的研究。E-mail:wangjc@qdu.edu.cn

