肠炎沙门氏菌gDNA标准物质的研究
柯 璐, 黄晓蓉*, 林 杰, 戴晓丽, 曾维扬, 张温玲
(1.福建出入境检验检疫局,福建 福州 350001;2.福建省检验检疫技术研究重点实验室,福建 福州 350001)
肠炎沙门氏菌gDNA标准物质的研究
柯 璐1,2, 黄晓蓉*1,2, 林 杰1,2, 戴晓丽1,2, 曾维扬1,2, 张温玲1,2
(1.福建出入境检验检疫局,福建 福州 350001;2.福建省检验检疫技术研究重点实验室,福建 福州 350001)
作者对制备肠炎沙门氏菌核酸标准物质(gDNA)进行初探,共制备200支样品,每支约含有肠炎沙门氏菌gDNA 1 μg。方差分析结果显示,F值为0.835 7,小于F0.05(14,30)=1.68,表明在95%显著性水平时,样品的gDNA含量均匀;稳定性试验表明样品在-20℃下保存12个月,gDNA含量维持在1 μg/支,0.8 g/dL的琼脂糖凝胶电泳的目标条带清晰,以invA基因为引物的PCR反应产物电泳条带清晰,样品均具有较好的稳定性。
肠炎沙门氏菌;核酸;标准物质
福建省曾因微生物污染遭遇国际贸易壁垒的抵制而使得出口商家损失巨大。20世纪90年代以来,以核酸为基础的基因诊断技术发展迅速,并在食品微生物领域逐渐成为出入境口岸检验检疫中快速检测方法之一。由于国内在快速检测方面没有统一的标准,各试剂盒采用的标准也各有不同,使得结果相差甚大,给进出口产品检验检疫带来很大的误差[1]。要解决检测的标准化问题以及提高检测的有效性,需要一个统一的标准物质。在国际上,生物成分的gDNA标准物质,大部分都是针对人类及一些真核生物,而关于细菌的基因组标物却比较少,目前欧盟执委会联合研究中心标准与测量研究院(IRMM)有研制细菌基因组DNA的标准物质[2],在国内却很少有报道。肠炎沙门氏菌(Salmonella enteritidis,SE)是引起食物中毒的常见致病菌,在公共卫生学上具有重要意义,严重影响养殖业的发展和人类健康[3],作者对肠炎沙门氏菌 gDNA标准物质进行研究制备,为gDNA标物的研制提供可行的技术路线。
1 材料与方法
1.1 菌源及引物
肠 炎 沙 门 氏 菌 Salmonella enteritidis(ATCC13076):购自上海汉尼公司;引物 invA(286bp):由北京赛百盛基因技术有限公司合成;invA-1:5'-GTGA AATT TACG CCAC GTTC GGGC AA-3';invA-2:5'-TCAT CGCA CCGT CAAA GGAA CC-3'
1.2 主要仪器及耗材
多 功 能 酶 标 仪 :Molecular Devices公 司SpectraMax M5; 核酸蛋白仪:Eppendorf公司Biophotometer;全自动变焦凝胶成像系统:美国KODAK公司GL212Pro;电泳仪、水平电泳槽系统:美国BIO-RAD公司,Powerpac通用型、SUBCELLGT;冷冻干燥机:美国LABCONC公司,FreeZone○RTriadTM2.5L;冻存管:京中生柏奥生物科技有限公司,0.5 mL。
1.3 主要试剂
缓冲蛋白胨:北京陆桥公司;Puregene Yeast/ Bact.Kit B试剂盒:QIAGEN公司;通用型DNA纯化回收试剂盒:北京天根生化科技有限公司;λDNA:Promega公 司 产 品 ;λDNA/Hind III+ EcoR I Marker:上海英骏生物技术有限公司;2×Taq PCR MasterMix:自北京天根生化科技有限公司;100 bp DNA Ladder Marker:北京天根生化科技有限公司;Picogreen荧光染料等。
2 SE gDNA标准物质制备方法
2.1 高浓度gDNA提取
核酸标准物质的质量关键在于基因组必须具有较好的完整性,且A260/280在1.70~1.90[4]。经比较,QIAGEN公司生产的Puregene Yeast/Bact.Kit B for Purification of Archive-quality DNA from Gram-Positive BacteriaCulture Medium试剂盒提取过程相对简便快捷,且基因组质量优良。取新鲜培养菌液(菌浓度达到0.5×109~1.5×109cells),按试剂盒步骤进行提取。
2.2 gDNA浓度测定
利 用 pH 8.0 TE 溶 液 按 200:1比 例 对Picogreen染料原液进行稀释,充分混合后避光保存待用。将1 μL DNA样品与99 μL、pH 8.0 TE溶液混合,50℃孵育5 min,每个待测样品做两个平行,孵育后样品与100 μL Picogreen工作试剂混合。同时,选用溶度为2 μg/mL的λDNA作为外标物,选取6个体积控制点,与pH 8.0 TE溶液及100 μL Picogreen工作试剂混合,最终稀释度见表1。混合液快速点入96 Well corning黑色荧光板中,避光孵育5 min,于多功能酶标仪上检测。

表1 标准曲线制备设计Table 1 Protocol for preparing standard curve
2.3 gDNA的核酸电泳及特征性验证
2.3.1 核酸电泳 取7 μL的gDNA与 6×Loading Buffer混合,1.0 g/dL的琼脂糖凝胶电泳,设计10个平行,98 V下电泳约80 min,EB染色30 min,利用全自动变焦凝胶成像系统观察条带。
2.3.2 invA基因扩增 以invA(286 bp)为引物进行PCR反应,10管平行实验,每管25.0 μL反应体系,详见表2。
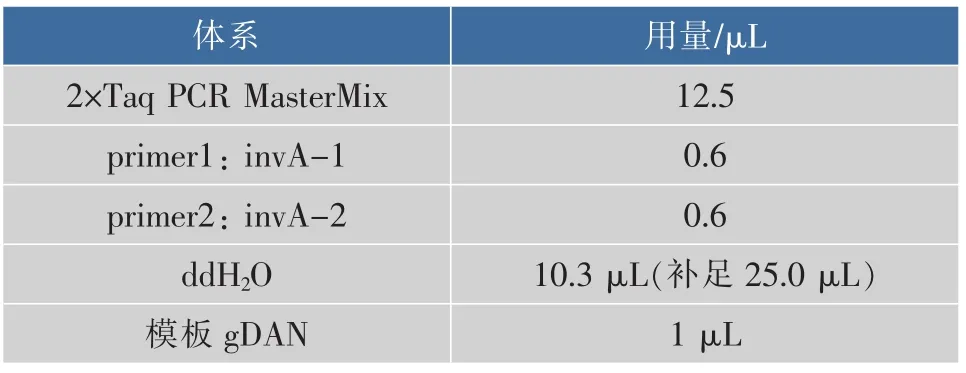
表2 PCR-25反应体系Table 2 PCR-25 reaction system
PCR扩增反应热力学循环参数为:95℃、5 min预变性,95℃、30 s变性,64℃、30 s退火,72℃、30s延伸,共35个循环,25℃保温。
分别取10 μL PCR产物进行2.0 g/dL琼脂糖凝胶电泳,200 V下跑胶约20 min,EB染色30 min,利用全自动变焦凝胶成像系统观察条带。
2.2.3 PCR产物的纯化回收、测序 按照Universal DNA Purification Kit步骤对PCR反应产物进行纯化。取纯化产物1 mL于离心管中,盖口封膜后送至上海生工进行克隆测序。将测序获得的基因序列进行在线 BLAST,分析比对结果是否存在差异,以此作为gDNA标准物质的特征标志。
2.3 制备gDNA标准物质
2.3.1 冷冻干燥程序的选择 制备的gDNA标准物质进行冷冻干燥后密封保存。针对冷冻干燥过程中对结果影响较大的两个因素水平进行实验设计,以冻干后gDNA质量浓度为指标,选择适合的冷冻干燥程序,每个水平设置6个重复,主要分析因素及水平见表3。

表3 冷冻干燥影响因素及水平设计Table 3 Influence factor and level design of Freeze drying
2.3.2 gDNA的分装 将gDNA溶液用pH 8.0 TE溶液稀释后分装于冻存管,100 μL/支,于-70℃预冻5 h后,置于冷冻干燥机按2.3.1程序冻干。
2.3.4 冻干样品的均匀性验证及定值
1)样品gDNA含量(μg)测定:抽取15支冻干样品,加100 μL、pH 8.0 TE溶液,室温下溶解2 min,于涡旋振荡仪上低速涡旋20 s,置于50℃干浴锅中溶解5 min,每支样品设置3个平行,样品最终质量浓度cZ(μg/μL)取平均值计,gDNA样品质量(μg)=100 μL×cZ。参照CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》要求,采用t检验法进行验证。
2)不确定度评估 测量不确定度主要由The PicofluorTM荧光计的测量中产生,评估方法如下:抽取样本数为n=10,每个样本进行平行3次的测量,标准不确定度 U=Sx/n1/2。
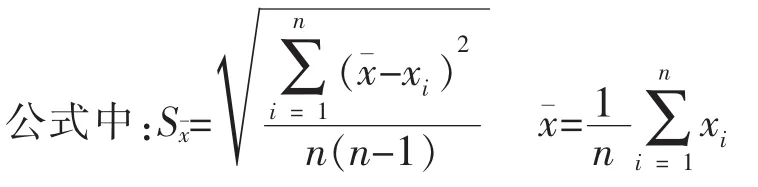
2.3.5 对冻干样品进行特征性验证及稳定性追踪对抽取的 10份样品同时进行以invA为引物的PCR扩增。模拟-20、4、25、60℃4个保存温度,对gDNA标准物质分组保存。在不同时间段,每个保存温度各抽取3份样品,以gDNA浓度、核酸电泳及特征性扩增为指标,进行稳定性追踪[5-7]。
3 结果与讨论
3.1 gDNA质量浓度及特征性检测
将提取的gDNA混合,混合后质量浓度为96 μg/mL,A260/A280=1.87。将gDNA溶液分装于17支1.5 mL离心管中,1 mL/支,于-20℃保存待用。
由图1—2可知,9条 gDNA溶液电泳条带清晰,条带均在20 kb左右。PCR反应产物电泳条带清晰,无明显杂带,与阳性对照条带位置一致。由图3可知,将测序的结果以FASTA的格式上传至http:// blast.ncbi.nlm.nih.gov/进行nucleotide blast,数据库选择nucleotide collection(nr/nt)。测序峰图结果显示其信号强,无明显干扰,清晰可见。进行nucleotide blast,结果为Identities=100%。

图1 gDNA核酸电泳图Fig.1 gDNA nucleic acid electrophoresis
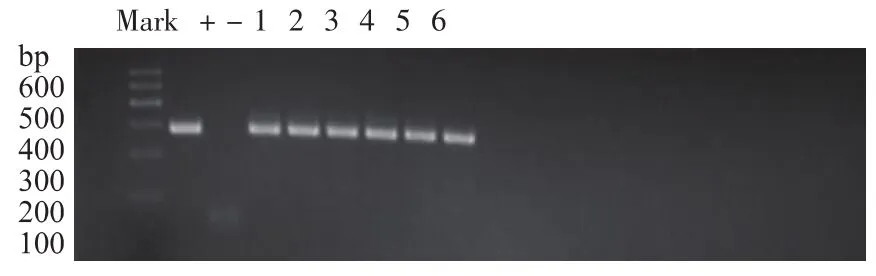
图2 gDNA PCR反应产物电泳图Fig.2 GDNA PCR reaction product electrophoresis
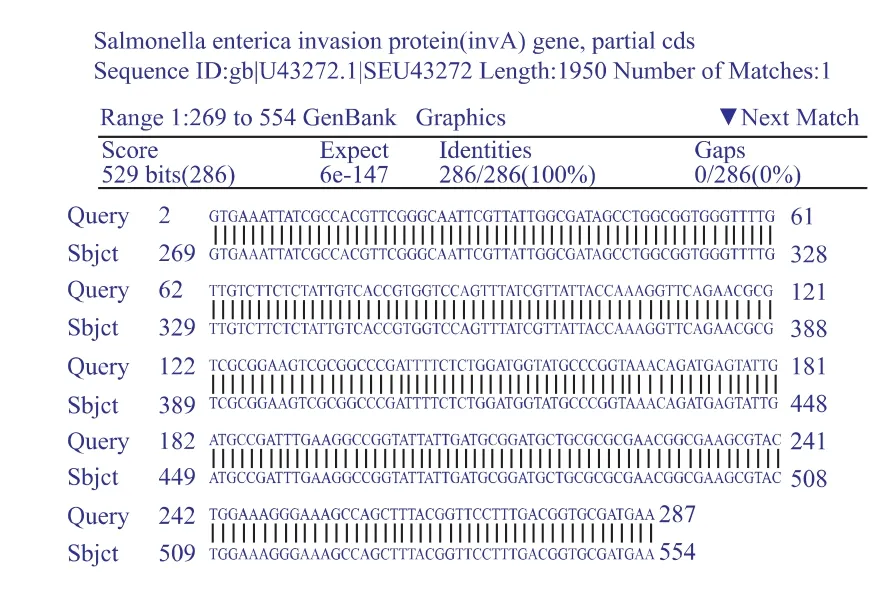
图3 测序比对结果Fig.3 Sequence alignment result
3.2 冷冻干燥因素结果及分析
由表4可知,当程序设定为隔板控温-40℃运行7 h,隔板控温4℃运行5 h时,gDNA冻干后质量浓度最高。将gDNA溶液稀释至15 μg/mL后按照冻干程序进行冷冻干燥,冻干后样品用Parafilm封口膜封闭瓶盖。
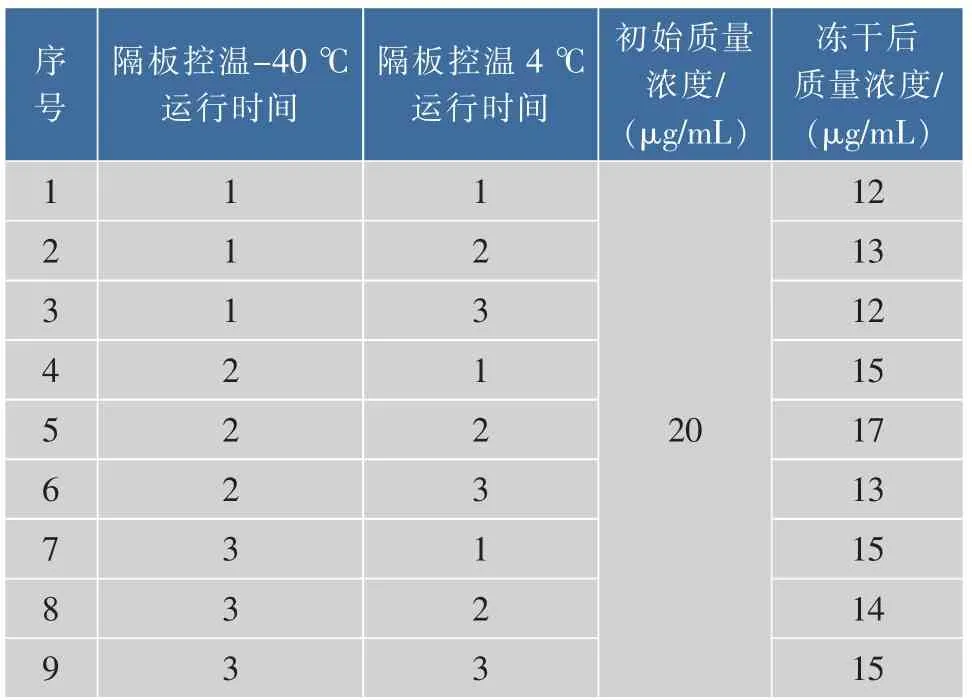
表4 冷冻干燥试验结果Table 4 Experiment results of Freeze drying
3.3 样品的浓度及均匀性结果
抽取的15支样品,利用荧光值法分别测定3次,cz=11 μg/mL,均匀性结果见表5。
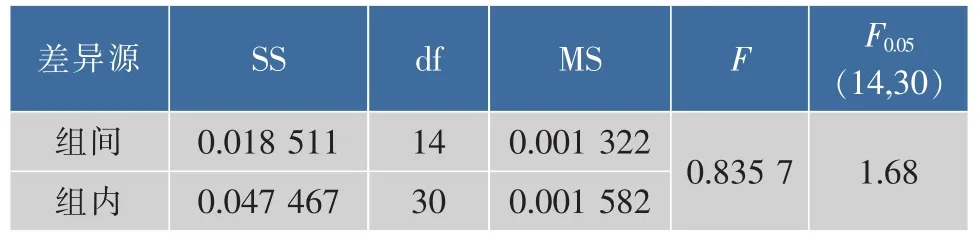
表5 方差分析结果Table 5 Results of variance analysis
F值=0.835 7,小于F0.05(14,30)=1.68,这表明在0.05显著性水平时,样品中的gDNA含量是均匀的。
3.4 研制方法的不确定度分析与评估
经计算,单次测量结果试验的标准差:S=3.529,则U=0.6442。因此,当检验结果以3次测量值的平均值表示时,其值区间分布于(11±0.644 2)μg/mL之间,这个取值区间适合于任何一次测量。
3.5 标准物质的稳定性追踪
3.5.1 样品质量浓度稳定性追踪 4种保存温度下标准物质gDNA质量浓度与t=0的gDNA质量浓度对比,统计结果见表6。
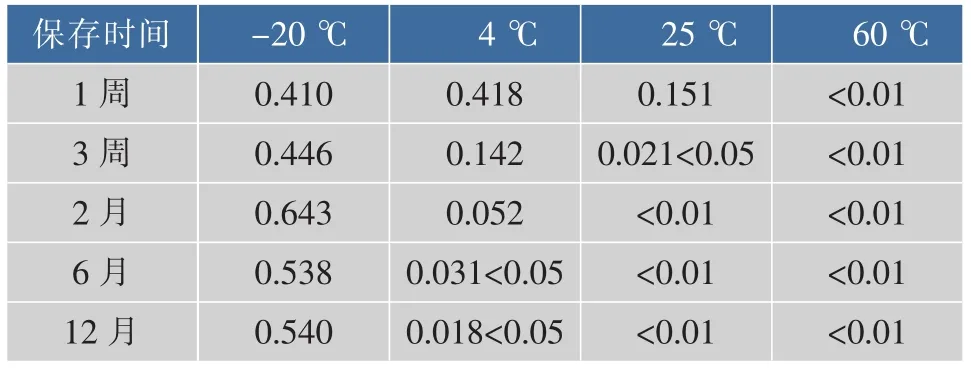
表6 稳定性结果Table 6 Stability test results
由表6可见,样品在-20℃下保存12个月标准物质质量浓度稳定,在4℃下保存半年后,gDNA开始降解。而在25℃及60℃下存储,gDNA样品降解快,不稳定。
3.5.2 琼脂糖凝胶电泳结果 每个保存温度抽取3支样品进行核酸电泳,同时进行PCR产物电泳。结果表明,在-20、4、25℃下保存12个月,gDNA电泳条带清晰,无明显杂带。PCR产物电泳结果显示,在-20、4、25℃下保存12个月均能扩增出invA。而保存温度为60℃时,虽invA特征基因能被扩增出,但gDNA电泳结果无条带。
4 结语
本研究制备的肠炎沙门氏菌gDNA标物共200支,具备一定的稳定性和均匀性,给核酸标准物质的制备及验证方法提供了有效的依据,并建立起适用于标准物质的定值的方法及不确定度的评估方案,作为制备成果适用性的理论依据。
[1]王根荣,陆慧.标准物质及其管理[J].化学计量分析,2004,13(6):59-62. WANG Genrong,LU Hui.Reference material and its administration[J].Chemical Analysis and Meterage,2004,13(6):59-62.(in Chinese)
[2]张洁.生物标准物质的制备、发展及管理[J].中国生物制药学杂志,2007,20(6):630-632. ZHANG Jie.The preparation,development and managerment of biological reference materials[J].Chinese Journal of Biologicals,2007,20(6):630-632.(in Chinese)
[3]叶朗光,邓树轩.肠炎沙门氏菌研究进展[J].畜牧与饲料科学,2011,32(2):121-122. YE Langguang,DENG Shuxuan.The research progress of salmonella enteritidis[J].Animal Husbandry and Feed Science,2011,32(2):121-122.(in Chinese)
[4]张丽,杨莲茹,吴绍强.核酸提取方法的研究进展[J].中国动物检疫,2011,28(12):75-78. ZHANG Li,YANG Lianru,WU Shaoqiang.The research progress of nucleic acid extraction method[J].China Animal Health Inspection,2011,28(12):75-78.(in Chinese)
[5]韩永志.标准物质不确定度的给定与评定[J].地质实验室,1995(3):162-163. HAN Yongzhi.Given and evalution of reference materials uncertainty[J].Geological Laboratory,1995(3):162-163.(in Chinese)
[6]阚莹,张正东.标准物质均匀性检验统计量F的判断[J].中国计量,2010(4):78-79. HAN Ying,ZHANG Zhengdong.The statistic F judgment of reference materials homogeneity test[J].China Metrology,2010(4):78-79.(in Chinese)
[7]韩永志.标准物质的稳定性监测及评价[J].化学分析计量,2001,10(4):37-79. HAN Yongzhi.The stability of the reference materials monitoring and evalution[J].Chemical Analysis and Meterage,2001,10(4):37-79.(in Chinese)
Study on the Reference Materials of Salmonella enteritidis Nucleic Acid
KE Lu1,2, HUANG Xiaorong*1,2, LIN Jie1,2, DAI Xiaoli1,2, ZENG Weiyang1,2, ZHANG Wenling1,2
(1.Fujian Entry-Exit Inspection and Quarantine Bureau,Fuzhou 350001;Fujian Provincial Key Laboratory of Inspection and Quarantine Technology Research,Fuzhou 350001)
The preparation of nucleic acid reference materials of Salmonella Enteritidis(gDNA)was carried out in this study.A total of 200 samples were prepared,each of them contained 1 μg of Salmonella Enteritidis gDNA.Variance analysis results showed that F value was 0.835 7<F0.05(14,30)=1.68,indicating that gDNA con ple was evenly in the 95%significance level.Stability tests showed that gDNA content of the samples was maintained at 1 μg/support after stored for 12 months at the temperature of-20℃.The goal electrophoresis band of 0.8 g/dL agarose gel and the electrophoresis bands of PCR reaction product by using the invA gene as primers were clear revealed that the property of samples were stable.
Salmonella enteritidis,gDNA,reference materials
Q93-331
A
1673—1689(2015)08—0891—05
2014-04-21
福建省科学技术厅社会发展重点项目(2011Y0002)。
*通信作者:黄晓蓉(1958—),江苏南通人,主任技师,主要从事微生物生理及生物化学方面的研究。E-mail:hxrwz@163.com

