超临界水氧化丙烯氰废水的反应动力学理论研究
武红娟, 李 斌, 赵光明
(中北大学化工与环境学院,山西 太原 030051)
引 言
超临界状态下反应的复杂性,主要在于参与反应的化学物质达到平衡时数据的可靠性和反应物质与溶剂的相互作用[1]。在描述SCWO(超临界水氧化)反应过程中,一般采用3种方式:经验动力学速率方程、基于基元反应的机理、过渡态理论。经验速率模型适用于筛选和评价反应的进行情况[2-4]。
根据阿伦尼乌斯速率公式,采用过渡态理论对反应的动力学进行研究,通过对反应速率常数的计算得出反应动力学结果[5-6]。充分考虑基元反应的机理和过渡态理论则有助于探讨反应实质和提供反应的完整信息。过渡态理论认为,化学反应不是一步形成,而是由反应物在反应条件下形成中间络合物(过渡态),进而由络合物形成产物。
本文对于超临界氧化反应动力学的研究,主要集中在从量子化学方面对超临界水氧化反应进行分析探讨[7-11]。利用密度泛函理论[12-15]研究氧负离子自由基与丙烯氰分子的反应,针对可能存在的置换氢、羟基化以及生成水反应通道,在高斯软件中得到反应物、产物、中间体复合物的过渡态优化构型,较完整地描述反应的具体机理和产物生成路径。
1 计算方法
所有结构计算均使用gaussian view5.0软件和gaussian 03[16]软件进行。利用密度泛函理论中的B3LYP方法以6-311G(2d,p)为基组,即B3LYP/6-311G(2d,p)方法,优化了有、无水分子参与的氧自由基与丙烯氰反应中所有驻点(包括反应物、中间体、过渡态和产物)物种的几何结构。同时,在相同水平下对其构型进行振动频率分析来确认所得几何构型[17-19]。进而从过渡态构型出发,利用内禀反应坐标(IRC,intrinsic reaction coordinate)理论计算反应的最小能量途径,验证各过渡态与相应反应物和产物的相关性。
2 结果与讨论
2.1 丙烯氰…H2O结构优化分析
根据实验要求进行丙烯氰化合物和水为骨架进行的分子设计,在B3LYP/6-311++G(2d,p)水平上进行结构优化,进而得出4种优化结果,如第38页图1所示。
2.2 无水条件下过渡态分析
在已优化出的丙烯氰单体结构基础上,合理设计出预设计结构,在密度泛函理论方法BHandHLYP/6-311++G**水平下进行计算,使氧负离子自由基分别指向丙烯氰中的碳原子,氧负离子自由基与碳原子结合置换出H,进而得到图2所示的过渡态,即为可能存在置换氢或者抽氢过程。

图1 B3LYP/6-311++G(2d,p)水平上丙烯氰…H2O优化结构
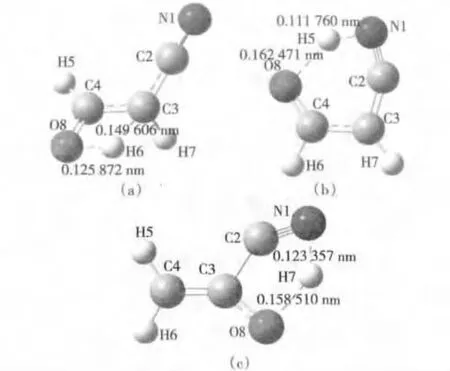
图2 BHandHLYP/6-311++G**水平上计算出的置换或者抽氢反应过渡态
在图2(a)中,氧负离子自由基O8指向C4,使得原位置上的H6发生迁移,在O8和C3之间振动,形成过渡态;
在图2(b)中,氧负离子自由基O8指向C4,使得原位置上的H5发生迁移,在O8和N1之间振动,形成过渡态;
在图2(c)中,氧负离子自由基O8指向C3,使得原位置上的H7在O8和N1之间振动,形成过渡态;
特殊情况下,当氧负离子自由基指向碳碳双键以及碳碳三键和带有氰基(—CN)的C时,无过渡态产生,可能形成其他环状复合物。如图3所示。
在图3(a)中,氧负离子自由基指向原有的碳碳双键,使得碳碳双键断裂,氧负离子自由基分别连在2个碳原子上,形成三元环复合物;
在图3(b)中,氧负离子自由基指向碳氮三键,破坏碳氮三键,氧负离子自由基与碳相连;
在图3(c)中,氧负离子自由基指向带有氰基(—CN)的C,氧负离子自由基与碳相连,使得氰基(—CN)整体发生迁移。
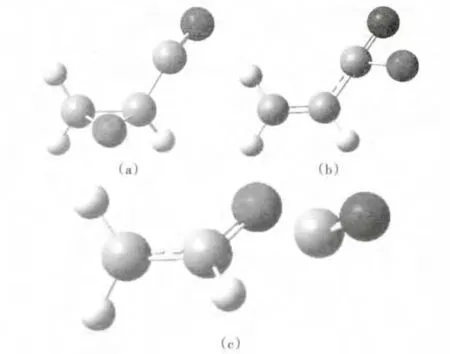
图3 BHandHLYP/6-311++G**水平上计算出的非过渡态复合物
另外,我们在B3LYP和BHandHLYP方法上未找到氢氧负离子自由基的生成,即羟基化过程。但是,根据抽氢或者置换氢反应通道可以推测出,抽出氢或者置换出的氢发生迁移过程中,会进一步和氧负离子自由基结合,形成氢氧负离子自由基,即羟基化过程。在羟基化的基础上,反应的中间产物OH自由基形成后会进一步指向丙烯氰中的氢,实现生成水的反应路径,H在羟基和碳之间振动,形成如图4所示的过渡态,即生成水反应通道。

图4 BHandHLYP/6-311++G**水平上计算出的生成水反应过渡态
在图4(a)、(b)中,氢氧负离子自由基 OH6指向H5,使H5在C4和OH6之间振动,形成过渡态。
2.3 有水条件下过渡态分析
由于水分子的存在,使得丙烯氰分子与氧负离子自由基的结合方式更加复杂。根据研究可以得出,丙烯氰和水形成的二聚体与氧负离子自由基的结合方式也可以归纳为置换氢、抽氢、羟基化和生成水4种反应通道。这里把置换氢和抽氢作为一大类进行研究。
在已优化的丙烯氰…H2O二聚体结构基础上,将氧负离子自由基与丙烯氰和水形成的4种二聚体在BHandHLYP/6-311++G**水平下进行计算,使氧负离子自由基或者氢氧负离子自由基指向所定位置上的基团,形成以下多种过渡态。置换或者抽氢通道如图5。
在图5(a)中,水中的O原子指向C3,H9在N2和O8之间振动,形成过渡态;
在图5(b)中,水中的O原子指向C2,H6在N1和O5之间振动,形成过渡态;
在图5(c)中,水中的O原子指向N2,H8在O7和H10之间振动,形成过渡态;
在图5(d)中,水中的H1原子指向氰基的N2原子,H7在O6和N2之间振动,形成过渡态;
在图5(e)中,水中的O原子指向C3,H9在O8和N2之间振动,形成过渡态。
与无水条件下类似,当氧负离子自由基指向碳碳双键、碳碳三键及带有氰基(—CN)的C时,可能形成其他非过渡态环状复合物。不同的是,在水分子的作用下,当氧负离子自由基指向丙烯氰中带有氰基(—CN)的C时,形成了其他形式的过渡态。本研究中,我们在B3LYP和BHandHLYP方法下也没找到OH负离子自由基生成,故羟基化过程并未在算法中实现。根据文献资料和众多学者的研究可以知道,在置换氢反应通道中,置换出的氢可能会进一步发生迁移和氧负离子自由基结合,极大可能形成OH负离子自由基,即羟基化过程。
对于生成水的反应通道,有水条件与无水条件相同。在羟基化的基础上,已经形成的氢氧负离子自由基会进一步发生迁移,指向丙烯氰中的剩余氢,并与之发生结合,形成生成水的反应通道。如第40页图6。
在图6(a)中,水分子中的O3指向丙烯氰中的N原子,H8在C7和氢氧负离子自由基OH9之间振动,形成过渡态;
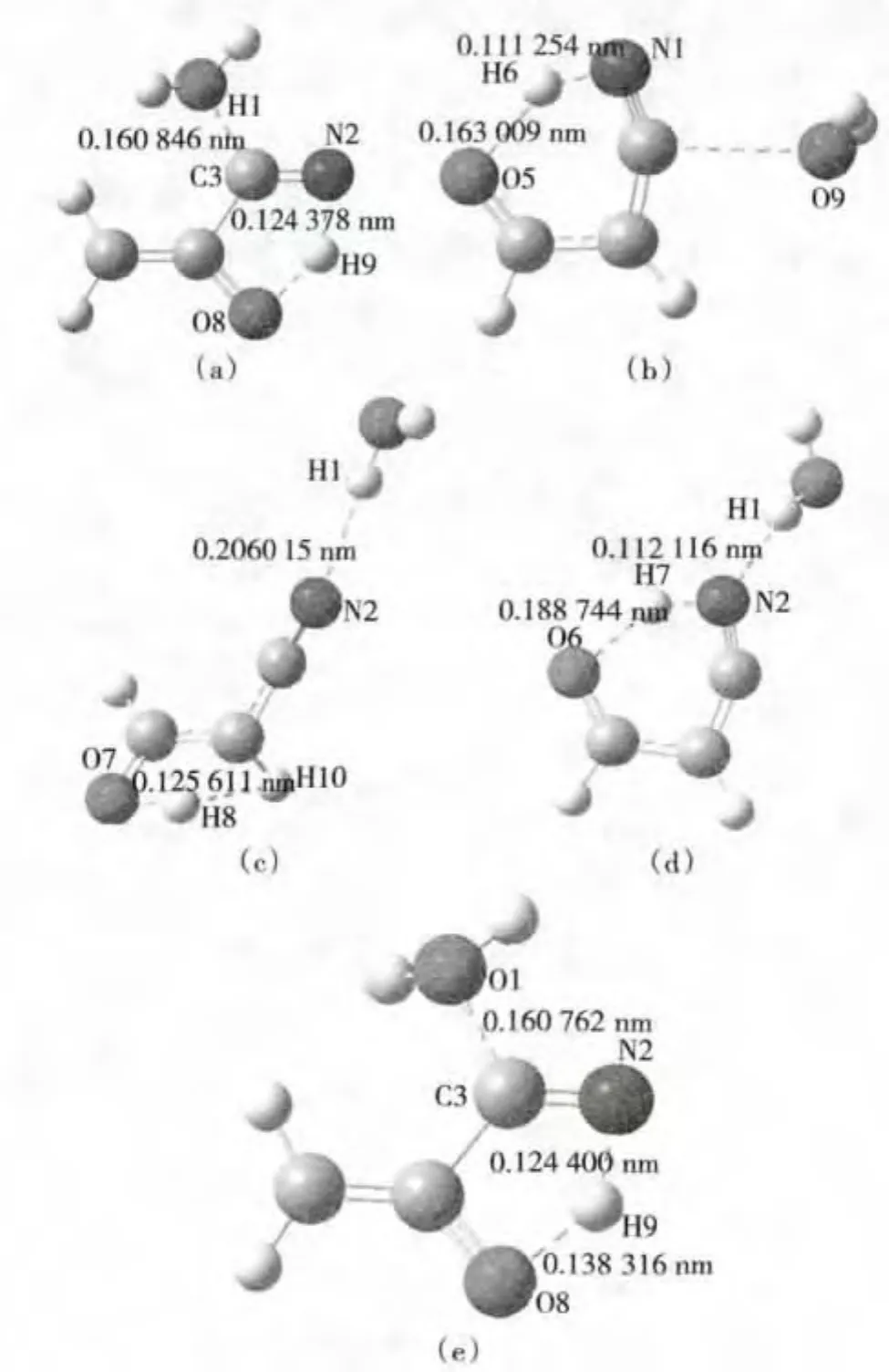
图5 有水条件BHandHLYP/6-311++G**水平上计算出的置换氢反应过渡态
在图6(b)中,水分子中的O7指向羟基的H原子,H5在C4和氢氧负离子自由基OH6之间振动,形成过渡态;
在图6(c)中,水分子中的O8指向丙烯氰中的H原子,H5在C4和氢氧负离子自由基OH6之间振动,形成过渡态;
在图6(d)中,水分子中的O指向丙烯氰中的H原子,且H6在O7和H5之间振动,形成过渡态;
在图6(e)中,水分子中的O8指向振动的H7,且H7在O8和氢氧负离子自由基OH6之间振动,形成过渡态;
在图6(f)中,水分子中的O5指向C4,H9在C3和氢氧负离子自由基OH10之间振动,形成过渡态;
在图6(g)中,水分子中的O7指向OH6,H5在C4和氢氧负离子自由基OH6之间振动,形成过渡态。
3 IRC分析
IRC(内禀坐标)是对过渡态的进一步验证。通过对IRC中总能量的坐标图进行分析,进一步确定过渡态形成产物的最有可能的通道。在本研究中,我们只观测到抽氢反应、生成水反应、置换氢反应的可能过渡态的形成,所以针对IRC验证也只从这3个通道进行分析。如,对图5(d)、图6(c)和6(d)所示的过渡态进行IRC计算得到如图7的IRC结果。
在图7(a)中,图5(d)中的 H7在水分子的作用下导致H7与丙烯氰中的N结合,形成稳定的HCN结构,证明了抽氢过程在此反应中的确存在;
在图7(b)中,图6(d)中的 H6在水分子和与丙烯氰上的H5共同作用下导致H5与丙烯氰之间的化学键发生断裂,与游离的氢自由基结合生成氢气。这表明,在此反应中同样存在置换氢的反应通道。
在图7(c)中,图6(c)中的C4在羟基的作用发生迁移,与羟基结合生成水,可以生成较稳定的产物。由此验证了生成水反应通道在丙烯氰和氧负离子自由基反应中的可能性。
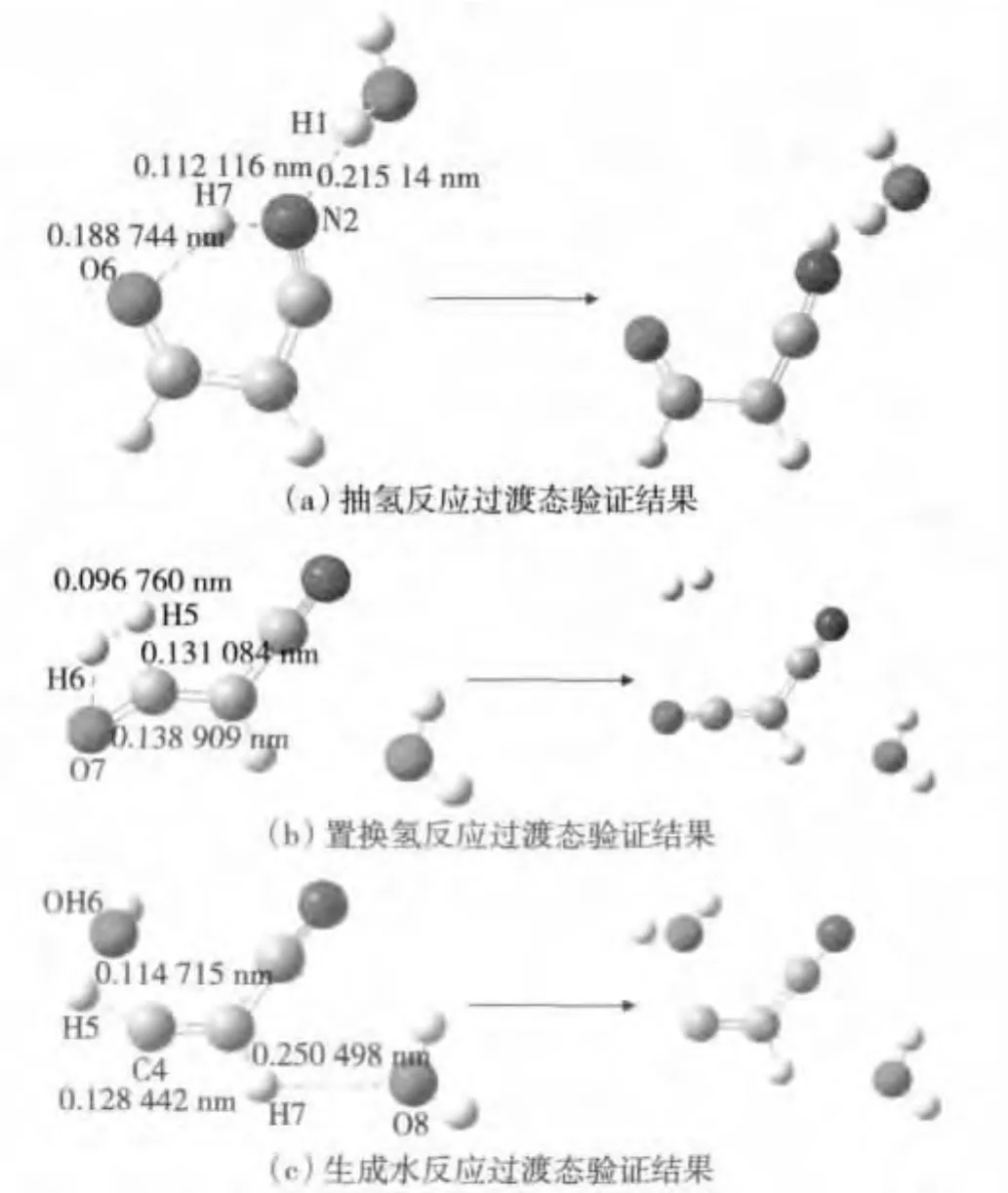
图7 IRC计算结果
4 结论
超临界水中发生的化学反应大多数属于自由基之间的反应,而氧负离子自由基作为自然界中广泛存在的一种自由基,在丙烯氰超临界水氧化反应中发挥了巨大作用。通过密度泛函理论在B3LYP/6-311++G(2d,p)和 HandHLY/6-311++G**的水平上对丙烯氰于有水和无水条件下与氧负离子自由基反应,得到反应物、产物、中间体复合物和过渡态的优化构型。
1)在氧负离子自由基与丙烯氰分子的反应中,存在置换氢反应、抽氢反应和生成水反应3种反应通道。
2)通过内禀坐标的计算验证,进一步证实置换氢反应、抽氢反应和生成水的反应是最主要的产物通道。
[1] Uematsu M,Franck E U.Static dielectric constant of water and steam[J].Journal of Physical and Chemical Reference Data,1980(9):1291-1306.
[2] Meyer Ea,Castellano Rk,Diederich F.Interactions with aromatic rings in chemical and biological recognition[J].Angew Chem Int Ed,2003,42:1210-1250.
[3] Hesselmann A,Jansen G,Schutz M.Interaction energy contributions of h-bonded and stacked structures of the at and gc dna base pairs from the combined density functional theory and intermolecular perturbation theory approach[J].J Am Chem Soc,2006,128:11730-11731.
[4] Leist R,Frey Ja,Ottiger P,et al.Nucleobase-fluorobenzene interactions:hydrogen bonding wins overπstacking[J].Angew Chem Int Ed,2007,46:7449-7452.
[5] Garcia-Raso A,AlbertíFm,Fiol Jj,et al.Anion-πinteractions in bisadenine derivatives:a combined crystallographic and theoretical study[J].Inorg Chem,2007,46:10724-10735.
[6] Tielrooij K J,Garcia-Araez N,Bonn M,et al.Cooperativity in ion hydration[J].Science,2010,328:1006-1009.
[7] Li Y,Guo L,Zhang X,et al.Hydrogen production from coal gasification in supercritical water with a continuous flowing system[J].International Journal of Hydrogen Energy,2010,35(7):3036-3045.
[8] 朱勇.量子有机化学(第二卷)[M].北京:高等教育出版社,1986:230-243.
[9] Escudero D,Frontera A,Quinonero D,et al.Interplay between cation-πand hydrogen bonding interactions[J].Chem Phys Lett,2008,456:257-261.
[10]Estarellas C,Frontera A,Quinonero D,et al.Interplay between cation-πand hydrogen bonding interactions:are non-additivity effects additive[J].Chem Phys Lett,2009,479:316-320.
[11]Vijay D,Zipse H,Sastry Gn.On the cooperativity of cation-πand hydrogen bonding interactions[J].J Phys Chem B,2008,112:8863-8867.
[12]Von RaguéSchleyer P,Manoharan M,Wang Zx,et al.Dissected nucleus-independent chemical shift analysis ofπ-aromaticity and antiaromaticity[J].Org Lett,2001(3):2465-2468.
[13]Kleeberg H,Klein D,Luck Wap.Quantitative infrared spectroscopic investigations of hydrogen-bond cooperativity[J].J Phys Chem,1987,91:3200-3203.
[14]Ojamäe L,Hermansson K.Ab initio study of cooperativity in water chains:binding energies and anharmonic frequencies[J].J Phys Chem,1994,98:4271-4282.
[15]Wu Yd,Zhao Yl.A theoretical study on the origin of cooperativity in the formation of 310-andα-helices[J].J Am Chem Soc,2001,123:5313-5319.
[16]Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian03[M].Pittsburgh Pa:Gaussian Inc,2003.
[17]Cera Ed.Site-specific thermodynamics:understanding cooperativity in molecular recognition[J].Chem Rev,1998,98:1563-1591.
[18]Whitesides Gm,Krishnamurthy Vm.Designing ligands to bind proteins[J].Q Rev Biophys,2005,38:385-395.
[19]Gupta Rb,Brinkley Rl.Hydrogen-bond cooperativity in 1-alkanol+n-alkane binary mixtures[J].Aiche,1998,44:207-213.

