急性心肌缺血再灌注大鼠早期心脏舒张功能降低及心肌纤维化的研究*
西安交通大学医学院第一附属医院心内科(西安710061) 邵 靓 张 萍 张 勇 马爱群
急性心肌缺血再灌注损伤是急性心肌梗死患者接受再灌注治疗后的严重不良后果,直接导致患者心功能降低和预后不良。目前研究认为:急性心肌缺血再灌注后的心脏舒缩功能障碍可能由多种原因引起,如血栓脱落栓塞[1],心肌抑顿[2],内皮细胞水肿[3],微血管痉挛外[4],炎症因子作用和原位血栓形成。然而急性心肌缺血再灌注后心功能的恶化不仅仅单纯是由于心肌细胞的损伤、凋亡及坏死所导致,心肌间质明显的改变也会对心功能造成较大的影响。
心肌细胞外基质(Extracellular matrix,ECM)的主要成分是心肌成纤维细胞分泌的胶原纤维,对维持心脏正常形态和功能起重要作用。在健康心脏中,多种生长因子和细胞因子控制着ECM的合成与降解,如肿瘤坏死因子α(TNF-α)、转化生长因子β1、白介素和内皮素等。然而在缺血缺氧、高压力负荷状态下,这些调节的失衡,将会引起ECM合成增加和(或)降解减少,从而导致心肌间质重构、心肌纤维化。心肌纤维化对心脏功能会产生显著的不良影响。伴随胶原水平的升高、心肌纤维化的不断加重,将会引起心肌机械僵硬度增加、心肌间隔增宽,心肌细胞之间出现电生理和舒缩功能障碍。
TNF-α是一种主要由外周巨噬细胞和单核细胞产生的促炎症作用的细胞因子,参与正常炎症反应和免疫反应,在一些炎症性疾病如病毒性心肌炎[5]、自发性流产[6]、类风湿性关节炎[7]等中起到了重要作用。同时TNF-α也是导致心脏急性心肌缺血再灌注后影响心肌灌流下降的重要因素,是引起心肌功能受损的重要原因[8]。同时TNF-α可上调L-1β和IL-6表达,加重急性心肌缺血再灌注后心肌纤维化。
由此可见,在急性心肌缺血再灌注时心肌纤维化和TNF-α对心功能起到了重要作用。然而在急性心肌缺血再灌注早期心肌纤维化对心功能的影响目前知之甚少。我们拟建立大鼠急性心肌缺血再灌注模型,观察不同时间点大鼠心肌纤维化、TNF-α和心功能状态的相互关系,探讨心肌纤维化对大鼠急性心肌缺血再灌注早期心功能的可能影响。
材料与方法
1 实验动物及处理 成年雄性SD大鼠(体重230~270g)购买自西安交通大学医学院。在整个实验过程中,遵循美国国立卫生研究院于1996年出版的《实验动物护理和使用指南》和中国国家科学技术委员会在2004年公布的《实验动物管理规定》相关要求,给予实验动物随意饮食。雄性SD大鼠随机分为假手术组(Sham组)和急性心肌缺血再灌注组(MI/R组)。急性心肌缺血再灌注组和假手术组分别设定第1天,第3天,第7天不同时间点。在进行单个检测方法处理时,每组每个时间点检测6个样本。
2 大鼠急性心肌缺血再灌注模型的建立 以2%的戊巴比妥钠(2ml/kg)腹内注射麻醉大鼠,将麻醉的大鼠腹面朝上缚于鼠台上。行气管切开,接于小动物呼吸机行正压辅助通气(哈佛小动物呼吸机)。沿大鼠胸骨左缘1cm处做纵向切口,逐层分离。于左心耳下方2mm处用6-0无损伤带线缝合针结扎前降支(假手术组只穿线,不结扎)。结扎前在结扎处放置一直径为4mm,长5mm的乳胶管,以便剪开结扎的丝线行再灌注。以Ⅱ导联心电图出现ST段抬高和出现左心缺血性颜色改变为标准判定急性心肌缺血。持续呼吸机正压通气。维持心肌缺血45min,剪开结扎丝线,关闭胸腔。给予青霉素400 000U/kg(1ml)腹腔注射,连续3d。分别于再灌注第1、3、7天时以乌拉坦过度麻醉,处死取样。
3 心脏功能的超声评估 以二维和M型的超声仪器(VIVID7型,GE公司,美国),分别从长短轴用10s的探头来观察心脏功能和结构的改变。用内在分析软件捕捉每只老鼠连续3个心动周期的数字图像,计算平均值。
4 血流动力学检测 以2%戊巴比妥钠溶液麻醉模型鼠后固定于鼠台。将充满肝素生理盐水的导管连于BL-420F生物机能实验系统上,经右颈总动脉进入左心室,当动脉压波形突然出现波浪状变化,振幅突然变大时,表明已进入左心室内。测量并记录所需数据。记录完毕后逐渐退出导管,夹闭并结扎颈总动脉近心端后拨出导管。
5 心肌羟脯氨酸测定 按照按照试剂盒的说明书配制试剂,采用碱水解法测定心肌羟脯氨酸含量。羟脯氨酸在氧化剂的作用下所产生的氧化产物与二甲氨基苯甲醛反应呈现紫红色,根据呈色的深浅可换算出心肌羟脯氨酸含量。
6 TNF-α表达水平检测
6.1 外周血中TNF-α表达检测:收集大动脉血液样本约1ml,3000g离心20min。取上清,保存于-80℃以待检测。采用ELISA试剂盒 (欣博盛公司,中国)检测大鼠血清TNF-α浓度。
6.2 心肌 TNF-α表达检测:采用 Western Blot方法检测心肌TNF-α表达。检测样本定位于左室前壁结扎动脉下方。另取AI/R3d组右心和后壁作对照观察。将心肌组织剪切成细小的碎片。按照每20mg组织加入200μl裂解液的比例加入裂解液。用玻璃匀浆器匀浆,直至充分裂解。BCA法测蛋白浓度。上样量20μg,用10%SDS-聚丙烯酰胺凝胶进行电泳分离,转NC膜。以5%脱脂奶封闭2h后,加入1∶1000兔抗大鼠 TNF-α抗体(PeproTech,美国),4 ℃孵育过夜,用Tris缓冲盐溶液(含0.05%吐温)洗3次。在暗室内,将NC膜浸入增强化学发光试剂(ECL)显色,X光片适当曝光后洗片。分析目的蛋白和内参β-actin的 Western-Blotting条带,结果表示为两者IOD比值并进行统计学分析。
7 统计学处理 本组使用SPSS16.0统计学软件进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用方差分析,以P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
1 两组大鼠急性缺血再灌注早期心功能比较见表1。采用心脏超声和血流动力学检测心功能变化,发现在急性缺血再灌注早期反映心脏的收缩功能的有关参数,如:EF、FS、LVSP、LVEDP等和反映心脏结构的参数,如:IVSd、LVIDs、EDV、ESV 等与假手术组比较均无显著变化(P>0.05)。然而,在相同心率状态下,反映舒张功能的参数,左室内压最大下降速率(-dp/dtmax),有不同程度的降低。在急性心肌缺血再灌注3d时,-dp/dtmax值与假手术3d该参数相比较有显著降低(P<0.05)。而在急性心肌缺血再灌注第1、3天时,-dp/dtmax值较之假手术组同期虽也有所降低,但无统显著性差异(P>0.05)。
2 急性心肌缺血再灌注大鼠早期心肌胶原容积和羟脯氨酸含量对比 见表2。进一步分析急性心肌缺血再灌注心肌纤维化的程度,胶原容积分数(CVF)即左心室胶原面积于所测视野面积之比。羟脯氨酸(HYP)在胶原蛋白中占13.4%,在弹性蛋白中占极少量,在其它蛋白中均不存在,因此羟脯氨酸的量能反映结缔组织疾病总的胶原代谢情况。这两项指标的检测可以直接反应心肌纤维化程度。在急性心肌缺血再灌注个时间点,CVF和HYP较假手术组同期明显增高(P<0.05),且于再灌注第3天达到最高值。然而,胶原容积分数仅在结扎动脉(前降支)的供血区域,左心前壁,表现为异常高值。而在再灌注第3天时,右心和左心后壁的胶原容积分数与假手术组相仿(P>0.05)。
表1 两组大鼠急性缺血再灌注早期心功能比较(±s)

表1 两组大鼠急性缺血再灌注早期心功能比较(±s)
Sham 组MI/R 组组 别第1天 第3天 第7天 第1天 第3天 第7天375.08±33.56 375.40±22.34 379.20±20.02 IVSd(mm) 1.55±0.28 1.67±0.32 1.59±0.32 1.60±0.18 1.58±0.33 1.57±0.29 IVSs(mm) 2.67±0.13 2.47±0.58 2.55±0.18 2.56±0.37 2.30±0.44 2.55±0.81 LVIDd(mm) 4.51±0.19 3.97±0.16 4.05±0.45 4.51±0.94 3.88±1.48 4.15±0.67 LVIDs(mm) 2.53±0.18 2.57±0.12 2.75±0.27 2.15±0.57 2.30±0.95 2.53±0.79 EF 0.78±0.026 0.75±0.062 0.77±0.086 0.68±0.046 0.66±0.057 0.69±0.094 FS 0.52±0.048 0.50±0.20 0.54±0.078 0.58±0.057 0.56±0.18 0.57±0.096 LVSP(mmHg) 77.42±12.55 76.45±10.25 75.44±14.13 72.52±26.85 70.67±10.15 73.84±10.04 LVEDP(mmHg) 2.19±0.84 2.33±0.59 2.04±0.77 2.09±1.04 2.13±1.09 2.06±0.91 EDV(cm3) 0.27±0.09 0.27±0.12 0.26±0.14 0.25±0.12 0.24±0.14 0.25±0.15 ESV(cm3) 0.039±0.007 0.046±0.019 0.044±0.009 0.033±0.007 0.034±0.009 0.047±0.019+dp/dtmax(mmHg/ms) 3.80±1.08 3.79±1.06 3.88±1.09 3.72±1.02 3.67±1.16 3.58±2.07-dp/dtmax(mmHg/ms) 2.72±0.38 2.75±0.64 2.69±0.39 2.28±0.86 1.56±0.48*HR(bpm) 395.80±35.46 385.40±32.34 396.20±18.20 2.37±0.54
3 急性心肌缺血再灌注大鼠早期心肌和血清中TNF-α表达比较 见表2及附图。通过Western Blot和ELISA方法,我们发现急性心肌缺血再灌注时心肌和血清中TNF-α的表达均显著增高(P<0.05)。在心肌中,TNF-α在急性缺血再灌注各时间点表达均较假手术组大幅增高(P<0.05),达8~10倍左右,但是其增高也是区域性的,仅在前降支所支配区域。然而在再灌注第3天的右心和左心后壁组织中,TNF-α的表达与假手术组持平或略高,并无显著性差异(P>0.05)。另外,我们通过ELISA方法检测血清中TNF-α表达,发现其表达规律和心肌中TNF-α为同一性,也是在再灌注第3天时表达最高。
表2 急性心肌缺血再灌注大鼠心肌纤维容积分数、心肌羟脯氨酸含量以及血清TNF-α浓度(±s)

表2 急性心肌缺血再灌注大鼠心肌纤维容积分数、心肌羟脯氨酸含量以及血清TNF-α浓度(±s)
Sham 组MI/R 组组 别第1天 第3天 第7天 第1天 第3天 第7天CVF(%) 6.53±2.43 5.52±1.54 5.78±2.14 22.74±2.35* 26.74±3.46* 21.43±3.72*HYP (μg/g) 158.53±13.56 150.34±20.53 162.36±22.34 462.56±50.43*583.56±34.78*46.78±46.62*TNF-α(pg/ml) 20.64±1.75 21.34±2.35 24.89±2.43 52.42±4.38* 68.24±2.56** 44.38±5.75*
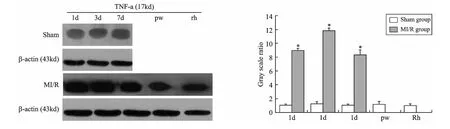
附图 急性心肌缺血再灌注大鼠心肌中TNF-α表达
讨 论
本研究显示:急性心肌缺血再灌注早期大鼠心舒张功能降低与心肌纤维化和TNF-α的表达异常增高密切相关。急性心肌缺血再灌注早期大鼠仅出现舒张功能降低而无明显得收缩功能减低及心脏结构变化。说明在缺血再灌注时,心功能的降低不仅是心肌细胞的损伤和丢失的结果,也有心肌间质发生纤维化改变的因素。
心肌纤维化是指心肌细胞外基质中胶原纤维过量积聚、胶原浓度显著升高或成分发生改变,它在多种心血管疾病中普遍存在,是心肌对压力超负荷、炎症反应、氧化应激等的反应[9,10]。在急性心肌缺血再灌注时,缺血再灌注区的细胞出现皱缩、崩解、坏死,以及结构紊乱,胶原纤维大量分泌,过度聚集于心肌细胞外和血管周围[11]。过度聚集的胶原纤维会对心功能产生不良影响,主要是增加心肌僵硬度,导致顺应性降低和舒张充盈下降[12];心肌小动脉周围胶原纤维增加[13],引起其储备能力的下降,从而影响心肌血流供应,进一步加重心肌缺血。但在试验中我们发现:在急性心肌缺血再灌注第1、7天时,心脏舒张功能虽有下降,但还未呈现出显著性差异。这可能是再灌注损伤的过程中,在缺血再灌注部位仍有一部分正常心肌保留下来,发挥其舒张收缩功能,且纤维化仅局限于模型建立时所结扎血管支配的区域,而对于非缺血再灌注部位的左心后壁的心肌几乎没有影响。
我们发现急性缺血再灌注心肌细胞的TNF-α与其胶原容积分数具有密切关系。已往研究证实:在心肌细胞中TNF-α通过活性氧中间体的产生使细胞肥大;通过细胞外基质蛋白诱导心肌纤维化;通过心肌细胞坏死和凋亡的形式导致心肌细胞缺失,然后由纤维组织修复,导致心肌纤维化[14]。同时,血浆TNF-α水平与左心室重构进展及心力衰竭密切联系。也有动物实验证实:给动物注射TNF-α可导致心脏功能障碍及心力衰竭[15]。另一方面,TNF-α可引起心肌成纤维细胞IL-1β和IL-6表达上调,从而加重心肌纤维化程度;并且能够通过激活并增加基质金属蛋白酶的表达来改变细胞外基质成分[16]。由此可见,TNF-α对于诱导心肌纤维化的作用是确定且多方面的。
总之,在急性心肌缺血再灌注早期,心脏舒张功能降低是缺血再灌注区心肌纤维化的结果,而TNF-α的表达增高则是再灌注时心肌纤维化的众多原因之一。
[1] Topol EJ,Yadav JS.Recognition of the imprortance of embolization in atherosclerotic vascular disease[J].Circulation ,2000,101(5):570-580.
[2] Michael LH,Entman ML,Hartley CJ,etal.Myocardial ischemia and reperfusion:a murine model[J].Am J Physiol,1995,269(6pt2):2147-2154.
[3] Eeckhout E,Kern MJ.The coronary no-reflow phenomenon:a review of mechanisms and therapies[J].Eur Heart J,2001,22(9):729-739.
[4] Rezkalla SH,Kloner RA.No-reflow phenomenon[J].Circulation,2002,105(5):656-662.
[5] Yamada T,Matsumori A ,Sasayama S.Therapeutic effect of anti-tumor necrosis factor-alpha antibody on the murine model of viral myocarditis induced by encephalomyocarditis virus[J].Circulation,1994,89(2):846-851.
[6] Raghupathy R,Makhseed M,Azizieh F,etal.Cytokine production by maternal lymphocytes during normal human pregnancy and in unexplained recurrent spontaneous abortion[J].Hum Reprod,2000,15(3):713-718.
[7] Maini RN,Elliott MJ,Brennan FM,etal.Beneficial effects of tumour necrosis factor-alpha (TNF-alpha)blockade in rheumatoid arthritis(RA)[J].Clin Exp Immunol,1995,101(2):207-212.
[8] Gurevitch J,Frolkis I,Yuhas Y,etal.Anti-tumor necrosis factor-alpha improves myocardial recovery after ischemia and reperfusion[J].J Am Coll Cardiol,1997,30(6):1554-1561.
[9] Yiting T,Bingxin L,Nasui W,etal.Fluorofenidone protects mice from lethal endotoxemia through the inhibition of TNF-a and IL-18release[J].Int Immunopharmacol,2010,10(5):580-583.
[10]Yeong HH,Hyun SL.Molecular cloning and characterization of chicken lipopolysaccharide-induced TNF-a factor[J].Dev Compa Immunol,2006,30(10):919-929.
[11] Kapadia S,Lee J,Torre-Amione G.Tumor necrosis factor gene and protein expression in adult feline myocardium afer endotox-in administration[J].J Clin Invest,1995,96(2):1042-1052.
[12] Tang X,Marciano DL,Leeman SE,etal.LPS induces the interaction of a transcription factor,LPS-induced TNF alpha factor,and STAT6(B)with effects on multiple cytokines[J].Proc Natl Aead Sci USA,2005,102(14):5132-5137.
[13] Kleine T,Zwerenz P,Zofel P.New and old diagnostic markers of meningitis in cerebrospinal fluid(CSF)[J].Brain Res Bull,2003,61(3):287-289.
[14] Usha S,Aiit K,Rajesh S,etal.Calreticulin transacetylasecatalyzed modification of the TNF-α-mediated pathway in the human peripheral blood mononuclear cells by polyphenolic acetates[J].Chemico-Biological Interactions,2010,185(3):263-270.
[15] Su C,Salzberg BA,Lewis JD,etal.Efficacy of anti-tumor necrosis factor therapy in animal with ulcerative colitis[J].Am J Gastmenterol,2002,97(10):2577-2584.
[16] 博 蔚.肿瘤坏死因子基因多态性与疾病[J].国外医学免疫学分册,2000,23(2):89-92.

