脑缺血再灌注后大鼠运动皮质SIRT3的表达特点*
西安市中心医院神经内科(西安710003)
常明则 吴海琴△ 乔 琳△△ 王新来 狄政莉 刘志勤 毛 佳 田 晔▲
沉默信信调节因子(Silent mating type information regulation 2,Sir2)家族属于第三类组蛋白去乙酰化酶,通过烟酰胺腺嘌呤二核苷酸(NAD+)参与调节组蛋白乙酰化,在基因沉默、染色质稳定、双链DNA断裂损伤后生理修复以及延长细胞周期中均起着重要的作用[1]。在哺乳动物共有7个SIRT的同源基因,分别命名为SIRT1-SIRT7。沉默信息调节因子3(Silent information regulator 3,SIRT3)是第一个被定位在哺乳动物细胞线粒体的NAD依赖的去乙酷化酶家族成员,广泛存在于线粒体基质和细胞核中,目前研究主要集中在调节代谢、防治变性疾病及抗衰老等方面,在线粒体能量生成、代谢、细胞凋亡和细胞内信号转导等方面发挥重要作用[2~4]。目前,SIRT3在缺血性脑损伤中的作用研究较少,本研究采用免疫组化技术观察大鼠全脑缺血再灌注后大脑运动皮质内SIRT3的动态变化情况。
材料与方法
1 实验材料
1.1 试剂与仪器:兔抗大鼠SIRT3单克隆抗体(SantaCruz公司),SABC试剂盒和DAB显色试剂盒由武汉博士德生物工程有限公司提供,JGD-RF2射频双极电凝器,江湾I型脑立体定位仪。
1.2 动物分组:SD大鼠42只,雌雄不拘,体重200~250g,由西安交通大学医学院动物实验中心提供,实验前将动物置于实验室适应环境1周,自由进食、饮水,室温22±2℃,相对湿度65%,每天光照12 h。随机均分为6组,即:正常对照组,脑缺血再灌注6h、24h、72h、5d和7d组,每组7只。
2 实验方法
2.1 动物模型的建立:采用改良Pulsinelli四动脉阻断法[5],以20%水合氯醛0.6ml/kg腹腔内注射麻醉,5min内痛觉及翻正反射消失,但有角膜反射。将大鼠转移到脑立体定位仪上,俯卧,头向下倾斜30度固定,直视下电凝第一颈椎后弓上的横突孔,阻断双侧椎动脉;24h后大鼠在乙醚麻醉下仰卧固定,分离两侧颈总动脉,待大鼠清醒后,用微型动脉夹夹闭两侧颈总动脉,脑电图变为一平线,15min后将两个动脉夹松开行再灌注。缺血时大鼠没有昏迷,或发生震颤、翻转,以及再灌注时发生痉挛、癫痫,均淘汰。
2.2 取材及制片:以20%水合氯醛0.8ml/kg腹腔内注射麻醉大鼠,快速开胸暴露心脏,经左心室插管至升主动脉,用4%多聚甲醛灌注固定1h,开颅取脑,置于相同灌注液12h,脱水后石蜡包埋。参照大鼠立体定位图谱[6],用石蜡切片机自前囟后3mm处向后行冠状位切片,片厚5μm。
2.3 免疫组化及结果判定:脑切片经脱蜡与水化后,至于蒸馏水配置的3%H2O2中,室温封闭15min,灭活内源性过氧化物酶的活性,并置于0.01mol/L枸橼酸钠缓冲溶液(pH 6.0)中加热10min进行抗原修复,正常山羊血清做为封闭液。一抗用兔抗大鼠SIRT3单克隆抗体。37 ℃ 复温 45min,0.01mol/LPBS洗3次,每次2min。后滴加生物素化二抗,37℃恒温孵育40min。0.01mol/L PBS洗3 次,每次2min并滴加试剂SABC,37℃恒温孵育20min后以0.01mol/L PBS洗4次,每次5min。再滴加 DAB溶液,室温下显色。脱水,透明,封片。光学显微镜下观察大鼠大脑运动皮质,以细胞膜出现鲜艳的棕黄色颗粒为阳性细胞,每张切片高倍镜(×400倍)下随机选择5个不同的视野,计数每个视野中阳性细胞数,取其平均值。
3 统计学处理 本组使用SPSSl3.0软件进行统计分析,所有检测数据以均数±标准差(±s)表示,采用单因素方差分析,组间比较采用LSD法,以P<0.05为有显著性差异,P<0.01为有极显著性差异。
结 果
光镜下可见SIRT3免疫反应产物呈棕黄色,胞膜染色为主,主要集中在Ⅱ及Ⅲ层,锥体细胞以及胶质细胞均有表达。正常对照组可见可见散在少量SIRT3蛋白表达;每高倍视野(×400)下正常对照组、再灌注6h、再灌注24h、再灌注72h、再灌注5d及再灌注7d组的SIRT3阳性细胞个数分别为15.14+2.11、70.71±6.13、86.57±5.03、95.71±6.05、80.71±4.39和53.14±3.80。脑缺血再灌注后各时间点组大鼠大脑运动皮质内SIRT3阳性细胞数较正常对照组增加(P<0.01);由6h组、24h组至72h组,大鼠大脑运动皮质内SIRT3阳性细胞数随再灌注时间延长而增加(P<0.01);由72h组、5d组至7d组,大鼠大脑运动皮质内SIRT3的含量随再灌注时间延长而减少(P<0.01),详见附图。
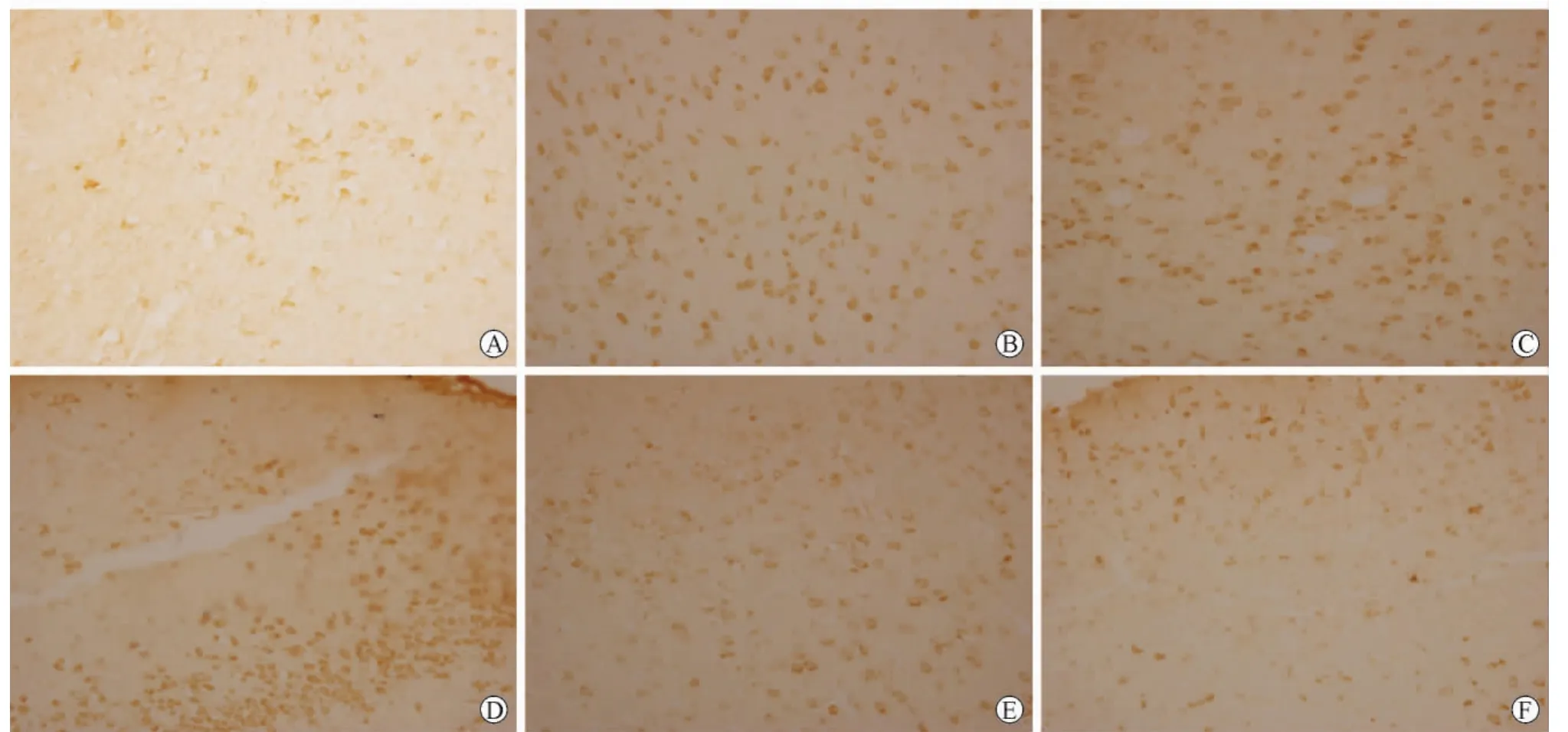
附图 各组大鼠运动皮质区SIRT3蛋白表达(SABC×400)A:正常对照组;B:再灌注6h组;C:再灌注24h组;D:再灌注72h组;E:再灌注5d组;F:再灌注7d组
讨 论
SIRT3是依赖于NAD+的去乙酰化酶的Sirtuin家族成员之一,能对线粒体内乙酰化蛋白脱乙酰基恢复或改善其调节蛋白活性,通过增加ROS清除酶活性和稳定线粒体功能来抑制线粒体内ROS的蓄积,增强线粒体氧化作用及呼吸链功能,对于缓解和降低氧化应激负荷具有重要意义[7]。Chen等研究证明:SIRT3能够增强乙酰化的锰超氧化物歧化酶(Mn-SOD)活性,降低线粒体内ROS水平[8]。近期研究表明:SIRT3能够提高线粒体中谷胱甘肽还原型/氧化型的比率及乙酰化人叉头框蛋白O3介导抗氧化损伤,下调ROS水平[9]。
大鼠全脑脑缺血再灌注后,SIRT3表达和活性变化有明显的动态时间分布特点。本研究通过免疫组化法发现在全脑缺血再灌注后大鼠大脑运动皮质内SIRT3的表达随再灌注时间延长呈抛物线式变化规律。正常对照组仅可见少量SIRT3蛋白表达,而再灌注后6h组、24h组至72h组,随再灌注时间延长SIRT3表达增加;由72h组、5d组至7d组,SIRT3表达随再灌注时间延长而减少。脑缺血后炎症启动于急性期,发展于亚急性期,并影响到慢性期的恢复,全脑缺血再灌注后急性期(数小时内),主要由于能量代谢障碍、离子平衡失调、兴奋性氨基酸毒性、自由基产生增加等变化,导致神经元急性损伤;亚急性期(数小时至数天),发展为炎症、细胞凋亡为主的变化[10~11],72h内的急性期及亚急性期内,SIRT3表达在可能伴随着炎症反应启动、活跃及细胞凋亡等,而慢性期表现为血管新生、神经元及其突触再生过程中伴随SIRT3表达的下降,可能与炎症反应后激发的脑保护机制相关。提示SIRT3可能参与脑缺血再灌注损伤后动态病理生理过程。细胞凋亡存在两种凋亡途径:外部途径和内部途径,外部途径又称之为凋亡受体途径,其始于死亡配体与细胞表面同族的受体相结合;内部途径也可称之为线粒体途径由许多细胞内和细胞外的刺激引起。于竹芹等研究表明:大鼠脑缺血再灌注后6h海马区凋亡神经元逐渐增多至再灌注7d凋亡神经元达峰值,随后至再灌注28d显著降低[12],与本研究中脑缺血再灌注后SIRT3时项动态变化的时项规律接近,提示SIRT3可能与脑缺血再灌注后凋亡的发生相关。
因此,我们设想,SIRT3通过调节线粒体ROS水平参与全脑缺血再灌注损伤后凋亡的内部途径机制,但其在全脑缺血再灌注损伤中扮演的具体的角色等有待进一步研究。
[1] Imai S,Armstrong CM,Kaeberlein M,etal.Transcriptional silencing and longevity protein SIR2is an NAD-dependent histone deacetylase [J].Nature,2000,403(6771):795-800.
[2]Cooper HM,Spelbrink JN.The human SIRT3protein deacetylase is exclusively mitochondrial[J].Biochem J,2008,411(2):279-285.
[3] Scher MB,Vaquero A,Reinberg D,etal.SirT3is a nuclear NAD+-dependent histone deacetylase that translocates to the mitochondria upon cellular stress[J].Genes Dev,2007,21(8):920-928.
[4] Duan W.Sirtuins:from metabolic regulation to brain aging[J].Frontiers in Aging Neuroscience,2013,5(36):1-13.
[5] Pulsinelli WA,Brierley JB.A new model of bilateral hemisphere ischemia in the unanesthetized rat [J].Stroke,1979,10(3):267-272.
[6] 包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出社,1991:40-50.
[7] Onyango P,Celic I,McCaffery J M,etal.SIRT3,a human SIR2homologue,is an NAD-dependent deacetylase localized to mitochondria[J].Proc Natl Acad Sci USA,2002,99(21):13653-13658.
[8] Chen YH,Zhang JY,Lin Y,etal.Tumour suppressor SIRT3deacetylates and activates manganese superoxide dismutase to scavenge ROS[J].Embo Rep,2011,12(6):534-541.
[9] Someya S,Yu W,Hallows W C,etal.SIRT3mediates reduction of oxidative damage and prevention of age-related hearing loss under caloric restriction[J].Cell,2010,143(5):802-812.
[10] Tseng AH,Shieh SS,Wang DL.SIRT3deacetylates FOXO3to protect mitochondria against oxidative damage[J].Free Radic Biol Med,2013,63(2):222-234.
[11] Dirnagl U,Simon RP,Hallenbeck JM.Ischemic tolerance and endogenous neuroprotection[J].Trends Neurosci,2003,6(5):248-254.
[12] 于竹芹,杨丽艳,刘广义.脑缺血再灌注后CIDE-B表达与神经元凋亡的关系[J].中国医药科学,2013,3(17):27-29.

