海带渣中岩藻黄素的酶法提取工艺研究
李 斌,吴永沛,刘翼翔,* ,蔡慧农,2,3,凌绍梅,闫相勇,苏永裕,张志刚
(1.集美大学食品与生物工程学院,福建厦门361021;2.福建省微生物与酶工程重点实验室,福建厦门361021;3.厦门市食品与生物工程技术研究中心,福建厦门361021;4.肉食品安全生产技术国家重点实验室,福建厦门361010)
岩藻黄素又称岩藻黄质、褐藻黄素,含有多个共轭双键,具有丙二烯和环氧烷结构,属于叶黄素类物质。岩藻黄素广泛分布于海藻、海洋浮游植物、水生贝壳等海洋动植物中[1],其中以褐藻含量最高[2]。大量研究表明,岩藻黄素具有抗氧化、抗肿瘤、抗炎、减肥、降脂等多种生物活性[3-7],在食品、医药、保健品及护肤美容产品等方面具有广阔的开发应用前景。海带是我国主要的褐藻,2010年我国海带年产量达到88.4万 t(以干重计),占我国海藻总产量的57.3%。目前,工业上对海带的深加工主要在于提取其中的褐藻胶、甘露醇和碘,而富含岩藻黄素的海带渣被当作廉价的饲料或生物肥料处理,造成资源极大的浪费。近年来,随着对岩藻黄素高生物活性的认识,其高效提取技术成为了开发利用岩藻黄素的关键。当前用于提取岩藻黄素的方法主要是传统有机溶剂提取法,另外,部分学者探究了超声波辅助提取[8]、超临界 CO2萃取[9]等技术提取岩藻黄素。岩藻黄素主要存在于细胞内[10],细胞壁的通透性直接影响岩藻黄素的提取效率。传统有机溶剂法提取岩藻黄素,由于不能破解细胞壁导致提取效率低,同时提取时间过长,不利于物质稳定性的维持,方法的重复性差;超声波辅助提取、超临界CO2萃取等技术提取效率高,时间短,但设备要求高、成本高,不适宜大规模的生产。与这些方法相比,生物酶法技术具有无毒、高效、反应条件温和、可控性强等优势[11]。
研究表明,海带细胞壁主要由纤维素、果胶质组成[12]。因此,本文以海带加工副产物—海带渣为原料,研究了纤维素酶、果胶酶及其组成的复合酶破壁技术对岩藻黄素提取的影响,优选出生物酶法技术为提取岩藻黄素的最佳工艺,从而为利用海带加工副产物提取岩藻黄素、实现海带资源综合利用提供技术支持。
1 材料与方法
1.1 原料与仪器
海带加工副产物 实验室制备;纤维素酶(100000U·g-1) Imperial Jade Bio-technology company;果胶酶(30000U·g-1) 上海晶纯生化科技股份有限公司;浓盐酸、95%乙醇、氢氧化钠等 均为分析纯。
UV-755B紫外-可见分光光度计 上海元析仪器有限公司;电子分析天平 德国赛多利斯仪器有限公司;IEC-31R台式高速冷冻离心机 美国Thermo公司;高速万能粉碎机 天津市泰斯特仪器有限公司;HZS-H水浴震荡锅 哈尔滨东联电子;酸度计 上海奥豪斯仪器有限公司;SHZ-ШD循环水真空泵 上海亚荣生化仪器厂;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 原料的预处理及制备 将海带进行清洗、烘干、粉碎、过筛,用热水法浸提海带多糖后离心,沉淀物即为海带渣,-20℃备用。
1.2.2 岩藻黄素酶法提取的工艺优化
1.2.2.1 加酶量对岩藻黄素得率的影响 称取一定质量的海带渣于烧杯中,分别加入不同量的纤维素酶、果胶酶,在 pH6.0、60℃条件下,酶解2h后,加入95%乙醇搅拌均匀后水浴提取1h,离心,取上清测定吸光度,计算岩藻黄素得率。
1.2.2.2 酶解pH对岩藻黄素得率的影响 选择1.2.2.1中最优的加酶量,分别调节不同的pH(由于纤维素酶pH稳定范围在4.0~9.0[13],故pH考察条件设定在4.0~8.0之间;果胶酶pH稳定范围在3.0~6.0[14],故其 pH 考察范围设定在 3.0~7.0 之间),其它方法同1.2.2.1。测定吸光度,计算岩藻黄素得率,选择最佳pH。
1.2.2.3 酶解温度对岩藻黄素得率的影响 选择1.2.2.2中最佳的酶解pH,设定酶解温度分别为20、40、50、60、70、80℃,其它方法同 1.2.2.2。测定吸光度,计算岩藻黄素得率,选择最佳酶解温度。
1.2.2.4 酶解时间对岩藻黄素得率的影响 选择1.2.2.3中最佳的酶解温度,设定酶解时间分别为30、60、90、120、150min,其它方法同 1.2.2.3。测定吸光度,计算岩藻黄素得率,选择最佳的酶解时间。
1.2.2.5 不同酶解法岩藻黄素提取效果的比较 根据纤维素酶法、果胶酶法优化出的提取条件,综合考虑,分别使用纤维素酶加酶量为16000U·kg-1,果胶酶加酶量为20000U·kg-1,复合酶加酶量(纤维素酶16000U·kg-1+果胶酶20000U·kg-1),选定酶解条件为pH5.0,酶解温度60℃,90min进行酶解提取,对比不加酶、纤维素酶法、果胶酶法、复合酶法提取岩藻黄素的效果。
1.2.2.6 最佳提取工艺参数优化 通过对纤维素酶法、果胶酶法提取岩藻黄素的单因素实验及不同酶解法提取岩藻黄素实验结果的分析,综合考虑各影响因素后,选取果胶酶法酶解 pH(A)、酶解温度(B)、酶解时间(C)三个因素,进行三因素三水平正交实验,确定酶法提取岩藻黄素的最佳工艺条件。

表1 岩藻黄素正交实验因素水平表Table 1 Factors and levels of orthogonal experiment on fucoxanthin
1.2.3 岩藻黄素的测定方法 在450nm吸收波长下,测定岩藻黄素提取液的吸光度值[15-16],按如下公式计算岩藻黄素的得率:

式中:A450为样品在450nm处的吸光值;n为稀释倍数;V为粗提取液总体积,mL;A1%1cm:在1cm光程长的比色皿中1g·L-1岩藻黄素的理论吸收值,即1600;M为样品质量,g。
1.2.4 数据分析 实验数据为3个平行实验样品的平均值,origin8.0软件做图,采用SPSS V17.0统计软件对数据进行方差分析(One-Way ANOVA)。
2 结果与分析
2.1 加酶量对岩藻黄素得率的影响
如图1所示,随着加酶量的增加,岩藻黄素的得率逐步增加至平稳,且果胶酶作用效果明显优于纤维素酶作用效果,这可能由于果胶酶决定着酶解过程中海带单细胞的产生[17]。对实验结果进行单因素方差分析,在α=0.05水平下,纤维素酶法处理组中加酶量分别为 16000、20000、25000、30000U·kg-1时岩藻黄素得率均数间差异不显著,其余均差异显著,故取16000U·kg-1为纤维素酶的最适加酶量,此时岩藻黄素的得率为0.044%,比未加酶得率提高了32%;果胶酶法处理组中加酶量 20000U·kg-1与25000U·kg-1时岩藻黄素得率均数差异不显著,其余均差异显著,故选20000U·kg-1为果胶酶最适加酶量,得率达到0.114%,是未加酶得率的3.3倍。

图1 加酶量对岩藻黄素得率的影响Fig.1 Effect of enzyme concentration on the yield of fucoxanthin
2.2 酶解pH对岩藻黄素得率的影响
在2.1确定最佳加酶量的基础上,进一步研究了pH对岩藻黄素得率的影响。由图2可知,纤维素酶法提取岩藻黄素的过程中:当pH小于7.0时,岩藻黄素的得率随pH的增大而增加,当酶解液pH达到6.0时,得率达到最大值0.044%,当pH大于6.0时得率随pH的增大而降低;果胶酶法提取岩藻黄素的过程中:当pH小于6.0时,岩藻黄素的得率随pH的增大而增加,当酶解液pH达到5.0时,得率达到最大值0.120%,当pH大于5.0时得率随pH的增大而降低。由此可见,纤维素酶法提取岩藻黄素的最佳pH为6.0,果胶酶法提取岩藻黄素的最佳pH为5.0,且果胶酶破坏海带细胞壁的效果要显著高于纤维素酶的破壁效果。

图2 酶解pH对岩藻黄素得率的影响Fig.2 Effect of the pH value of hydrolysis conditions on the yield of fucoxanthin
2.3 酶解温度对岩藻黄素得率的影响
根据2.1和2.2的研究结果,本文观察了不同温度下的酶法破壁对岩藻黄素得率的影响。由图3可以看出:酶解温度在20℃时两种方法岩藻黄素的得率非常接近,但在随后的温度变化过程中,果胶酶法岩藻黄素的得率一直高于纤维素酶法的得率。当酶解温度在20~60℃之间时,随着温度升高,经纤维素酶和果胶酶破壁处理后,岩藻黄素的得率都随之增加;当温度为60℃时,得率达到最大值,纤维素酶处理组得率为0.044%,果胶酶处理组得率为0.119%;当温度大于60℃后,岩藻黄素的得率明显下降。因此,选择60℃为两种酶法提取的最佳温度。

图3 酶解温度对岩藻黄素得率的影响Fig.3 Effect of the temperature of hydrolysis conditions on the yield of fucoxanthin
2.4 酶解时间对岩藻黄素得率的影响
基于以上实验结果,进一步研究了酶处理时间对岩藻黄素得率的影响。由图4中可以看出,在酶处理时间内,果胶酶破壁提取岩藻黄素的效果都明显高于纤维素酶法,且酶解时间在30~90min时,两种酶处理下的岩藻黄素得率随着酶解时间的延长而增加;在90min时得率达到最高,分别为纤维素酶处理组0.047%,果胶酶处理组0.127%。然而,随着时间的延长,岩藻黄素得率逐步降低。这种现象可能是由于岩藻黄素的稳定性差,长时间的处理导致岩藻黄素发生氧化降解。故确定酶解的最佳时间为90min。

图4 酶解时间对岩藻黄素得率的影响Fig.4 Effect of the time of hydrolysis conditions on the yield of fucoxanthin
2.5 不同酶解法提取效果的比较
为了得到提取岩藻黄素的最佳酶解工艺,本文进一步对比了由纤维素酶+果胶酶组成的复合酶、单独使用纤维素酶、果胶酶对岩藻黄素的提取效果。由图5可知,酶法提取岩藻黄素比不加酶提取岩藻黄素的得率更高,并且果胶酶法得率远高于纤维素酶法得率,复合酶法得率略高于果胶酶法得率。数据显示纤维素酶法岩藻黄素得率是不加酶的1.36倍,果胶酶法是不加酶得率的3.72倍,复合酶法是不加酶得率的4.09倍。充分表明酶法可以加速植物细胞壁的崩解,改变细胞的通透性,进而提高岩藻黄素的提取效果。虽然复合酶处理组的岩藻黄素得率较单独使用果胶酶的效果略好,但综合考虑生产成本问题,选定果胶酶法为提取岩藻黄素的最佳方法。
2.6 岩藻黄质最佳工艺条件的确定
根据单因素实验结果及不同酶法提取效果分析,以岩藻黄素得率为指标,选取果胶酶酶解pH(A)、温度(B)、时间(C)三个因素三水平进行 L9(33)正交实验,各组合实验重复三次,结果见表2。

表2 正交实验设计与结果Table 2 Orthogonal experiment design and corresponding results
由表2正交实验结果和极差分析表明,在果胶酶法提取岩藻黄素工艺中,影响岩藻黄素得率的因素主次顺序为酶解温度>酶解pH>酶解时间。综合各因素得出海带渣中岩藻黄素酶法提取的最佳工艺条件组合为 A2B2C2,即酶解pH为5.0,酶解温度60℃,酶解时间90min。
据表3的方差分析结果可知酶解温度对果胶酶法提取岩藻黄素得率影响显著,酶解pH和酶解时间对岩藻黄素得率的影响不显著。按上述最佳条件,用果胶酶法从海带渣中提取岩藻黄素,做3次平行验证实验,通过公式计算岩藻黄素得率,平均值为0.124%,明显高于正交表中的其他组合。
3 讨论
由于岩藻黄素主要存在于质体、液泡等细胞器及细胞壁内,因此海带细胞壁的破壁程度对岩藻黄素的提取率具有决定性的影响。本文选择果胶酶法为提取岩藻黄素的最佳方法,最终确定果胶酶加酶量 20000U·kg-1,pH5.0,酶解温度 60℃,酶解时间90min,液料比40L·kg-1,在此条件下岩藻黄素得率达到0.124%。与其他研究者的研究结果做对比:赵鹏[18]常规提取,以海带为原料,选择甲醇做为最佳提取溶剂,液料比为43.5L·kg-1,提取时间2.05h,温度52.4℃时,可以达到最大得率0.023%,酶法提取的溶剂消耗和时间分别降低了8.1%和27%,岩藻黄素得率提高了4.04倍;超声提取,超声功率45Hz,液料比33.5L·kg-1,时间 60.9h,温度50.1℃,得率0.035%,酶法提取岩藻黄素得率提高了2.56倍;刘梁[18]研究结果,以海带为原料,80%甲醇做为提取剂,液料比10L·kg-1,40℃,提取时间 1h,提取 2 次,得率0.056%,酶法提取在缩短提取时间的基础上,得率提高了1.23倍;尹尚军[19]等从羊栖菜中提取岩藻黄质,最佳溶剂配比为90%,乙醇和丙酮体积比3∶1,液料比40L·kg-1,65℃水浴振荡提取两次,每次各80min,得岩藻黄质得率为0.107%,酶法提取在缩短提取时间的基础上,得率提高了15.9%。此外,岩藻黄素得率的高低也可能由于原料的产地、种类以及海带的粉碎程度不同导致在同样的实验方法、实验设备状态下存在差异。总结以上研究结果,酶法提取可以温和的破坏海带细胞壁,降低溶剂消耗、缩短提取时间,在保持岩藻黄素稳定性的基础上进行高效率的提取,是一种新型、高效绿色提取技术,可以用此方法探索大批量的制备岩藻黄素,有利于产业化发展。
4 结论
经过单因素优化,确定出纤维素酶法提取的最佳酶解条件是加酶量16000U·kg-1,pH为6.0,酶解温度60℃,酶解时间90min,得率达到0.046%;果胶酶法提取的最佳酶解条件是加酶量20000U·kg-1,pH5.0,酶解温度60℃,酶解时间90min,得率达到0.124%;复合酶(纤维素酶16000U·kg-1+果胶酶20000U·kg-1)在 pH5.0,酶解温度 60℃,酶解时间90min酶解后提取,得率达到0.137%,比普通试剂得率提高3.09倍,比纤维素酶法得率高出2倍,比果胶酶法得率提高了9.9%。但考虑到复合酶得率相比于果胶酶得率提高不多以及成本问题,酶法提取岩藻黄素最终选用果胶酶法进行提取。通过正交实验确定果胶酶法提取岩藻黄素的最佳工艺条件为加酶量20000U·kg-1,酶解pH 为5.0,酶解温度60℃,酶解时间90min,液料比40L·kg-1。以海带加工副产物为原料,采用酶法提取岩藻黄素,不仅提取效率高,对环境污染小,设备要求低,而且以海带加工副产物为原料能够充分利用海带资源,提高其经济价值。
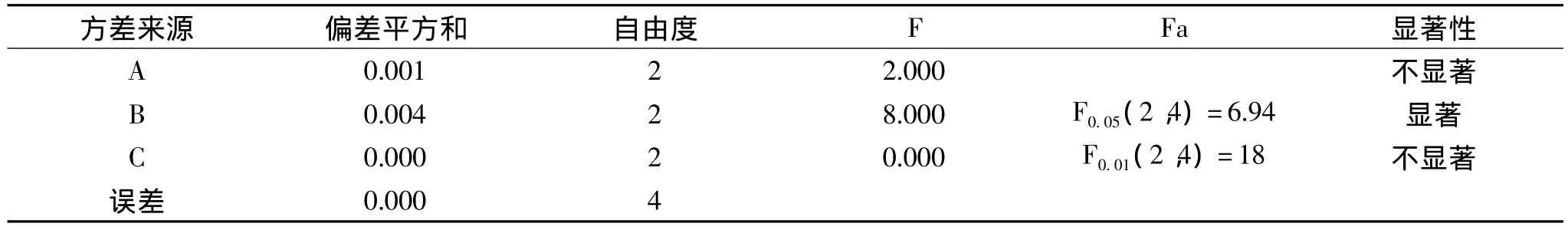
表3 实验结果的方差分析及显著性检测Table 3 Variance analysis of experiment results and significance test
[1]项斌,高建荣.天然色素[M].北京:化学工业出版社,2004:105-172.
[2]李艳梅,刘清华.含岩藻黄素提取物的组合物[P].国际专利:WO2010081259,2010-7-22.
[3]Sachindra N M,Sato E,Maeda H,et al.Radical scavenging and singlet oxygen quenching activity of marine carotenoid fucoxanthin and its metabolites[J].Journal of Agricultural and Food Chemistry,2007,55(21):8516-8522.
[4]Riccioni G.Marine carotenoids and oxidative stress[J].Marine drugs,2012,10(1):116-118.
[5]Tanaka T,Shnimizu M,Moriwaki H.Cancer chemoprevention by carotenoids[J].Molecules,2012,17(3):3202-3242.
[6]Kim K N,Heo S J,Kang S M,et al.Fucoxanthin induces apoptosis in human leukemia HL-60 cells through a ROS-mediated Bcl-xL pathway[J].Toxicology in vitro,2010,24(6):1648-1654.
[7]Bharathiraja K,Hari Babu L,Vijayaprakash S,et al.Fucoxanthin,a marine carotenoid protects cadmium-induced oxidative renal dysfunction in rats[J].Biomedicine & Preventive Nutrition,2013,3(3):201-207.
[8]陈文佳,邵秀芝,赵祥忠,等.超声波辅助提取岩藻黄素的工艺优化[J].农业机械,2011,(14):168-171.
[9]Roh M K,Uddin M S,Chun B S.Extraction of fucoxanthin and polyphenol from Undaria pinnatifida using supercritical carbon dioxide with co-solvent[J].Biotechnology and Bioprocess Engineering,2008,13(6):724-729.
[10]杨立群.海带中总色素和褐藻黄素的提取分离及其生物活性研究[D].济南:山东师范大学,2008.
[11]闫训友,刘志敏,史振霞,等.纤维素酶在食品工业中的应用进展[J].食品工业科技,2004,25(10):140-142.
[12]孟琛,孟祥红,肖慧,等.不同品系海带细胞壁组成对褐藻酸降解菌感染响应的差异性[J].武汉大学学报:理学版,2007,52(6):767-772.
[13]邵学良,刘志伟.纤维素酶的性质及其在食品工业中的应用[J].中国食物与营养,2009,(8):34-36.
[14]刘国良,遥远.黑曲霉 HYA4菌株产果胶酶酶学性质研究[J].黑龙江科技信息,2013,(35):133.
[15]惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005:90-94.
[16]刘梁,勾明明,张春枝,等.海带岩藻黄素提取工艺的优化[J].大连工业大学学报,2010,29(6):406-408.
[17]王华斌,王珊,傅力.酶法提取石榴皮多酚工艺研究[J].中国食品学报,2012,12(6):56-65.
[18]赵鹏.海带中岩藻黄素的提取与纯化工艺研究[D].北京:北京化工大学,2010.
[19]尹尚军,徐涛,刘丽平,等.羊栖菜岩藻黄质的提取工艺研究[J].食品工业科技,2011(4):272-275.

