PEF作用下亚致死损伤酿酒酵母修复条件的初步研究
陈 晨,赵 伟,杨瑞金,顾艳洁
(1.江南大学食品学院,江苏无锡214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡214122)
高压脉冲电场(PEF)技术能够有效地杀灭食品中腐败菌和致病菌,同时能够较好保持食品固有的营养成分[1]。国内外的学者在研究大量PEF不同体系的杀菌效果同时,已开始对PEF的杀菌机理展开进一步的研究。有研究表明,PEF等非热杀菌方式除杀灭部分微生物外,还会形成一定比例的损伤亚致死细胞,亚致死微生物在特定的环境下可以进行自我修复[2-4],恢复其自身繁殖能力,这使得直接对食品安全和货架期造成不良的影响。因此,研究亚致死微生物的修复条件,从而进一步灭活微生物和验证PEF杀菌食品的安全性是非常必要。陈晓婵等人[5]对比研究了高压脉冲电场对草莓汁中大肠杆菌和酿酒酵母损伤亚致死细胞产生的影响,同时还探究发现了PEF处理后冷臧或温和热处理都可以抑制亚致死酿酒酵母修复或使其进一步死亡。Somolinos[6]等选用不同 pH培养基研究了 PEF处理下下亚损伤酿酒酵母细胞的自我修复情况。Pernic[7]等人以大肠杆菌和沙门氏菌作为目标微生物,提出PEF亚致死损伤是一个累积的过程。
酿酒酵母是液体食品(乳制品、果蔬汁、非酒精性饮料等)中的常见污染菌种,对各种防腐剂、电离辐射照射、冷冻等的抵抗性强[8]。草莓营养丰富,常规热杀菌会造成热敏性活性成分流失,降低了草莓汁的营养价值,因此国内外学者开始倾向于利用PEF等非热加工技术对草莓汁等果蔬饮品进行杀菌研究,以便于应用于实际生产。在酿酒酵母生长过程中,除需碳源、氮源和生物素外,还需要K+、Ca2+、Mg2+等无机金属离子作为生长因子,培养环境中金属离子的含量影响着酿酒酵母的生理代谢活动[9-10]。
本实验以酿酒酵母作为研究模型,以培养体系和金属离子作为研究平台,选用模拟体系和实际体系(草莓汁体系),初步研究了培养体系和金属离子对PEF作用下对亚致死损伤酿酒酵母的影响。为PEF杀菌机理提供进一步的研究提供了理论依据。
1 材料与方法
1.1 材料与仪器
酿酒酵母菌 江南大学食品酶学实验室提供,菌种编号C-03;酵母浸出粉LP0021 英国OXOID公司;蛋白胨F403、葡萄糖、氯化钠、无水氯化钙、硫酸镁、磷酸氢二钾 均为分析纯,购自国药集团化学试剂有限公司。
OSU-4L型实验室规模PEF连续处理设备 美国俄亥俄州立大学;DRP-9082型电热恒温培养箱 上海森信实验仪器有限公司;LDZX-50KB立式压力蒸汽灭菌器 上海申安医疗器械厂;XSW-CJ-2A标准型净化工作台 吴江市绿叶空调净化有限公司;QYC2102-C型恒温培养摇床 上海新苗医疗器械有限公司。
1.2 实验方法
1.2.1 微生物的活化培养与接种 酿酒酵母(C-03)由酵母浸出粉胨葡萄糖(YPD)琼脂斜面培养基移至YPD液体培养基,30℃摇床200r/min培养16~20h至对数生长期。菌液在4℃条件下冷冻离心(8000r/min,6min)得到菌液沉淀,用pH7.2灭菌的磷酸盐缓冲液(PBS)反复洗2次后重悬,菌悬液浓度达到107~108CFU/mL,电导率约为2000μs/cm。
1.2.2 模拟体系和实际体系配制 模拟体系一:主要是以酵母浸出粉、蛋白胨 F403和葡萄糖配制0.1%酵母浸出粉缓冲溶液、0.1%蛋白胨缓冲溶液、0.1%葡萄糖缓冲溶液作为目标体系,可利用PBS调节电导率至3000μs/cm左右。模拟体系二:在以pH7.2灭菌的PBS菌悬液中,用无水氯化钙、硫酸镁、磷酸氢二钾在缓冲体系添加不同浓度的金属离子。实际体系:选用新鲜草莓汁,将市售新鲜草莓洗净后,按料液比1∶6,用果汁机榨汁,用离心机离心(3000r/min,15min)获取上清液,抽滤后草莓汁电导率约为3000μs/cm,用无水氯化钙、硫酸镁、磷酸氢二钾在草莓汁中添加不同浓度的金属离子。以上均将10mL培养液1.2.1接种至90mL不同处理体系中。
1.2.3 高压脉冲电场杀菌 采用实验室规模连续PEF处理设备,脉冲电场为双极方形波脉冲电场。实验室选择6个连续处理腔,选用了电场强度20kV/cm,处理循环时间为400μs,脉冲宽度 2μs,脉冲频率200Hz,循环式冷却水浴的温度为15℃。PEF杀菌处理后的不同样品在室温下放置 0、5、30、50、70、120 和150min进行修复研究。
1.2.4 选择性培养基和非选择性培养基 采用选择性平板法测定亚致死损伤微生物,计数参照Perni等的方法[7]。受损失的酵母细胞在正常培养基上可以进行生长,但是在高渗透环境下无法维持渗透平衡,故不能生长;而未受损伤的酵母细胞可以在适度的高渗透环境下生长。故选用两种培养基进行亚致死损伤微生物的测定:一种是正常的非选择性培养基,另一种是选择性高渗透培养基,以顾艳洁等人[11]确定的4%NaCl浓度为酿酒酵母细胞的临界渗透压,即常规培养基补加4%NaCl。
1.2.5 微生物计数 根据GB/T4789.2-2003方法,对PEF处理前后的菌液采用菌落平板计数法进行微生物计数。通过将菌液用0.85%生理盐水以10倍稀释法进行逐级稀释,选择合适的稀释度,吸取1.0mL稀释样于灭菌平皿中与培养基混合摇匀,于(30±0.1)℃条件下培养24h并计数。
1.2.6 cFDA标记 羧基荧光素乙酰乙酸(cFDA)是一种亲脂性、无荧光的物质,能够自由穿越细胞膜,可用来评价细胞内酶活力。cFDA进入细胞后会被细胞内非特异性酯酶水解生成极性、不能穿过细胞膜的荧光物质—羧基荧光素(cF)。cF标记细胞经488nm激发后可在530nm发射绿色荧光,荧光越强表明细胞非特异性内酯酶活越强。取PEF处理前后的酿酒酵母菌悬液1.0mL用cFDA染液(终浓度为5μg/mL)37℃避光染色30min,PBS反复冲洗两次去除多余的染料。
1.2.7 酿酒酵母非特异性内酯酶活力的测定 经cFDA染色后的酵母细胞用流式细胞分析仪检测FSC、SSC及FL1荧光通道(绿色)的各项指标。每个样品检测20000个细胞。采用488nm激发光,cFDA标记细胞在530nm处发绿色荧光,通过FL1通道检测,数据采集后用CellQuest Pro软件进行分析。
2 结果与讨论
2.1 不同缓冲体系中亚致死损伤酿酒酵母的修复
参考 Garcıá,Somolinos 等人[6]对 PEF 处理后大肠杆菌及酿酒酵母修复情况考察时的培养液选取原则,选取相同电导率的0.1%酵母浸出粉缓冲溶液、0.1%蛋白胨缓冲溶液、0.1%葡萄糖缓冲溶液作为酿酒酵母的培养修复环境,采用选择性培养基与非选择性培养基进行菌落计数,结果如表1~表3所示。
通过相同条件PEF处理后,三种缓冲体系中酿酒酵母的存活情况及亚致死损伤酿酒酵母的修复均存在差异。在0.1%酵母浸出粉缓冲体系中,PEF处理后亚损伤酵母细胞约为2个对数,在0.1%蛋白胨缓冲体系中,PEF处理后亚损伤酵母细胞约为1个对数,而在0.1%葡萄糖缓冲体系中,PEF处理后亚损伤酵母细胞约为0.8个对数。亚致死损伤酵母的修复速度在成分相对丰富的酵母浸出粉缓冲体系与蛋白胨缓冲体系中远快于成分较为单一的葡萄糖缓冲体系,在酵母浸出粉缓冲体系与蛋白胨缓冲液中处理后30min内损伤细胞即基本修复完毕,在葡萄糖缓冲液中处理后120min左右损伤细胞才修复完全。
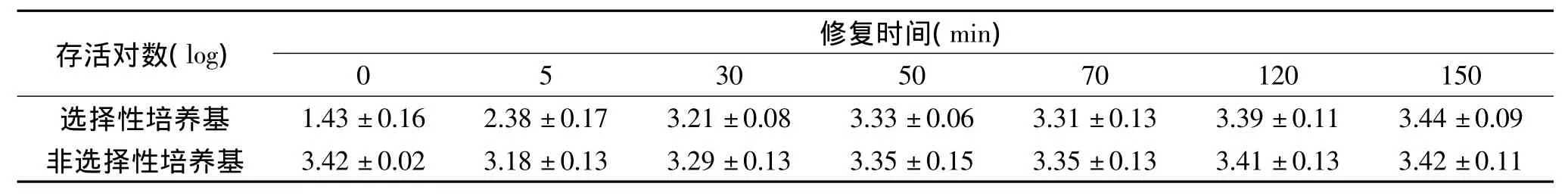
表1 0.1%酵母浸出粉缓冲体系中PEF处理后酿酒酵母的修复Table 1 The recovery of PEF treated S.cerevisiae in 0.1%Yeast extract solution
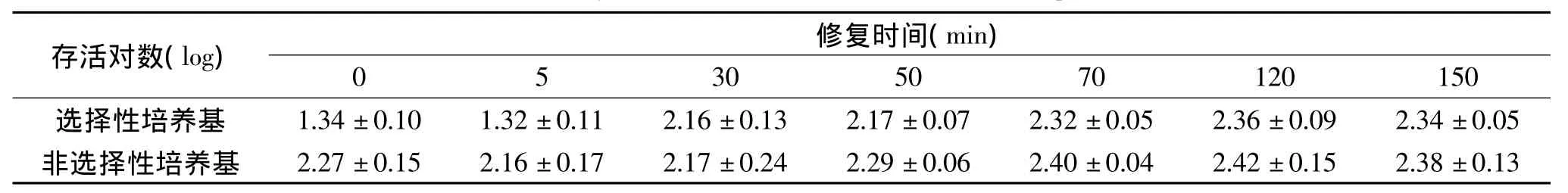
表2 0.1%蛋白胨缓冲体系中PEF处理后酿酒酵母的修复Table 2 The recovery of PEF treated S.cerevisiae in 0.1%Peptone solution
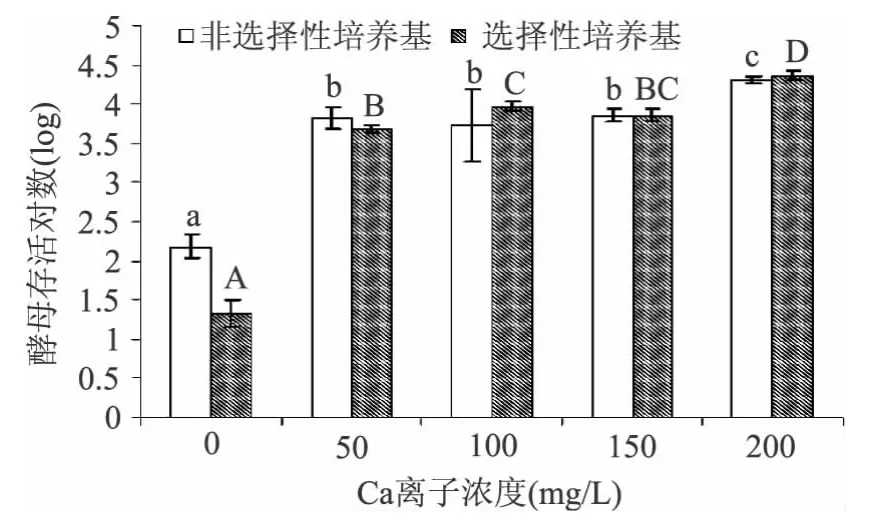
图1 不同添加量的金属离子Ca2+对酿酒酵母存活量的影响Fig.1 Effect of different addition of metal ions Ca2+on the survival of S.cerevisiae cells
2.2 金属离子对模拟体系中亚致死损伤酿酒酵母的修复
无机盐离子是酿酒酵母生长过程中必不可少的营养物质,其中 Na、K、Ca、Mg等金属阳离子对酿酒酵母的正常生理机能有着重要的影响。本实验初步选取K、Ca、Mg三种均对酶有一定激活作用的金属离子考察其对PEF处理后亚致死酿酒酵母细胞的修复作用。
参照酿酒酵母生长过程中三种离子的最适添加量以及苹果、草莓等常见水果中三种金属离子的一般含量,分别向酿酒酵母缓冲溶液中添加不同浓度的金属离子,同时保证微生物初始浓度在一个对数级。PEF处理前后进行菌落计数,得到酿酒酵母的存活情况如图1~图3所示。
在未添加特定金属离子的对照组,PEF处理后酿酒酵母存活对数约为2.3~3.0个对数,存活细胞中亚致死损伤酿酒酵母的所占比例约为40%左右,PEF处理后亚致死酵母细胞存活对数约为1个对数,证明PEF处理后有亚致死酵母细胞的存在。
从图1可见,当Ca2+浓度升至50mg/L后,对酵母细胞存活有显著影响(p<0.05),可见Ca2+存在会影响酵母的存活。而当Ca2+浓度升至200mg/L,非选择性培养基和选择性培养基分别检测酵母存活对数为4.31和4.36个对数,说明修复完全。从图2可见,当Mg2+浓度升至30mg/L后,酵母存活对数显著提高至约4.7个对数,而随着离子浓度的增加,存活不同大写或小写字母代表不同培养基的差异性(p<0.05)。
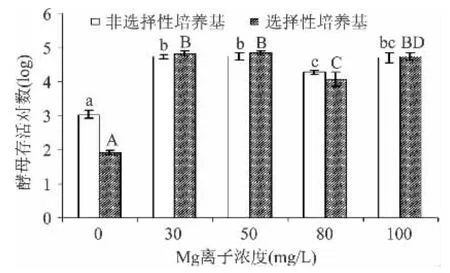
图2 不同添加量的金属离子Mg2+对酿酒酵母存活量的影响Fig.2 Effect of different addition of metal ions Mg2+on the survival of S.cerevisiae cells
不同大写或小写字母代表不同培养基的差异性(p<0.05)。对数略有所下降,当离子浓度到达100mg/L,存活对不同大写或小写字母代表不同培养基的差异性(p<0.05)。数变化不显著(p>0.05)。说明在 Mg2+浓度升至30mg/L后,已修复完全。从图3可见,当K+浓度升至0.8g/L后,酵母存活对数显著提高至4.4个对数,已修复完全。但随着离子浓度的提高,会对酵母菌的存活产生一定的副作用。
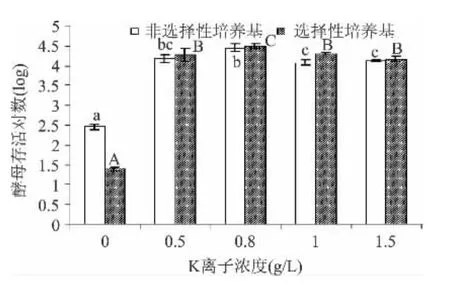
图3 不同添加量的金属离子K+对酿酒酵母存活量的影响Fig.3 Effect of different addition of metal ions K+on the survival of S.cerevisiae cells
考虑到K、Ca、Mg三种金属离子均对酶有一定激活作用,初步以酿酒酵母内酯酶为研究对象,应用cFDA对酵母进行荧光标记能够反应酵母的酯酶和蛋白的水平,从而反应酵母的活性。
选取约20000个细胞,以cFDA标记酿酒酵母细胞内酯酶,FAM使光越强表明细胞非特异性内酯酶活越强,如图4所示,三种金属离子的添加对酿酒酵母的非特异性内酯酶活均产生了不同程度的影响。Ca2+的添加使得酿酒酵母细胞内酯酶活呈现先降后升的趋势;Mg2+的添加使得酿酒酵母细胞内酯酶活呈现负增长的趋势;而K+的添加使得酿酒酵母细胞内酯酶活呈现增加的趋势。说明三种金属离子添加对亚致死损伤酿酒酵母细胞的修复也部分体现在于对非特异性内酯酶的修复。金属离子的添加对PEF处理下酵母细胞内酯酶的修复是个较为复杂的过程,目前研究未能阐述其影响机理。
2.3 金属离子对食品体系中亚致死损伤酿酒酵母的修复
为了更全面的反映三种金属离子对亚致死损伤酵母细胞的修复作用,选取鲜榨草莓汁作为实际食品体系,三种离子的添加量与缓冲体系中保持一致,进行菌落计数,得到酿酒酵母的存活情况如图5~图7所示。
从图5可见,在未添加特定金属离子的对照组中,PEF处理后产生亚致死酵母细胞约为0.5个对数。金属阳离子的添加对鲜榨草莓汁中亚致死损伤酵母细胞的修复产生了一定的促进效果。当Ca2+浓度升至50mg/L后,Ca2+添加对酵母细胞存活有显著影响(p<0.05),酵母存活对数约达至3个对数,且修复完全。Ca2+主要以离子状态存在于细胞中以控制细胞的生理状态,如调节膜的透性、激活酶等。冯玉娟等[12]曾指出酿酒酵母的生长代谢速度随着Ca2+的添加量而加快,而当Ca2+浓度超过一定量之后酿酒酵母生长会受到抑制。Yamada等人在对 Ca2+-ATPase活力的测定中已经得知PEF处理会显著增加酿酒酵母中Ca2+-ATPase的活力,因此可以推测当缓冲体系中额外添加Ca2+后,酿酒酵母依赖于高尔基体上活跃的Ca2+-ATPase将胞外Ca2+运输到胞内,从而加快损伤酿酒酵母的修复速度[13]。
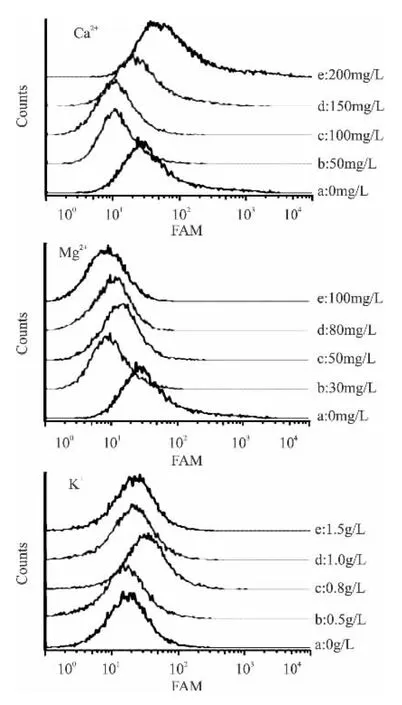
图4 不同添加量的金属离子对酿酒酵母内酯酶活的影响Fig.4 Effect of different addition of metal ions on the lactone enzyme activity of S.cerevisiae cells
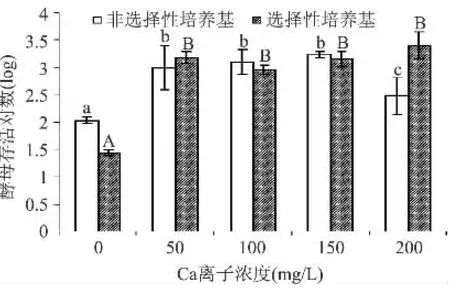
图5 不同添加量的金属离子Ca2+对草莓汁中酿酒酵母存活量的影响Fig.5 Effect of different addition of metal ions Ca2+on the sublethally injured percentage of S.cerevisiae in Strawberry juice

图6 不同添加量的金属离子Mg2+对草莓汁中酿酒酵母存活量的影响Fig.6 Effect of different addition of metal ions Mg2+on the sublethally injured percentage of S.cerevisiae in Strawberry juice

图7 不同添加量的金属离子K+对草莓汁中酿酒酵母存活量的影响Fig.7 Effect of different addition of metal ions K+on the sublethally injured percentage of S.cerevisiae in Strawberry juice
从图6可见,当Mg2+浓度升至30mg/L,Mg2+的添加对酵母存活对数影响显著(p<0.05),当Mg2+浓度升至50mg/L和80mg/L,Mg2+浓度的添加对酵母存活数影响不显著(p<0.05),随着浓度提高,会对酵母菌的存活产生一定的副作用,表现在酿酒酵母存活对数的下降。
从图7可见,在未添加特定金属离子的对照组中,PEF处理后亚致死酵母细胞约为0.8个对数,当K+浓度升至0.8g/L后,K+的添加对酵母细胞存活有显著影响(p<0.05),酵母存活对数约达至4个对数。随着浓度提高,酵母存活对数下降,杀菌效果反而提高。可能是由于酿酒酵母在受到PEF处理刺激时会导致细胞膜通透性、渗透压及膜电位改变,从而可能引起K+外流。当缓冲体系中额外加入K+后,胞外K+渗透压高于胞内,阻止了酵母细胞内K+外流现象,同时刺激了酵母内酯酶活,促进亚致死损伤酿酒酵母细胞的修复。
3 结论
在单一的葡萄糖缓冲体系存在的亚损伤酵母细胞较复杂成分的酵母浸出粉、蛋白胨溶液少。亚致死酵母细胞在以YPD培养基为主要成分的酵母浸出粉、蛋白胨和葡萄糖缓冲溶液于30~70min内完成修复。
在模拟体系中,未添加特定金属离子的对照组均存在亚损伤酵母细胞。当Ca2+浓度升至50mg/L,Mg2+浓度升至30mg/L,当K+浓度升至0.8g/L后,亚致死损伤细胞均已修复。
在真实草莓汁体系中,当Ca2+浓度升至50mg/L,K+浓度升至0.8g/L后,亚致死损伤细胞均已修复。Mg2+离子的添加对PEF作用下亚致死酵母修复影响不显著,但随着离子浓度的增加,PEF对酵母细胞杀菌效果先降后升。
[1]曾新安,陈勇.脉冲电场非热灭菌技术[M].北京:中国轻工业出版社,2004,3-7.
[2]Jaeger H,Schulz A,Karapettov N,et al.Protective effect of milk constituents and sublethal injuries limiting process effectiveness during PEF inactivation of Lb.rhamnosus[J].International Journal of Food Microbiology,2009,134:154-161.
[3]Simpson R K,Whittington R,Earnshaw R G,et al.Pulsed high electric field causes‘all or nothing’membrane damage in Listeria monocytogenes and Salmonella typhimurium,but membrane H+-ATPase is not a primary target[J].International Journal of Food Microbiology,1999,48:1-10.
[4]Russell N J,Colley M ,Simpson R K ,et al.Mechanism of action of pulsed high electric field(PHEF)on the membranes of food-poisoning bacteria is an ‘all-or-nothing’effect[J].International Journal of Food Microbiology.2000,55:133-136.
[5]陈晓婵,赵伟,杨瑞金,等.高压脉冲电场处理草莓汁中损伤亚致死大肠杆菌与酿酒酵母的检测[J].食品工业科技,2013,34(16):79-83.
[6]Somolinos M ,Mañas P ,Condón S,et al.Recovery of Saccharomyces cerevisiae sublethally injured cells after Pulsed Electric Fields[J].International Journal of Food Microbiology.2008,125:352-356.
[7]Perni S,Chalise P R,Shama G ,et al.Bacterial cells exposed to nanosecond pulsed electric fields show lethal and sublethal effects[J].International Journal of Food Microbiology,2007,120:311-314.
[8]周刚.酵母对食品的污染[J].环境卫生学杂志,1979,6:325-329.
[9]Pironcheva G L.The effect of magnesium ions during beer fermentation[J].Cytobios,1998,94:135-139.
[10]McConkey D J,Orrenius S.Breakthroughs and views:The role of calcium in the regulation of apoptosis[J].Biochemical and Biophysical Research Communications,1997,239:357-366.
[11]顾艳洁,赵伟,杨瑞金,等.高压脉冲电场作用下亚致死酵母的存在与检测[J].食品发酵与工业,2012,38(7):90-93.
[12]冯玉娟.酿酒酵母生长代谢影响因素的测定[J].潍坊学院学报,2010,10(6):110-112.
[13]Akiko Yamada,Takenori Yamamoto,Yuya Yoshimura,et al.Ca2+-induced permeability transition can be observed even in yeast mitochondria under optimized experimental conditions[J].Biochimica et Biophysica Acta,2009,1787:1486-1491.

