宫颈癌微血管密度与CT灌注的关系
曹振东 赵宇阳 吉 洁 宋 雪 王淑贤 柳逢春 贾丽美 李晓陵
(承德医学院附属医院CT科,河北 承德 067000)
肿瘤的侵袭生长及转移依赖于新生血管〔1〕。目前评价肿瘤血管常用的方法是免疫组化,常用指标是微血管密度(MVD),此法的缺点是有创、离体、时间长。子宫颈血管较丰富,位于盆腔,受呼吸运动影响小。本文通过探讨灌注参数与MVD的相关性,试图找到一种更为简单快捷、在体无创的方法评价宫颈癌的新生血管,为临床诊治宫颈癌提供数据参考。
1 材料与方法
1.1 临床资料 选择2010年5月至2013年11月在承德医学院附属医院诊断为宫颈癌的患者,行多层螺旋CT(MSCT)灌注扫描。年龄31 ~62〔平均(43.28±11.91)〕岁,均行 MSCT 灌注扫描及手术治疗。术后病理显示:鳞癌19例,腺癌11例;临床分期:原位癌7例,Ⅰ期8例,Ⅱ期15例;组织学分级:中高分化8例,低分化22例;淋巴结转移阴性18例,淋巴结转移阳性12例。将癌旁正常宫颈组织(距肿瘤边缘>3 cm作为正常组织)10例作为对照。纳入标准:(1)宫颈癌患者临床分期≤Ⅱa,(2)CT灌注扫描前及术前未经任何形式的治疗,(3)造影剂碘过敏试验阴性且无其他使用造影剂的禁忌证,(4)病变处无伪影(呼吸、运动伪影、邻近骨质的线束硬化伪影等)。共有30例符合条件,纳入资料分析。
1.2 CT灌注
1.2.1 注意事项 (1)禁食4 h,扫描前1 h口服1%泛影葡胺500 ml充盈消化道并嘱患者充盈膀胱;(2)向患者讲述检查过程,缓解患者紧张情绪,取得良好配合。
1.2.2 检查设备及器材 GE light speed VCT 64排螺旋CT;adw4.5工作站;高压注射器;18 G穿刺针;非离子型造影剂碘帕醇注射液50 ml。
1.2.3 扫描条件 扫描范围为骼棘上方至耻骨联合下方,扫描序列:平扫(120 kV,400 mA,层厚为5 mm),在所得图像中选定8张肿瘤最大相关连续层面;灌注(120 kV,120 mA,层厚5 mm,扫描45次,每次获得8幅图像,计360幅,延迟时间5 s,单次曝光时间1 s,曝光间隔时间1 s)。
1.2.4 图像数据处理 灌注数据传至工作站,首先设定阈值,去除宫颈周围组织影像,骼外动脉选为流入动脉,将感兴趣区(ROI)选于基础像目标区域(宫颈癌组织或正常宫颈),可得到目标组织时间密度曲线(TDC)、灌注图及灌注参数,在选择肿瘤部位ROI时要尽量避开肿瘤坏死区、血管和肿瘤边缘部分,ROI面积要尽量大,以减少光子噪声及部分容积效应的影响。正常宫颈组织应选择灌注图像中无肿块的正常灌注区,要避免包括肿瘤边缘,面积亦要尽量大,必要时可多点采集取平均值。
1.3 免疫组化技术
1.3.1 取材 术后癌组织取材部位与CT灌注图像所选ROI部位一致,对照组选择距肿瘤边缘>3 cm的组织作为正常组织,标本经10%甲醛固定,常规石蜡包埋。
1.3.2 切片制备 对蜡块连续切片,厚度4 μm,第一张切片行苏木素-伊红(HE)染色,用于核实组织病理类型,其余用于免疫组化染色。
1.3.3 结果判定 由两位病理科医师阅片,分析病理类型及免疫组化染色结果:肿瘤微血管由CD34的阳性细胞数决定,以血管内皮细胞的胞质内出现棕黄色颗粒为阳性判定标准,采用Weidner等〔2〕建立的人工方法对MVD进行计数,其中,肿瘤硬化区、肿瘤交界处、有明显肌层者以及管腔直径大于8个红细胞直径的血管,均排除在外。
1.4 统计学处理 应用SPSS13.0软件进行分析,数值变量资料采用s表示,用方差分析、t检验和Person相关性分析;分类变量采用率表示,用χ2检验。
2 结果
2.1 各组血流量(BF)、血容量(BV)、表面通透性(PS)、平均通过时间(MTT)比较及与临床病理特征的关系 腺癌BF值高于鳞癌、有淋巴结转移组高于无淋巴结转移组、低分化组高于中高分化组,Ⅱ期宫颈癌高于Ⅰ期宫颈癌和原位癌(均P<0.05)。低分化组BV值高于中高分化组,有淋巴结转移组高于无淋巴结转移组(P<0.05)。有淋巴结转移组的PS值高于无淋巴结转移组(P<0.05)。MTT与病变组织的病理类型、组织学分级、临床分期以及有无淋巴结转移均无关(P>0.05)。见表 1,表 2。
2.2 Pearson相关分析 鳞癌组、不同组织学分级、临床分期、有无淋巴结转移患者 BF值均与MVD呈正相关(r=0.631,0.604,0.715;0.609,0.573,0.764,0.759;均 P<0.05)。
表1 BF、MTT、BV和PS比较(s)
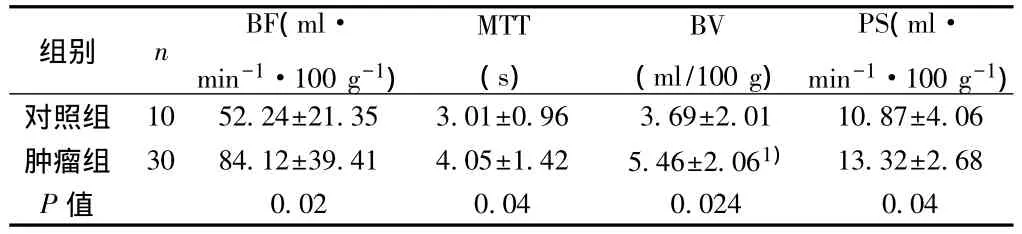
表1 BF、MTT、BV和PS比较(s)
组别 n BF(ml·min-1·100 g-1)MTT(s)BV(ml/100 g)PS(ml·min-1·100 g-1)对照组 10 52.24±21.35 3.01±0.96 3.69±2.01 10.87±4.06肿瘤组 30 84.12±39.41 4.05±1.42 5.46±2.061)13.32±2.68 P 值 0.02 0.04 0.024 0.04
表2 BF、MTT、BV、PS与临床病理特征的关系(s)
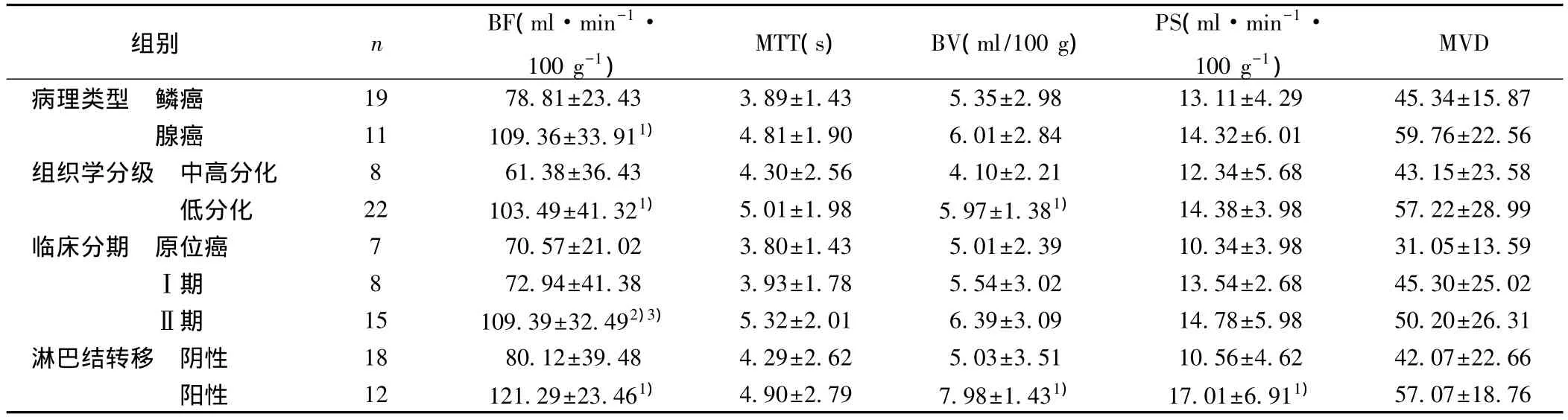
表2 BF、MTT、BV、PS与临床病理特征的关系(s)
不同亚组间比较:1)P<0.05
组别 n BF(ml·m 100 g-VD病理类型 鳞癌 19 78.81±23.43 3.89±1.43 5.35±2.98 13.11±4.29 45.34±15.87腺癌 11 109.36±33.911) 4.81±1.90 6.01±2.84 14.32±6.01 59.76±22.56组织学分级 中高分化 8 61.38±36.43 4.30±2.56 4.10±2.21 12.34±5.68 43.15±23.58低分化 22 103.49±41.321) 5.01±1.98 5.97±1.381) 14.38±3.98 57.22±28.99临床分期 原位癌 7 70.57±21.02 3.80±1.43 5.01±2.39 10.34±3.98 31.05±13.59Ⅰ期 8 72.94±41.38 3.93±1.78 5.54±3.02 13.54±2.68 45.30±25.02Ⅱ期 15 109.39±32.492)3) 5.32±2.01 6.39±3.09 14.78±5.98 50.20±26.31淋巴结转移 阴性 18 80.12±39.48 4.29±2.62 5.03±3.51 10.56±4.62 42.07±22.66阳性 12 121.29±23.461) 4.90±2.79 7.98±1.431) 17.01±6.911) 57.07±18.76
3 讨论
CT灌注成像使用的数学计算模型有两种:其一是非去卷积模型:由于此模型未考虑静脉流出,并且对注射速率要求很高,国外最高达20 ml/s。考虑到操作难度和危险性,本文未采用此模型;其二是去卷积模型:根据实际情况考虑了静脉流出问题,得到的灌注图及参数能较真实地反映组织器官内部血液动力学情况。此模型计算偏差小,注射速度要求不高(4~5 ml/s)〔3,4〕,缺点是采集数据的时间较长,易受呼吸运动影响。本研究的靶器官为宫颈,位于盆腔底部,几乎不受呼吸运动影响,扫描过程中患者无需屏气,匀速浅呼吸即可,这样就有效回避了此模型的缺点,既解决了技术难题又能得到较理想的结果。
MVD可较为直观地判断肿瘤血管的生成状态,是目前衡量肿瘤血管生成常用的客观定量指标。本研究显示,MVD水平反映了肿瘤细胞的侵袭能力以及恶性程度,这与血管形成促进肿瘤的增殖和转移的理论相吻合,随着肿瘤MVD的增加,肿瘤侵袭转移等恶性潜能也明显增加。赵玺龙等〔5〕研究表明,在宫颈腺癌中,多血管型比少血管型患者的生存期显著缩短,并有统计学意义。这说明MVD具有判断预后的作用,可以提示临床制定个体化方案,对MVD较高的患者应当更积极地给予治疗〔6〕,以减少不良事件的发生。倘若条件允许,还可以考虑辅助以抗血管生成药物。
肿瘤内微血管的来源主要有两种途径:其中绝大部分是肿瘤新生血管,其次是正常组织延伸的微血管以及残存在肿瘤内的原宿主血管,由于肿瘤生长对营养的高要求,仅靠原有血管难以保证,肿瘤组织势必将通过血管内皮生长因子诱导产生更多的微血管,这样就会导致肿瘤的血流量及血容量相应增加,肿瘤得到充足的养分供应,才能继续生长。因此通过检测瘤组织的BF及BV等灌注参数的变化,可以反映肿瘤血供情况及肿瘤微血管的生成情况〔7,8〕。CT灌注技术正是这样一种检查手段,通过灌注增强扫描获取目标组织的TDC曲线及BV、BF、MTT、PS等灌注参数及灌注图,对比剂在肿瘤中的分布受到血管的数量、PS、血管外间隙以及血流灌注量等因素的影响,对比剂首先分布于血管中,然后进入血管外间隙并逐渐达到平衡状态,肿瘤微血管是肿瘤增强的物质基础,对比剂在血管内及外间隙积聚是肿瘤增强的内在因素〔9〕,因此灌注参数可以反映肿瘤的血流灌注状态及肿瘤微血管的特点。
本研究结果显示:宫颈癌灌注参数仅在腺癌组两者缺乏相关性,可能与病例数目过少有关。分析结果,灌注参数值是由肿瘤内部的血流灌注情况决定的。灌注参数是MVD的外在表现形式,由此可见,CT灌注成像的本质是研究肿瘤内部的血流灌注特点,在毛细血管水平上非侵入性、定量检测肿瘤组织的灌注参数及微血管状况。
1 田 刚,许民辉,吕胜青,等.垂体腺瘤中血管生成及其与肿瘤侵袭性关系的研究〔J〕.中国现代医院杂志,2003;13(8):31-4.
2 Weidner N,Semple J P,Welch WR,et al.Tumor angiogenesis and metastasis correlation in invasive breast carcinoma〔J〕.N Eng1 J Med,1991;342(1):1-8.
3 Miyazaki M,Tsushima Y,Miydzaki A,et al.Quantification of hepatic arterial and portal perfusion with dynamic computed tomography:comparison of maximum-slope and dual-input one-compartment model methods〔J〕.Jpn J Radiol,2009;27(3):143-50.
4 Kei Shibuya,Yoshito Tsushima,Eri Horisoko,et al.Blood flow change quantification in cervical cancer before and during radiation therapy using perfusion CT〔J〕.J Radiat Res,2011;52(6):804-11.
5 赵玺龙,姚丽青,孙 睿,等.微血管密度在宫颈腺癌中的预后意义〔J〕.中国现代医学杂志,2005;15(16):2453-6.
6 楼宝阳,谢秀敏,余 玲,等.腹腔镜下改良筋膜内子宫切除术〔J〕.中国内镜杂志,2000;6(1):7-8.
7 Mayr NA,Wang JZ,Zhang D,et al.Longitudinal changes in tumor perfusion pattern during the radiation therapy course and its clinical impact in cervical cancer〔J〕.Int J Radiat Oncol Biol Phys,2009;77:502-8.
8 Yuh WT.Predicting control of primary tumor and survival by DCE MRI during early therapy in cervical cancer〔J〕.Invest Radiol,2009;44(6):343-50.
9 Tateishi U,Nishihara H,Watanabe S,et al.Tumor angiogenesis and dynamic CT in lung adenocarcinoma:radiologic-pathologic correlation〔J〕.J Comput Assist Tomogr,2001;25(1):23-7.

