紫杉醇脂质体与注射液在大鼠体内的血药浓度及相关药动学参数对比
王 杰 余 瑜 (重庆医科大学药学院,重庆 400016)
紫杉醇(PTX)是一种从红豆杉属植物中提取的具有独特抗癌作用的天然物质〔1〕,能够与细胞微管蛋白结合,在癌细胞分裂时诱导和促进其聚合,抑制其解聚,阻断细胞的有丝分裂,装配和稳定微管,从而限制癌细胞的生长。PTX抗肿瘤适应证较广,临床上主要用于治疗卵巢癌和乳腺癌〔2〕。目前临床上使用最多为PTX注射液,但因为PTX水溶性极差,所以目前国内外上市的PTX注射液都是以聚氧乙烯蓖麻油和无水乙醇作为溶媒〔3〕。然而这两者在体内降解时能够刺激机体释放组胺,从而易引起过敏反应〔4〕,另外由于缺乏靶向性〔5〕,PTX注射液对人体的毒副作用较大〔6〕,因而限制了它的应用。目前,以脂质体作为载体的PTX静脉给药系统成为了研究热点。20世纪90年代初,国内外对PTX脂质体的研究就取得了不错的研究成果〔7〕,该制剂能明显降低药物毒性,提高机体耐受性,而且与PTX注射液相比,具有相同抗肿瘤活性。本研究比较了PTX脂质体与PTX注射液在大鼠的血药浓度及药动学参数,考察两者在大鼠体内过程的差异。
1 资料与方法
1.1 材料与仪器 仪器:UV-2201型紫外-可见分光光度计,LC-3AT泵和SPD-10A(HPLC系统)紫外检测器,由日本岛津公司生产;Sage data system色谱工作站,Rheodyne 7725型液相色谱进样器(美国)。试剂与药品:注射用PTX脂质体(力朴素),南京绿叶思科药业有限公司生产;PTX注射液(紫素),北京协和药厂生产;PTX对照品(中国食品药品检定研究院);地西泮对照品(中国食品药品检定研究院)。甲醇、乙腈为色谱纯,其余试剂均为分析纯。动物:SD大鼠12只,体重(200±50)g,雌雄各半,由南京大学动物中心提供。
1.2 方法
1.2.1 色 谱 条 件 流 动 相:乙 腈-甲 醇-0.2 mol/L NaH2PO4(28 ∶20 ∶52,pH4.2);色谱柱:μBondapak C18 柱(4.0 mm×250 mm,10 m);流速:1.0 ml/min;检测波长:254 nm;内标物:地西泮;柱温:25℃。
1.2.2 血浆样品的预处理 精密吸取100 μl内标溶液(含地西泮20 mg/L)于8 ml具塞离心管中,氮气流下挥干,加入血浆样品1.0 ml后旋混30 s,再加入氯仿-甲醇(4 ∶1)4.0 ml,机械旋混振荡,离心10 min,吸取上层清液于5 ml尖底试管中,于水浴(45℃)通氮气流挥干溶剂。残渣物加入100 μl甲醇溶解混匀,离心,取上清液20~50 μl进样测定。
1.2.3 药动学实验 将12只SD健康大鼠随机分成PTX脂质体注射液组和 PTX注射液组,每组6只,按大鼠体重(12 mg/kg)计算给药量,经大鼠尾静脉缓慢推注药品,然后分别于 0.25、0.5、1.0、2.0、3.0、4.0、6.0、12.0、24.0、48.0、72.0 h股动脉取血,离心5 min分离血浆。按照1.2.2项处理测定后,作高效液相色谱法(HPLC)分析,将所得数值代入标准曲线求得血浆药物浓度。
1.3 统计学方法 采用SPSS17.0统计软件行t检验。
2 结果
2.1 HPLC法的验证
2.1.1 专属性实验 取空白血浆预处理后,在上述色谱条件下,用HPLC测定,PTX与内标地西泮的分离度符合要求,内标峰与样品峰血浆中内源性成分对测定无干扰。
2.1.2 标准曲线测定 以PTX注射液血药浓度(X)为横坐标,以PTX峰面积与内标峰面积之比(Y)为纵坐标,进行线性回归,得标准曲线:Y=0.089 5X+0.327 4(r=0.999 1,n=5)。
2.1.3 最低定量限(LCIQ)测定 配制系列低浓度血浆样品,高效液相色谱法测定,紫杉醇最低定量限为2 ng/ml。
2.1.4 回收率精密度试验 制备1.25、5、20 μg/ml PTX高、中、低浓度,带入当日标准曲线计算含量,计算回收率。三种浓度的回收率为96.6% ~104.8%,相对标准偏差(RSD)均<8.0%。日内、日间精密度 RSD均<6.0%(n=5)。
2.1.5 稳定性试验 在-20℃的温度下存放PTX对照品配制的血浆标准样品,定期进行取样处理和测定,考察血浆样品的稳定性,结果血浆样品在1个月内基本稳定。
2.2 大鼠药动学实验
2.2.1 血药浓度-时间曲线分析 PTX脂质体在血浆中的浓度是PTX注射液的200倍,见图1。
2.2.2 在血浆样品中的平均浓度比较 PTX及其脂质体在血浆样品中的平均浓度分别为(0.21±0.11)、(48.12±9.42)C·mg-1· L-1,差异具有统计学意义(t=12.457,P<0.001)。

图1 PTX注射液(A)和PTX脂质体(B)的药-时曲线图
2.2.3 相关药动学参数的比较 利用3p87药动学软件处理血药浓度-时间数据,得到药物动力学参数见表1。结果表明,药-时曲线下面积(AUC)PTX脂质体比PTX大,表观分布容积PTX脂质比PTX小,清除率PTX脂质比PTX慢。
表1 脂质体PTX和PTX注射液药动学参数比较(s)
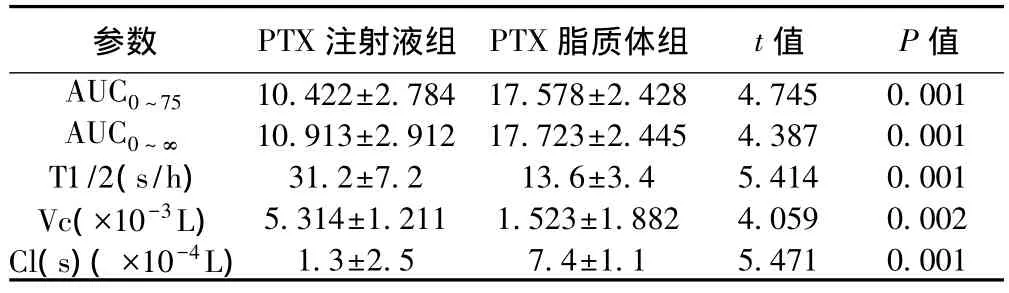
表1 脂质体PTX和PTX注射液药动学参数比较(s)
参数 PTX注射液组 PTX脂质体组 t值 P值AUC0~75 10.422±2.784 17.578±2.428 4.745 0.001 AUC0~∞ 10.913±2.912 17.723±2.445 4.387 0.001 T1/2(s/h)31.2±7.2 13.6±3.4 5.414 0.001 Vc(×10-3L)5.314±1.211 1.523±1.882 4.059 0.002 Cl(s)(×10-4L)1.3±2.5 7.4±1.1 5.471 0.001
3 讨论
PTX是目前临床应用最广泛及最有效的抗肿瘤物质之一,主要应用于乳腺癌、非小细胞癌、卵巢癌、前列腺癌等多种肿瘤的治疗〔8〕,但由于PTX不溶于水的性质,目前市场上的PTX注射液均采用聚氧乙烯蓖麻油和无水乙醇作为混合溶媒,然而其中的聚氧乙烯蓖麻油能刺激机体产生组胺,以引起严重过敏反应〔9,10〕。临床上在运用PTX注射液时普遍采用组胺受体拮抗剂和大剂量激素作为常规预处理,但对高血压、糖尿病及溃疡病的肿瘤患者不适用。以脂质体作为载体的PTX注射液不仅能降低药物的毒性,机体耐受性高,而且能保持与PTX注射液相同的抗肿瘤作用,因此PTX脂质体可能改变PTX传统的给药方式,提高肿瘤患者的治疗效果〔11〕。
PTX注射液一般采用先提取再测定的方法,提取溶剂有无水乙醚、叔丁基甲醚;流动相多采用甲醇、乙腈及水按不同比例组成,内标物质有炔诺酮或地西泮。
本研究按HPLC法〔12〕,以叔丁基甲醚为提取溶剂,以甲醇水为流动相,地西泮为内标物质,方法简单可靠。另外本实验中增加给药剂量,从而减少由于药物代谢使血药浓度减低造成的误差,增加了结果的可比性。
本研究结果表明,与PTX注射液相比,PTX脂质体在大鼠体内消除速度明显减慢,而AUC大大提高,提示PTX脂质体在一定程度上延长了PTX在体内循环的时间,能够在较长时间内保持体内血药浓度维持较高水平,从而达到抗肿瘤的长效作用;同时,PTX脂质体的Vc和Cl均显著降低,提示PTX脂质体中的药物能更好地集中于肿瘤靶组织,具有较少的毒副作用。
综上,PTX脂质体不仅使药物在体内的浓度延长,大大改善了PTX注射液的药动学性质,而且还具有靶向的作用。
1 郭仁宏,王金万.紫杉醇脂质体的研究进展〔J〕.中国肿瘤,2008;17(8):698-703.
2 鲁治文,钱章君.紫杉醇脂质体临床应用进展〔J〕.亚太传统医药,2012;8(12):229-32.
3 陈 凝,刘宝瑞.紫杉醇脂质体瘤体内给药对荷S180实体瘤小鼠的抑瘤作用〔J〕.中国肿瘤外科杂志,2012;4(1):40-4.
4 南家林.40例紫杉醇注射液过敏反应分析〔J〕.中国药物警戒,2009;6(6):346-50.
5 王 健,王秀问,王亚伟,等.奥曲肽紫杉醇偶联物靶向治疗小细胞肺癌的实验研究〔J〕.山东大学学报(医学版),2011;49(3):27-32.
6 杨 乐,张 健,张 璟,等.抑制NDRG2基因表达对宫颈癌Hela细胞紫杉醇化疗敏感性的影响〔J〕.现代生物医学进展,2013;13(17):3230-3.
7 赵晓晓,蔡 宇.紫杉醇脂质体的研究进展〔J〕.现代医院,2010;10(9):3-5.
8 Chakravarthi BV,Sujay R,Kuriakose GC,et al.Inhibition of cancer cell proliferation and apoptosis-inducing activity of fungal taxol and its precursor baccatin III purified from endophytic Fusarium solani〔J〕.Cancer Cell Int,2013;13(1):105.
9 Tekade RK,D'Emanuele A,Elhissi A,et al.Extraction and RP-HPLC determination of taxol in rat plasma,cell culture and quality control samples〔J〕.J Biomed Res,2013;27(5):394-405.
10 Amini-Fazl MS,Mobedi H,Barzin J.Investigation of aqueous stability of taxol in different release media〔J〕.Drug Dev Ind Pharm,2014;40(4):519-26.
11 耿 丽,陈小兵,陈清江,等.紫杉醇脂质体与紫杉醇新辅助化疗对乳腺癌的影响及机制〔J〕.山东医药,2011;51(33):89-90.
12 钱 隽,王漪璇,郁韵秋,等.注射用紫杉醇脂质体与紫杉醇注射液在肿瘤患者中的药动学比较〔J〕.肿瘤,2011;31(12):1103-7.

