水通道蛋白1和4在大鼠挫伤肺组织中的表达
孙相华 洪文娟 洪志鹏 周 菊 祝艳翠
(昆明医科大学第一附属医院干部医疗科,云南 昆明 650032)
肺挫伤是创伤病人中常出现的一种闭合性损伤,创伤导致的肺组织出血、水肿是急性呼吸窘迫综合征的主要危险因素,老年患者由于身体各项功能都出现衰退趋势,加上基础疾病较多,因此病情更加复杂、凶险,显著加大了救治难度〔1〕,早期采取有效措施减轻肺水肿对于改善患者预后具有重要意义〔2,3〕,研究肺挫伤水肿的机制,对于肺挫伤患者的临床治疗具有重要的指导意义。本研究检测水通道蛋白(AQP)1和4在挫伤肺组织中的表达变化,探讨肺水肿的形成机制。
1 材料和方法
1.1 肺挫伤模型制作及分组 健康老年雄性SD大鼠100只,体重450~500 g,由昆明医科大学实验动物中心提供。肺挫伤模型采用金属球自由落体打击法制作,老年大鼠麻醉后放置于水平实验台上,180 g重物自1 m高处自由落体,垂直撞击于大鼠右侧胸廓,于设定时间点麻醉后断头处死,分为四组:假手术组,模型1、3和6 h组,每组25只,其中10只做水含量测定,10只做分子生物学检测,5只做组织病理检测。
1.2 肺组织含水量的测定 大鼠麻醉后取肺组织,称量右肺中叶肺组织湿重,后置于100℃恒温鼓风干燥箱中干燥2 d后称重,计为干重。根据下列公式计算肺组织水含量:(湿重-干重)/湿重×100%。
1.3 肺组织HE染色 取大鼠右肺上叶组织,4%多聚甲醛固定后,切片,常规脱水、脱蜡,行HE染色。
1.4 RT-PCR 根据标准的RNA提取步骤提取总RNA,使用反转录试剂盒(Promega)进行反转录,具体操作根据说明书进行。利用琼脂糖凝胶电泳检测各组AQP1和4的表达,以β-actin作为内参照,Image J软件定量分析各电泳条带的灰度值,RT-PCR产物以各样本目的基因与β-actin的灰度值进行比较,AQP1 上游引物序列:5'-AAAGTGGCAAGGAAGGGACA-3';下游引物序列:5'-GCTGTGGATGTTGGGAAAGAG-3'。AQP4 的上游引物序列:5'-TTGGACCAATCATAGGCGC3';下游引物序列:5'-GGTCAATGTCGATCACATGC-3';β-actin 上游引物序列:5'-GAGAGGGAAATCGTGCGTGAC-3';下 游 引 物 序 列:5'-CATCTGCTGGAAGGTGGACA-3'。
1.5 Western印迹分析 老年大鼠100 mg肺组织加入裂解液匀浆,冰上碾磨匀浆后,12 000 r/min离心10 min取上清,BCA法蛋白定量,取蛋白样品50 μg,电泳后转膜,5%的脱脂奶粉封闭1 h,β-actin、AQP4和1抗体(均购自美国Santa cruz公司)稀释液孵育(1∶200),4℃过夜,TBST洗膜,5%的牛奶稀释的辣根过氧化物酶标记的兔抗羊二抗,洗膜后,按照ECL说明书,1∶1配置发光工作液,凝胶成像仪成像。
1.6 统计学分析 采用SPSS17.0软件进行单因素方差分析及LSD-t检验。
2 结果
2.1 肺组织湿/干重比和病理改变 模型1、3、6 h组湿/干比重(0.932 4±0.079 6、1.537 8±0.071 3、2.378 0±0.071 3)显著高于假手术组(0.799 1±0.069 3)(P<0.05)。模型 3、6 h 组与模型1 h组有显著差异(P<0.05)、挫伤后1 h组织肺泡腔内未出现明显水肿液,3 h后,光镜下见挫伤肺组织间质出现明显肿胀,肺泡壁毛细血管出现明显扩张、红细胞外漏、水肿明显,肺泡腔内出现少量水肿液;挫伤后6 h,黏稠液体充满肺泡腔,肺泡间隔出现明显水肿,有大量炎性细胞浸润,假手术组未出现明显异常。
2.2 各组肺组织AQP1和4的mRNA和蛋白表达量 与假手术组相比,模型3、6 h组肺组织内AQP1和4 mRNA和蛋白表达明显升高(P<0.05)。与模型1 h组比较,模型6 h组有显著差异(P<0.05)。见图1 和图2,表1。
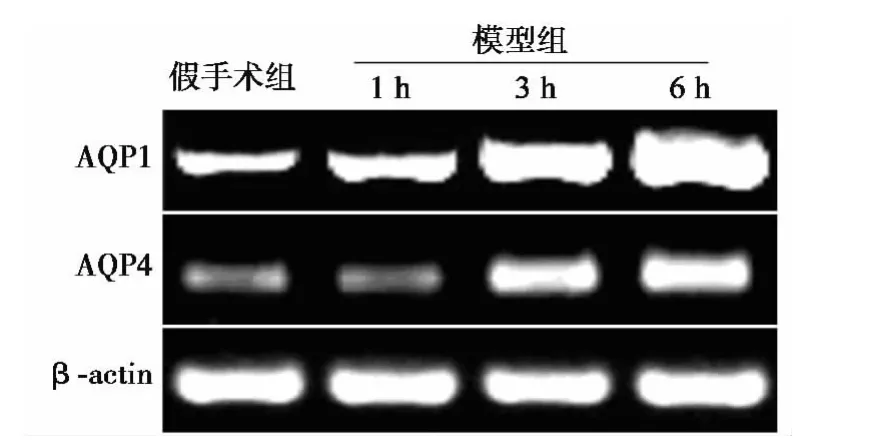
图1 各组肺组织中AQP1和4 mRNA的RT-PCR电泳
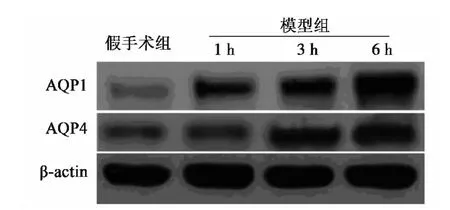
图2 各组肺组织中AQP1和4蛋白的Western印迹检测
表1 各组中AQP1和4灰度分析(s,n=10)
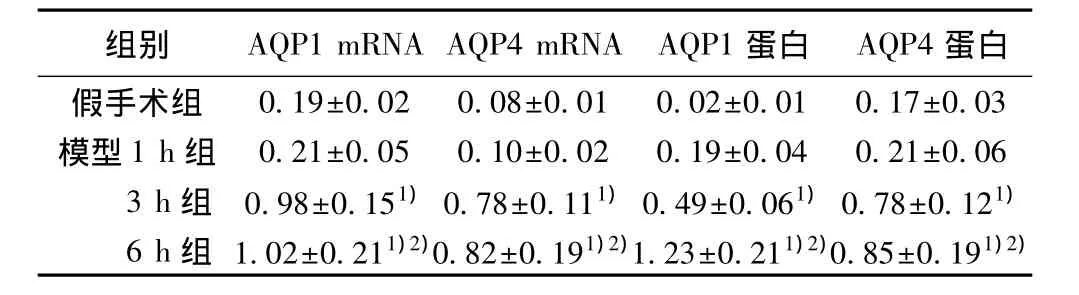
表1 各组中AQP1和4灰度分析(s,n=10)
与假手术组相比:1)P<0.05;与1 h 组相比:2)P<0.05
假手术组 0.19±0.02 0.08±0.01 0.02±0.01 0.17±0.03模型 1 h 组 0.21±0.05 0.10±0.02 0.19±0.04 0.21±0.06 3 h 组 0.98±0.151)0.78±0.111)0.49±0.061)0.78±0.121)6 h 组 1.02±0.211)2)0.82±0.191)2)1.23±0.211)2)0.85±0.191)2)
3 讨论
研究表明弥漫性肺泡损害、低氧血症、挫伤区肺组织的血水肿、通气与换气功能障碍时肺挫伤的主要病理生理机制〔4〕,其中肺水肿是导致肺通气功能障碍的主要原因,引起肺组织水肿的原因主要有两方面:一方面,创伤直接破坏血管内皮和肺泡上皮的屏障完整性,使通透性增加〔5〕;另一方面,肺挫伤后继发性产生的炎性介质,活性氧残基导致肺泡水的清除能力明显降低〔4〕。水代谢异常显著降低了肺组织的顺应性和氧合功能,是影响患者预后的重要因素。
研究证实AQP在肺挫伤后组织水肿形成中发挥重要作用,其中,AQP1在肺挫伤后组织中的表达量明显升高〔6〕,Verkman等〔7〕在敲除AQP1基因的研究发现,AQP1参与渗透压驱动的肺内水运动,能够促进肺水肿的形成;袁军等〔6〕在大鼠肺挫伤模型中研究发现AQP1的表达在肺挫伤后明显升高,可能是肺水肿的重要参与者。AQP4蛋白最初在1994年从大鼠的肺组织中克隆出来的一种选择性水转运体,属于汞不敏感性AQP家族〔8〕,采用电镜和免疫细胞化学技术检测发现AQP4定位于肺组织的气管、支气管上皮及成纤维细胞的膜基质侧顶部,此外AQP4也存在于气管、支气管的柱状上皮的基质侧,AQP4在肺泡水的转运及气道表面液体的调整中发挥重要作用。Verkman等〔7〕证实发现AQP1缺失可导致肺泡毛细血管间的水通透性下降10倍,AQP1和4均敲除小鼠水通透性降低14~16倍。研究采用血管外肺水(EVLW)技术发现,AQP4的主要作用是保持肺泡相对干燥,在正常状态下表达较少,血管外肺水量的增加可以显著诱导AQP4蛋白表达,以纠正“渗出-吸收”的失衡〔7,9〕。朱丽华等〔10〕在大鼠油酸性急性肺损伤模型中发现,AQP4在油酸导致损伤的肺组织中表达明显升高,这与本实验的研究结果具有一致性,同时还证明早期使用肾上腺能β2受体激动剂特布他林可以上调肺泡Ⅱ型细胞AQP4表达,明显减少肺泡腔渗出,减轻肺损伤,显著减少细胞外肺水的含量,提示AQP4在肺泡水肿中可以加强水转运发挥重要的抗水肿作用;推测肺挫伤后AQP4表达升高,是一种肺挫伤后的代偿性升高,可能利于减轻肺泡腔水肿。以往研究证实AQP1在肺挫伤后表达也明显升高,本研究结果与前期研究具有一致性〔11,12〕,AQP1 蛋白的表达增加则可以加重肺水肿,因此调节二者比值的平衡可能对于肺水肿早期的治疗具有重要意义,未来还需要进一步使用敲除AQP4或1基因及两者同时敲除的基因验证二者在肺挫伤中肺水肿的作用。
1 李景华.老年人严重肺挫伤的治疗体会〔J〕.现代诊断与治疗,2012;23(5):508-9.
2 罗玉龙,李超峰,苏鹏霄.严重肺挫伤150例诊治体会〔J〕.吉林医学,2009;30(19):2244-6.
3 Feden JP.Closed lung trauma〔J〕.Clin Sports Med,2013;32(2):255-65.
4 Simon B,Ebert J,Bokhari F,et al.Management of pulmonary contusion and flail chest:an Eastern Association for the Surgery of Trauma practice management guideline〔J〕.J Trauma Acute Care Surg,2012;73(5 Suppl 4):S351-61.
5 Gokce M,Saydam O,Hanci V,et al.Antioxidant vitamins C,E and coenzyme Q10 vs dexamethasone:comparisons of their effects in pulmonary contusion model〔J〕.J Cardiothorac Surg,2012;7:92.
6 袁 军,陈 阳,程利宝.大鼠挫伤肺组织中水通道蛋白1表达变化〔J〕.法医学杂志,2009;25(2):85-7.
7 Verkman AS.Role of aquaporins in lung liquid physiology〔J〕.Respir Physiol Neurobiol,2007;159(3):324-30.
8 Badaut J,Fukuda AM,Jullienne A,et al.Aquaporin and brain diseases〔J〕.Biochim Biophys Acta,2013;205(7):154-60.
9 Song Y,Fukuda N,Bai C,et al.Role of aquaporins in alveolar fluid clearance in neonatal and adult lung,and in oedema formation following acute lung injury:studies in transgenic aquaporin null mice〔J〕.J Physiol,2000;525(3):771-9.
10 朱丽华,李涛平,何 琳.大鼠油酸性急性肺损伤初期水通道蛋白4在肺水代谢的实验研究〔J〕.南方医科大学学报,2008;28(5):707-11.
11 王腾腾,王道喜.水通道蛋白1在大鼠挫伤肺损伤中的表达变化〔J〕.中国医学工程,2012;20(3):160-1.
12 Bai C,Fukuda N,Song Y,et al.Lung fluid transport in aquaporin-1 and aquaporin-4 knockout mice〔J〕.J Clin Invest,1999;103(4):555-61.

