重组白细胞介素12抑制哮喘小鼠肺部炎症的机制
王红阳 王 袁 王宏丽 郝小惠 刘和亮, (河北联合大学附属医院呼吸内科,河北 唐山 063000)
支气管哮喘是由多种细胞(如嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞和气道上皮细胞等)和细胞组分参与的气道慢性炎症性疾病。它是呼吸系统的常见病和多发病,但其发病机制至今尚不十分清楚〔1〕。现有的药物并不能彻底治疗哮喘,因此世界卫生组织把哮喘确定为终身治疗性疾病〔2〕。随着细胞生物学和分子生物学技术的不断进展,人们发现许多与气道炎症有关的细胞因子都参与了哮喘的病理生理过程,其中IL-12扮演了极为重要的角色,但它在哮喘免疫治疗过程中发挥作用的具体机制还不清楚。本研究旨在观察IL-12对哮喘小鼠体内肿瘤坏死因子(TNF)-α、白细胞介素(IL)-10、一氧化氮(NO)和IgE水平的影响,探讨其治疗哮喘的可能作用机制。
1 材料与方法
1.1 实验动物 SPF级6~8周龄的C57BL/6雄性小鼠45只,平均体重18~22 g,购自北京华阜康生物科技股份有限公司,动物生产许可证号:CSXK京2009-0004。
1.2 主要试剂与仪器 OVA(A5503,美国 Sigma公司),氢氧化铝(天津市大茂化学试剂厂),rmIL-12(210-12,美国PEROTECH EC公司),小鼠 TNF-α、IL-10、NO 和 IgE ELISA 试剂盒(美国R&B公司);402AI超声雾化器(江苏鱼跃医疗设备股份有限公司);自制透明雾化吸入箱(30 cm×20 cm×10 cm);酶标仪(瑞士帝肯公司);低温高速离心机(3K30,美国 Sigma公司);电热恒温培养箱(DNP-9052,上海精宏实验设备有限公司)。
1.3 实验动物的分组 正常饲养7 d,使小鼠适应环境后,采用随机数字表法将45只小鼠随机分成3组,即rmIL-12组20只,哮喘组20只,对照组5只。前两组又各自分为末次激发后1 d,2 d,4 d,8 d 四个亚组(每个亚组:n=5)。
1.4 小鼠模型的建立 参照文献〔3〕方法建立哮喘小鼠模型。哮喘组和 rmIL-12组小鼠分别于第 0、7和 14天腹腔注射0.2 ml OVA致敏液(含OVA 20 μg和氢氧化铝2 mg的PBS溶液)进行致敏,第21~27天将两组小鼠依次置于一自制透明的不完全密闭的有机玻璃盒内 (容积为30 cm×20 cm×10 cm),以1%OVA溶液20 ml(含0.2 g OVA的PBS溶液 )进行雾化激发,每天一次,每次30 min,连续7 d。rmIL-12组在哮喘组的基础上,每次激发前30 min,每只小鼠腹腔注射0.1 ml含0.14 μg rmIL-12的PBS溶液进行治疗。对照组用等量的PBS溶液进行致敏和激发。在实验过程中,密切观察各组小鼠的一般情况,包括进食,活动、呼吸、体重、精神状态以及抓挠颜面部等过敏行为的变化,并做相应的记录。
1.5 标本采集和处理 对照组小鼠在末次激发后2 d处死,哮喘组和 rmIL-12组小鼠在末次激发后1、2、4、8 d分四个时间段处死。所有小鼠通过弯镊摘取一侧眼球的方式进行采血,离心后的血浆-70℃储存待测NO和IgE水平。然后仰卧位固定小鼠,打开胸腔,结扎右肺下叶待做病理。剪开小鼠颈部皮肤,暴露颈前气管,在环状软骨上方做一横行切口,给两侧支气管肺泡同时进行灌洗。每次缓慢注入PBS 1 ml,重复操作3次,3次获得的BALF混匀后离心,收集其上清液,-70℃冰箱储存用于检测IL-10、TNF-α含量。细胞沉淀用于细胞总数和嗜酸性粒细胞(EOS)分类计数。最后剪下结扎的右肺下叶用于HE染色观察炎症反应情况。
1.6 统计学处理 采用SPSS13.0统计软件进行分析。首先对所得数据进行正态性和方差齐性检验,各组数据均符合正态分布,数据以s表示。组间比较采用单因素方差分析法(One-way ANOVA)。
2 结果
2.1 各组小鼠在激发过程中的一般情况 致敏阶段:各组小鼠在进食、活动、精神状态、呼吸、体重、大小便等方面均未见明显的异常和组间差别。激发阶段:对照组小鼠激发前后上述指标无明显异常。哮喘组小鼠激发后的精神状态较致敏阶段差,食欲下降,体重减轻。激发过程中,在雾化吸入OVA 5 min左右后呼吸便加深加快,甚至出现点头呼吸,频繁搔抓颜面皮毛,前肢缩抬,缩头弓背等哮喘急性发作表现,继而小鼠俯伏不动。与哮喘组相比,rmIL-12组小鼠上述哮喘症状明显减轻。
2.2 各组小鼠BALF中细胞总数和EOS百分比的动态变化哮喘组小鼠的细胞总数在第1天达高峰,EOS百分比在第2天达高峰。rmIL-12组小鼠的细胞总数和 EOS百分比在1、2和4 d随时间延长其水平逐渐降低,但至第8天时都略有回升。与相同时间段的哮喘组相比,rmIL-12组的细胞总数,EOS百分比明显降低,在末次激发后1、2和4 d差异均具有统计学意义(P<0.05)。见表1。
表1 各组小鼠BALF中细胞总数和EOS百分比的动态变化(s,n=5)
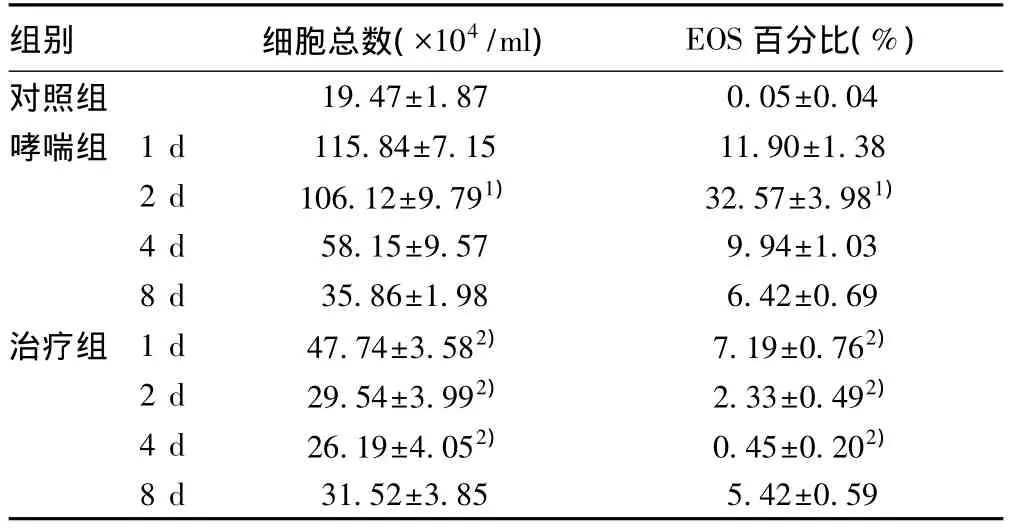
表1 各组小鼠BALF中细胞总数和EOS百分比的动态变化(s,n=5)
与对照组比较:1)P<0.05;与哮喘组比较:2)P<0.05,下表同
组别 细胞总数(×104/ml)EOS百分比(%)对照组 19.47±1.87 0.05±0.04哮喘组 1 d 115.84±7.15 11.90±1.38 2 d 106.12±9.791) 32.57±3.981)4 d 58.15±9.57 9.94±1.03 8 d 35.86±1.98 6.42±0.69治疗组 1 d 47.74±3.582) 7.19±0.762)2 d 29.54±3.992) 2.33±0.492)4 d 26.19±4.052) 0.45±0.202)8 d 31.52±3.85 5.42±0.59
2.3 各组小鼠TNF-α、IL-10、NO和 IgE水平的动态变化 哮喘组小鼠的TNF-α、NO、IgE在第2天达高峰,以后逐日下降,至第8 d时仍然高于对照组水平,IL-10随时间延长其水平逐渐降低,后者至第8天时略有回升,出现释放高峰的延迟。rmIL-12组与相同时段的哮喘组相比,TNF-α、NO、IgE水平明显降低,IL-10水平明显升高,TNF-α和NO在1、2,4 d和8 d差异均具有统计学意义(P<0.05),IL-10在1、4和8 d具有统计学意义(P< 0.05),IgE 在2 d和4 d具有统计学意义(P< 0.05)。见表2。
表2 各组小鼠BALF中TNF-α、IL-10及血浆NO、IgE水平动态变化(s,n=5)
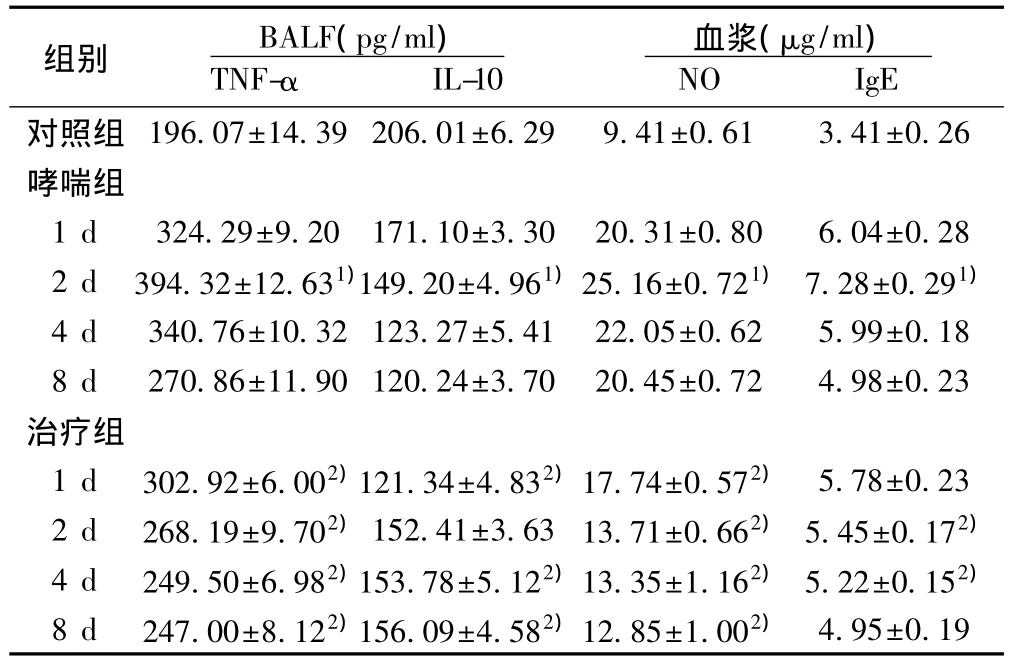
表2 各组小鼠BALF中TNF-α、IL-10及血浆NO、IgE水平动态变化(s,n=5)
组别 BALF(pg/ml)TNF-α IL-10血浆(μg/ml)NO IgE对照组 196.07±14.39 206.01±6.29 9.41±0.61 3.41±0.26哮喘组1 d 324.29±9.20 171.10±3.30 20.31±0.80 6.04±0.28 2 d 394.32±12.631)149.20±4.961)25.16±0.721)7.28±0.291)4 d 340.76±10.32 123.27±5.41 22.05±0.62 5.99±0.18 8 d 270.86±11.90 120.24±3.70 20.45±0.72 4.98±0.23治疗组1 d 302.92±6.002)121.34±4.832)17.74±0.572) 5.78±0.23 2 d 268.19±9.702)152.41±3.63 13.71±0.662)5.45±0.172)4 d 249.50±6.982)153.78±5.122)13.35±1.162)5.22±0.152)8 d 247.00±8.122)156.09±4.582)12.85±1.002) 4.95±0.19
2.4 肺组织病理改变 对照组小鼠的肺泡和中小细支气管结构正常:肺泡上皮细胞排列规整,支气管管腔和肺泡腔内无异物,管壁和平滑肌厚度正常。血管、气道周围未见明显的炎性细胞浸润。哮喘组小鼠的肺泡腔内充满渗出液,肺泡间隔变宽。支气管的管壁杯状细胞增生,管壁增厚,管腔缩小且不规则,可见黏液栓。支气管管壁、血管周围和肺间质内有大量炎性细胞浸润,主要是嗜酸性粒细胞、淋巴细胞和浆细胞等。rmIL-12组与哮喘组相比,小鼠的支气管黏膜上皮和肌层均完好,细支气管无明显痉挛、收缩,管腔较为规则。肺泡管和肺泡壁结构受损程度明显轻于哮喘组,支气管管腔及肺泡腔中黏液栓明显减少。肺组织及血管周围炎性细胞浸润程度明显减轻。见图1。

图1 小鼠肺组织病理结果(HE,×100)
3 讨论
哮喘是呼吸系统的常见病和多发病,其发病机制迄今仍未完全阐明。目前公认的是哮喘的反复发作是由于炎症介质、炎性细胞之间相互调控,相互制约的失常,从而导致炎症-上皮细胞损伤-气道重构的恶性循环〔4~6〕。因此,炎性介质的研究对阐明哮喘的发病机制具有极为重要的意义。IL-12是细胞免疫中一类重要的调节因子,它属于Th1型细胞因子,主要介导细胞免疫过程〔7,8〕。IL-12几乎完全由活化的抗原提呈细胞(包括树突状细胞,单核/巨噬细胞和B淋巴细胞)分泌〔9〕,它具有多种生物学功能在哮喘发病过程中具有保护作用:①在体外可以通过干扰素依赖机制和干扰素非依赖机制抑制B细胞合成IgE,从而调节Th1/Th2细胞介导的免疫应答平衡;②转变B细胞产生抗体的类型,降低 IgG1水平,提升 IgG2a,IgG2b,IgG3水平〔10〕;③抑制嗜酸性粒细胞向气道内浸润,抑制肥大细胞和嗜碱性粒细胞合成Th2型细胞因子,同时抑制其脱颗粒反应;④和局部产生的IFN-γ协同作用,共同降低过敏原导致的气道高反应性。IL-10是近年来发现的具有抗炎作用的细胞因子。它几乎能够抑制所有促炎因子的合成与释放,包括一些在哮喘发病过程中过度表达的细胞因子(如 TNF-α、IL-4、IL-5等)〔11〕。它还能通过抑制嗜酸粒细胞表达CD40从而发挥抗过敏效应。TNF-α是由单核巨噬细胞产生的一种具有广泛生物学活性的多肽类细胞因子。它可引起支气管的高反应性〔12〕。NO由一氧化氮合酶(NOS)催化左旋精氨酸(L-精氨酸)与氧分子而成。在某些病理条件下,NO的大量释放会产生细胞毒作用,损坏组织细胞,扩张支气管黏膜血管,增强毛细血管的渗出及炎症介质的释放〔13,14〕。除此之外,NO还能够促进嗜酸性粒细胞的趋化,并抑制其凋亡〔15〕,因而是哮喘的危险因素。IgE是由B细胞合成的一种可介导Ⅰ型变态反应的免疫球蛋白,血清总IgE水平的增高和气道内嗜酸性粒细胞浸润分别是支气管哮喘的主要免疫学特征和病理学特征。因此,由上可以得知IL-10、IL-12是哮喘发生时的保护因子,TNF-α,NO是哮喘的危险因子。
本研究结果显示,IL-12对哮喘小鼠气道炎症有良好的治疗作用。IL-12正是通过抑制炎症介质TNF-α、NO的释放同时促进抑炎因子IL-10的合成从而使炎症反应与抗炎反应重新回复平衡。同时各类研究也表明IL-12在治疗哮喘方面有相当不错的研究前景。国内学者用能产生活性IL-12的乳球菌滴鼻治疗哮喘小鼠,发现Th2型细胞因子的合成明显受到抑制,气道高反应性和肺内炎症明显减轻,局部细胞免疫功能低下的状态明显改善〔16〕。Li等〔17〕发现在卵白蛋白激发时肌内注射rm IL-12可减轻杯状细胞的增生,抑制黏液的分泌。
综上所述,白细胞总数、EOS百分比、TNF-α、IL-10、NO 和IgE水平综合的动态变化可作为反映支气管哮喘气道炎症的重要指标,以IL-12为靶点的治疗方案也为临床上哮喘的治疗带来了新希望,有望成为治疗哮喘的新途径。
1 Kaiko GE,Foster PS.New insights into the generation of Th2 immunity and potential therapeutic targets for the treatment of asthma〔J〕.Curr Opin Allergy Clin Immunol,2011;11(1):39-45.
2 Patil SU,Long AA.The usefulness of biomarkers of airway inflammation in managing asthma〔J〕.Allergy Asthma Proc,2010;31(4):259-68.
3 唐顺广,周瑞祥,贲素琴,等.急性支气管哮喘小鼠肺组织水通道蛋白1表达的变化及乙酰唑胺对水通道蛋白1表达的影响〔J〕.中华哮喘杂志(电子版),2009;3(5):326-37.
4 Baran CP,Opalek JM,McMaken S,et al.Important roles for macrophage colony-stimulating factor,CC chemokine ligand 2,and mononuclear phagocytes in the pathogenesis of pulmonary fibrosis〔J〕.Am J Respir Crit Care Med,2007;176(1):78-89.
5 McLachlan CR,Poulton R,Car G,et al.Adiposity,asthma,and airway inflammation〔J〕.J Allergy Clin Immunol,2007;119(3):634-9.
6 Sabroe I,Parker LC,Dockrell DH,et al.Targeting the networks that underpin contiguous Immunity in asthma and chronic obstructive pulmonary disease〔J〕.Am J Respir Crit Care Med,2007;175(4):306-11.
7 Pini M,Sennello JA,Cabay RJ,et al.Effect of diet-induced obesity on acute pancreatitis induced by administration of interleukin-12 plus interleukin-18 in mice〔J〕.Obesity(Silver Spring),2010;18(3):476-81.
8 Del Vecchio M,Bajetta E,Canova S,et al.Interleukin-12:biological properties and clinical application〔J〕.Clin Cancer Res,2007;13(16):4677-85.
9 Suzuki M,Matsumoto T,Ohta N,et al.Intranasal CpG DNA therapy during allergen exposure in allergic rhinitis〔J〕.Otolaryngol Head Neck Surg,2007;136(2):246-51.
10 Klinke DJ 2nd.A multiscale systems perspective on cancer,immunotherapy,and Interleukin-12〔J〕.Mol Cancer,2010;9:242.
11 Barnes PJ.The cytokine network in asthma and chronic obstructive in asthma and chronic obstructive pulmonary disease〔J〕.J Clin Invest,2008;118(11):3546-56.
12 Brightling C,Berry M,Amrani Y,et al.Targeting TNF-αlpha:a novel therapeutic approach for asthma〔J〕.J Allergy Clin Immunol,2008;121(1):5-10.
13 Pacher P,Beckman JS,Liaudet L,et al.Nitric oxide and peroxynitrite in health and disease〔J〕.Physiol Rev,2007;87(1):315-424.
14 Heffler E,Guida G,Marsicop P,et al.Exhaled nitric oxide as a diagnostic test for asthma in rhinitic patients with asthmatic symptoms〔J〕.Respir Med,2006;100(11):1981-7.
15 Lex C,Ferreira F,Zacharasiewicz A,et al.Airway eosinophilia in children with severe asthma:predictive values of noninvasive test〔J〕.Am J Respir Crit Care Med,2006;174(12):1286-91.
16 Wu C,Yang G,Bermúdez-Humarán LG,et al.Immunomodulatory effects of IL 12 secreted by Lactococcus lactis on Th1/Th2 balance in ovalbumin(OVA)induced asthma modelmice〔J〕.Int Immunopharmacol,2006;6(4):610-5.
17 Li H,Xie Q,Wang H,et al.Intramuscular delivery of mIL-12 gene reduces the expression of CD44/CD49d on pulmonary leucoytes and inhibits ovalbumin-induced airway hyperreactivity〔J〕.Inflamm Res,2008;57(1):11-7.

