大肠杆菌菌蜕装载质粒DNA实验方法的优化
胡岸 ,吴婷,陈翀,檀英霞,张士坤,冷泠,李素波,高红伟,季守平
1.中南大学 生物科学与技术学院,湖南 长沙 410012;2.军事医学科学院 野战输血研究所,北京 100850
核酸疫苗是一种新型疫苗,与传统疫苗相比,其具有成本低廉、易于构建和改造、导入抗原提呈细胞后可持续表达产生很强的免疫应答等显著优势,自1990 年被偶然发现以来发展迅速,成为当前分子生物学和免疫学中新的研究热点[1]。但核酸疫苗的免疫原性低下、诱发的免疫效果不佳,一直制约着其临床应用[2]。因此,核酸疫苗研究领域的一个关键问题是如何提高核酸疫苗的免疫原性及其诱发的免疫反应效果。研究者们使用各种方式以提高核酸疫苗对疾病的免疫保护能力,比如改变接种部位,使用脂多糖、分支杆菌等佐剂,结合电传转染技术等[3],但增效作用都有限。鉴于抗原提呈细胞在核酸疫苗免疫应答过程中发挥至关重要的作用,因而提高核酸疫苗活性的根本途径在于高效、特异地将核酸疫苗导入抗原提呈细胞,并使它得到高效表达[4]。这个过程中运载核酸的载体非常关键,制备合适的DNA 导入载体成了研究者试图提高核酸疫苗活性的重要策略。
近年来,菌蜕(bacterial ghosts,BG)被认为是极具潜力的核酸疫苗载体[4]。菌蜕是将细菌细胞壁裂解、去除细胞质内容物之后形成的细菌空壳。菌蜕保留了较为完整的细胞壁结构和免疫原性,因而其表面结构可以有效地与抗原提呈细胞相互作用,诱发强烈的免疫反应。同时,菌蜕可以装载核酸疫苗,将其导入抗原提呈细胞中。当装载核酸疫苗的菌蜕进入体内时,宿主的抗原提呈细胞就会主动识别菌蜕,从而提高菌蜕装载的核酸疫苗在抗原提呈细胞中的表达水平,进而增加抗原提呈及免疫应答水平。菌蜕的发现和运用,为研究核酸疫苗载体提供了一个全新的技术平台[5]。
在以往的研究中,我们初步建立了菌蜕的制备及装载核酸疫苗的方法,发现菌蜕确有靶向运载核酸疫苗的作用。但菌蜕装载DNA 的效率不稳定,且装载质粒DNA 后的菌蜕转染抗原提呈细胞的效率也有待提高[6]。在本实验中,我们以大肠杆菌DH5α制备菌蜕,在文献报道及前期工作基础上,优化菌蜕装载质粒DNA 的条件,以获得更高且更稳定的装载效果。鉴于破碎大肠杆菌后的细胞膜(即膜囊)能影响装载效率,其浓度过高或过低都会导致装载效率低下,我们摸索并优化了菌蜕、质粒和膜囊三者的最佳浓度比例。检测装载效率后,使用装载质粒DNA的菌蜕转染抗原提呈细胞RAW264.7(巨噬细胞系)和DC2.4(树突状细胞系),优化转染条件,进一步分析菌蜕作为DNA 疫苗载体装载质粒DNA 并将其导入抗原提呈细胞的能力。
1 材料与方法
1.1 材料
RAW264.7 巨噬细胞株和DC2.4 树突状细胞为本室保存;大肠杆菌DH5α购于全式金公司;pHH43质粒为德国Rainer Hass 教授惠赠;质粒pDSred-N1购于BD Clontech 公司;pVAXI-mIi-TM 为本室构建;胎牛血清、胰酶、DMEM 培养基和1640 培养基购于Gibco 公司;PI 购于Sigma 公司;HEPES 购于Amresco 公司;Mito Tracker 购于Invitrogen 公司;氯霉素、青霉素、链霉素购于华北制药有限公司;质粒大量抽提试剂盒购于威格拉斯公司;DNA marker DL2000购于TaKaRa公司。
1.2 菌蜕的制备
转化pHH43 质粒至感受态大肠杆菌DH5α中,在氯霉素抗性LB 固体培养基上于28℃培养过夜,挑出单克隆菌落转接至LB培养基中,恒温摇床过夜培养,随后以1∶100 扩大培养,待D600nm为0.5 时于42℃诱导,当D600nm值降到0.3 以下时离心收集菌体,加入50 mL 无菌水重悬,并加入200 U/μL 青霉素、链霉素各100μL,4℃静置过夜,取上清离心,沉淀悬浮,4℃静置过夜,小心取出上清,离心,弃除上清,用无菌水重悬沉淀,此时溶液均匀,无絮状不溶物,再次离心,收集的沉淀即为菌蜕,用无菌PBS重悬,混匀,测定菌蜕浓度。
1.3 膜囊的制备
以1∶1000 将大肠杆菌DH5α转入LB 培养基中培养,再以1∶100 将大肠杆菌转入LB 培养基培养过夜,离心收集菌体,弃上清,沉淀称重,用20 mmol/L Tris-HCl(pH8.0,含20%蔗糖)重悬(每克菌体加入4 mL),每克菌体加入600μg 溶菌酶,依次加入0.1 mol/L EDTA、0.5 mol/L MgCl2,离心收集菌体,沉淀重悬于冰冷的10 mmol/L Tris-HCl(pH8.0)中,超声波破碎,离心收集上清,40 000 r/min 离心1 h,沉淀重悬于2 mL 10 mmol/L Tris-HCl(pH8.0)中。
1.4 菌蜕装载质粒
参照威格拉斯大提质粒试剂盒说明书提取质粒pDSred-N1和pVAXI-mIi-TM,测定DNA 浓度。取质粒pDSred-N1和pVAXI-mIi 质粒各1 mg,加入400μL 冰冷的无水乙醇,充分混匀,室温静置10 min,12 000 r/min 离心10 min,弃上清,沉淀溶于50μL HBS 中,测定质粒DNA 的浓度;取菌蜕,6000 r/min 离心10 min,弃上清,用冰冷的CaCl2反复洗涤菌蜕(6000 r/min 离心10 min),弃上清,向菌蜕中加入10μL HBS,混匀;按菌蜕140μg/质粒200μg 的比例向菌蜕中加入质粒,加入HBS 定容至20μL,轻轻混匀,28℃水浴1 h;取出膜囊,按200μg 质粒/80μg 膜囊的比例加入,加入13μL 0.1 mol/L CaCl2,轻轻混匀后于37℃过夜。
取出-20℃冻存的Mito Tracker染料,融后混匀,取0.5μL 稀释至500μL PBS 中,混匀,取出37℃孵育的装载混合液,每管加入35μL 染料,37℃静置15 min,2000 r/min 离心10 min,加入PBS 定容至500μL,加入细胞核荧光染色剂PI 2μg/mL,混匀,用流式细胞术测定装载效率。
取制备的菌蜕和装载质粒pDSred-N1 的菌蜕,分别用扫描电镜(HITACHI S-4500)和透射电镜(Philps-EM 400T)观察菌蜕的外膜结构,以及菌蜕装载质粒前后的结构变化。
1.5 抗原提呈细胞吞噬菌蜕
37℃、5% CO2条件下培养巨噬细胞RAW264.7和树突状细胞DC2.4;取菌蜕装载的质粒pDSred-N1 1 mg(菌蜕用Mito Tracker 染色),与2 mL 无血清的Opti-MEM 培养基混匀,分别与RAW264.7细胞和DC2.4 细胞孵育过夜,用PBS 洗涤1 次,激光扫描共聚焦显微镜(Bio-Rad Radiance2100)观察抗原提呈细胞吞噬菌蜕的效果。按上述方法取1×106细胞,用流式细胞术测定抗原提呈细胞吞噬菌蜕的效率。
2 结果
2.1 菌蜕的制备
质粒pHH43 为温控型表达载体,可在42℃诱导表达φX174 噬菌体的裂解蛋白(E 蛋白),裂解革兰阴性菌。结果表明,在诱导过程中D600nm值明显下降并维持在0.3 以下,提示大肠杆菌得到了有效裂解。将裂解细菌洗涤、离心,获得菌蜕。将大肠杆菌在碱裂解液中超声波破碎,获得裂解的大肠杆菌。琼脂糖凝胶电泳结果显示,与大肠杆菌及其裂解液相比,菌蜕内DNA已随着细胞内容物被洗去(图1)。
2.2 菌蜕装载质粒的效率
本研究采用的装载方法是在本研究室前期工作基础上加以改进。分别用PI 将质粒pDSred-N1和pVAXI-mIi-TM 染色,菌蜕用Mito Tracker 标记;将不同比例的质粒DNA 与菌蜕混合孵育后,用膜囊将菌蜕封闭,以优化装载条件。流式细胞术检测结果(图2)表明,当质粒DNA、菌蜕、膜囊混合的比例为10∶7∶4 时装载效率达到最高,2 种质粒的装载效率都达到了98%以上,其中片段较长的质粒pVAXImIi-TM 的装载效率几乎为100%。以上结果说明菌蜕可以有效装载质粒DNA,且装载效率不会受DNA片段大小的影响。
2.3 扫描电镜和透射电镜观察菌蜕和装载质粒的菌蜕
为了检测大肠杆菌是否得到了有效裂解,以及菌蜕是否能够有效装载质粒DNA,我们将制备得到的菌蜕和装载质粒的菌蜕在扫描电镜和透射电镜下进行观察。扫描电镜结果显示(图3A),在菌蜕的两端出现孔状结构,提示大肠杆菌被成功地诱导裂解,在菌体两端形成了非常明显的裂解通道。透射电镜的结构显示,制备的菌蜕内部基本不着色,提示其DNA 等内容物基本洗涤干净(图3B);反之,装载质粒DNA 的菌蜕内部有有较多的高密度物质(黑色絮状物)(图3C),提示菌蜕装载质粒DNA的效率较高,可以作为很好的质粒DNA载体。
2.4 抗原提呈细胞吞噬菌蜕的效率
为了检测菌蜕是否能有效导入抗原提呈细胞,增强质粒DNA 的提呈效率,我们用激光共聚焦显微镜检测了装载质粒DNA 的菌蜕(Mito Tracker 标记)转染抗原提呈细胞RAW264.7和DC2.4,发现几乎所有RAW264.3 细胞内都可以观察到绿色荧光信号,提示Mito Tracker 标记的菌蜕被巨噬细胞吞噬到胞内(图4)。

图1 大肠杆菌和菌蜕的DNA电泳图
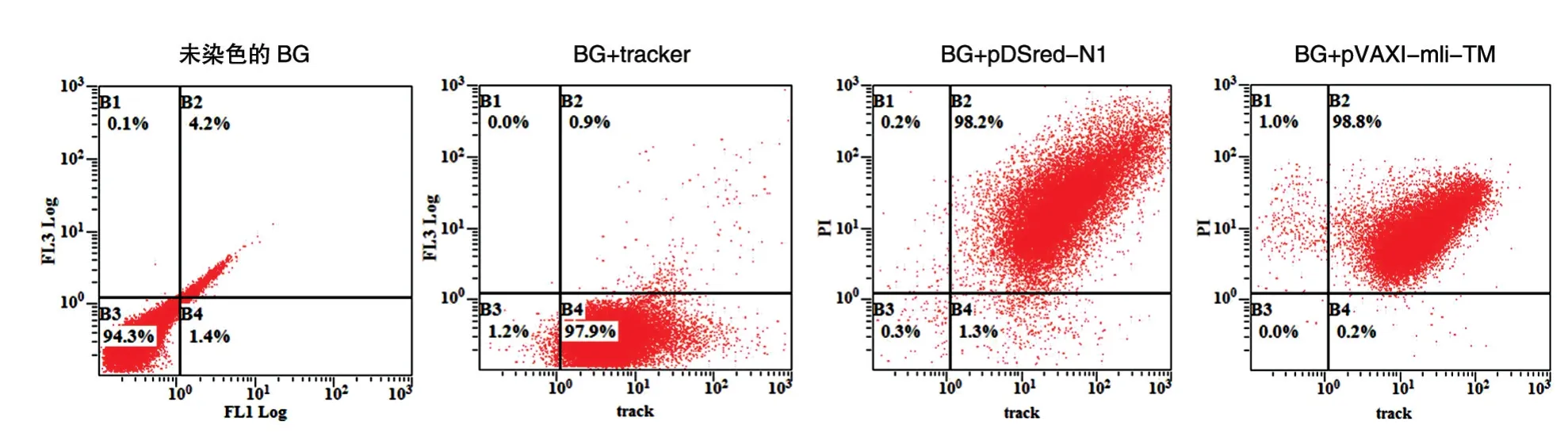
图2 流式细胞术测定菌蜕装载质粒的效率

图3 扫描电镜和透射电镜观察装载质粒DNA前后的菌蜕
进一步用流式细胞术定量分析转染效果,结果见图5,RAW264.7和DC2.4 细胞转染菌蜕后,Mito Tracker 的绿色荧光强度明显增强,将转染前后的峰图拟合,转染后的峰明显右移,且峰形较好,说明基本上所有细胞均有吞噬现象,效率几乎高达100%,从而显示出标记在菌蜕表面的绿色荧光。部分细胞内的荧光强度较弱,提示其吞噬菌蜕的量较少。流式细胞术结果表明,菌蜕能够高效导入抗原提呈细胞,这对增加DNA 疫苗在抗原提呈细胞中的表达水平是非常有益的。
3 讨论
φX174噬菌体的裂解基因E编码一个含91个氨基酸残基的膜蛋白,该蛋白能够融合革兰阴性菌的内外膜,并在菌膜上形成一个直径为40~200 nm 的特异性跨膜孔道。跨膜孔道的形成使得革兰阴性菌内外渗透压发生改变,细胞内容物由裂解孔道排出,生成菌蜕。采用这种方法已成功地制备了大肠杆菌、霍乱弧菌和幽门螺杆菌等的细菌菌蜕[7-8]。在菌蜕制备过程中,细菌表面的抗原结构没有受到任何化学和物理作用的损伤,保留了活菌样的完好形态结构,如脂多糖、肽聚糖和包膜特异性受体等免疫刺激成分,因而能够被巨噬细胞和树突状细胞等抗原提呈细胞主动摄取,具有免疫系统靶向性质[9]。故而装载核酸的菌蜕能够靶向性地将DNA 导入抗原提呈细胞,是良好的DNA 疫苗递送载体。菌蜕可经口服、皮下、肌肉注射等途径使用,可操作性极强[10]。此外,作为细菌空壳,菌蜕没有感染能力,具有安全性好,易于制备、保存等优点,有望成为安全有效的核酸疫苗递送载体,被广泛开发用于各个领域,如肿瘤疫苗的设计和发展、靶标药物和微酶反应等[11]。
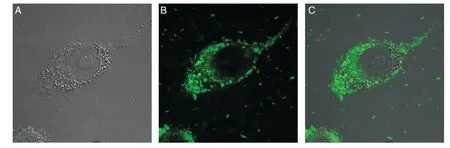
图4 激光扫描共聚焦显微镜观察标记菌蜕被巨噬细胞RAW264.3吞噬
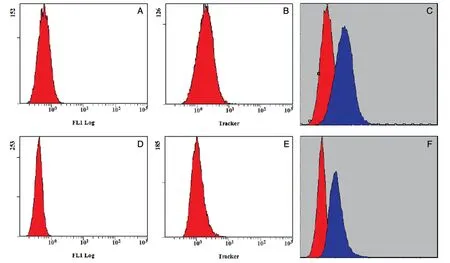
图5 流式细胞术检测抗原提呈细胞
高效地将质粒DNA 装载到菌蜕中,是菌蜕介导的核酸疫苗递送能否成功的关键步骤。Pauker等发现每个菌蜕可以装载6000 个质粒DNA,容量很大,且装载质粒的菌蜕能靶向到小鼠巨噬细胞,表达率为60%[12]。但我们参照他们的方法装载质粒DNA 却一直没有成功。究其原因,Pauker 等直接将DNA 与菌蜕混合,以包被质粒,但他们提供的实验方法中缺少将装载的DNA 封闭在菌蜕中的关键步骤,导致装载在菌蜕中的DNA 在洗涤过程中丢失。在前期研究中,我们用大肠杆菌菌蜕装载质粒DNA 之后,用大肠杆菌膜囊封闭菌蜕,成功地将质粒DNA 装载在菌蜕内[13],使用装载质粒DNA 的菌蜕转染巨噬细胞Raw264.7,报告基因的表达效率可超过50%。但前期研究的装载效率偏低,且不稳定,原因可能是只对菌蜕和质粒的浓度比例进行了探索,没有优化膜囊浓度。在本研究中,我们将大肠杆菌DH5α超声波破碎后,离心收集破碎的细胞膜成分,即膜囊。我们发现膜囊能影响菌蜕装载效率。膜囊浓度过低,装载质粒的菌蜕不能完全封闭;膜囊浓度过高,会影响菌蜕装载质粒效率。我们对菌蜕、质粒和膜囊三者的最佳浓度进行了摸索和优化,弥补了之前研究的空缺。结果表明,质粒、菌蜕、膜囊三者的浓度比为10∶7∶4 时可达到最高装载效率,效率稳定维持在98%以上,多数情况可高达100%。
为了测定菌蜕装载质粒DNA 的效率,我们按照之前的方法将DNA 用PI 染色,菌蜕包被质粒,随后菌蜕用Mito Tracker 标记,用流式细胞术检测装载。然而在检测过程中,我们发现PI 染色效果不好,同样装载方法的所获得产物的检测值波动较大。这可能是由于用PI 染色后,菌蜕包被过夜处理、Mito Tracker 标记菌蜕等步骤对荧光染料PI 产生了不利影响。于是我们尝试菌蜕包被质粒后,用Mito Tracker 标记菌蜕,再用PI 将质粒染色,用流式细胞术检测。这样改进后,PI 浓度仅为2μg/mL 即可成功染色,而且染色效果比改进前要好。PI 对质粒DNA 的染色效果非常稳定,同种装载条件所获得的检测结果也非常稳定。
最后,我们优化了菌蜕介导的转染程序,发现装载DNA 的菌蜕浓度对转染效率的影响很大。当菌蜕浓度为0.5 mg/mL 时,可获得良好的转染效率。激光共聚焦显微镜检测结果显示,几乎所有细胞内部均可看见绿色荧光,提示RAW264.7 及DC 等抗原提呈细胞能够高效吞噬菌蜕。流式细胞术检测结果显示2种细胞对菌蜕的吞噬效率均为100%。
综上所述,我们成功地制备了菌蜕,优化了菌蜕装载质粒DNA 的条件,建立了稳定的装载方法及装载效率的检测方法,提高了菌蜕装载DNA 的装载效率,使菌蜕装载几乎达到100%。在转染实验中,几乎在100%的抗原提呈细胞内均可检测到菌蜕,提示菌蜕确实是一种靶向有潜力的高效递送载体,能高效进入巨噬细胞并使携带的质粒DNA 获得高水平表达。今后我们将通过动物实验探讨菌蜕提高DNA 疫苗免疫应答水平的可能性。我们相信,随着对免疫科学进一步的探索,菌蜕高效运载核酸的潜力将进一步被挖掘,成为治疗疾病的强有力工具。
[1]Kudela P,Koller V J,Lubitz W,et al.Bacterial ghosts(BGs)—advanced antigen and drug delivery system[J].Vaccine,2010,28(36):5760-5767.
[2]Eko F O,Talin B A,Lubitz W,et al.Development of a Chlamydia trachomatis bacterial ghost vaccine to fight human blindness[J].Hum Vaccines,2008,4(3):176-183.
[3]Jechlinger W.Optimization and delivery of plasmid DNA for vaccination[J].Expert Rev Vaccines,2006,5(6):803-825.
[4]Reddy S T,Swartz M A,Hubbell J A.Targeting dendritic cells with biomaterials:developing the next generation of vaccines[J].Trends Immunol,27(12):573-579.
[5]Mayrhofer P,Tabrizi C A,Walcher P,et al.Immobilization of plasmid DNA in bacterial ghosts[J].J Control Release,2005,102(3):725-735.
[6]Muhammad A,Champeimont J,Mayr U B,et al.Bacterial ghosts as carriers of protein subunit and DNA-encoded antigens for vaccine applications[J].Expert Rev Vaccines,2012,11(1):97-116.
[7]Panthel K,Jechlinger W,Matis A,et al.Generation of Helicobacter pylori ghosts by PhiX protein E-mediated inactivation and their evaluation as vaccine candidates[J].Infect Immun,2003,71:109-116.
[8]Eko F O,Hensel A,Bunka S,et al.Immunogenicity of Vibrio cholerae ghosts following intra-peritoneal immunization of mice[J].Vaccine,1994,12:1330-1334.
[9]Felnerova D,Kudela P.T cell-specific response induced by bacterial ghosts[J].Med Sci Monit,2004,10:362-370.
[10]Mayr U B,Walcher P,Azimpour C,et al.Bacterial ghosts as antigen delivery vehicles[J].Adv Drug Deliv Rev,2005,57(9):1381-1391.
[11]Walcher P,Cui X,Arrow J A,et al.Bacterial ghosts as a delivery system for zona pellucida-2 fertility control vaccines for brushtail possums(Trichosurus vulpecula)[J].Vaccine,2008,26(52):6832-6838.
[12]Pauker S,Kudela P,Kobl G,et al.DNA-loaded bacterial ghosts efficiently mediate reporter gene transfer and expression in macrophages[J].Mol Thera,2005,11:215-223.
[13]靳小攀,檀英霞,李素波,等.大肠杆菌菌蜕作为核酸疫苗载体的实验方法研究[J].军事医学科学院院刊,2010,34:171-174.

