CHO 细胞表达的抗炭疽保护性抗原人源化抗体的纯化及质量控制分析
张金龙 ,李冰,2,任军,宋晓红,张章,侯利华,于长明,付玲,杨秀旭,李建民
1.军事医学科学院生物工程研究所 疫苗与抗体工程研究室,北京 100071;2.解放军306医院 检验科,北京 100000
炭疽是炭疽芽孢杆菌引起的人畜共患重大烈性传染病。炭疽芽孢由于其强烈的致病力和极强的对环境的适应能力,一直被作为重要的生物战剂及生物恐怖剂[1]。炭疽芽孢杆菌外毒素由保护性抗原(protective antigen,PA)、致死因子(lethal factor,LF)和水肿因子(edema factor,EF)3 种多肽组成[2-4]。针对PA 的单克隆抗体具有良好的保护性和安全性[5],且其半衰期长、性质稳定,是目前最有前景的炭疽毒素抑制剂[6-7]。我们利用自主构建的表达抗PA 的人源化抗体的重组CHO 细胞,尝试建立并优化大规模哺乳动物细胞发酵后纯化工艺,并对所获得的产品的纯度和活性进行检测,为抗炭疽人源化抗体的生产及质量控制打下基础。
1 材料和方法
1.1 材料
表达重组抗炭疽PA 人源化抗体的CHO 细胞株为本室构建保存[8-9];小鼠巨噬细胞系J774A.1 由本室保存;层析介质MabSelect Sure、SP-Sepharose Fast Flow、Sephadex G25,蛋白质纯化系统AKTA purifier 购自GE 公司;Waters 2487/2695 HPLC 系统购自Waters 公司;TSK G3000 SWXL(7.8 mm×300 mm)购自TOSOH 公司;0.45 μm 微孔滤器、30kD 超滤系统购自Millipore公司。
1.2 发酵液处理
重组CHO 细胞培养液共50 L,经12 000 r/min离心15 min,收集上清液,用0.45 μm 微孔滤膜过滤,采用截留分子量为30kD 的滤膜超滤浓缩,得到约20 L超滤浓缩液。
1.3 MabSelect Sure亲和层析
用5 倍柱体积的缓冲液A(20 mmol/L PB,0.15 mol/L NaCl,pH7.0)平衡亲和层析柱,将超滤浓缩后的细胞培养液以200 mL/min 的流速上样,上样完毕后用缓冲液A 平衡层析柱,检测波长280 nm,至基线后,用缓冲液B(0.1 mol/L 甘氨酸-HCl,0.15 mol/L NaCl,pH4.2)洗涤去除杂蛋白后,用缓冲液C(0.1 mol/L甘氨酸-HCl,0.15 mol/L NaCl,pH3.2)洗脱,收集洗脱液,静置3 h,灭活病毒后,用1 mol/L Tris(pH9.0)中和至pH5.6。
1.4 SP-Sepharose FF阳离子交换层析
用5 倍柱体积的缓冲液D(50 mmol/L NaAc,pH5.6)平衡SP-Sepharose FF 阳离子交换层析柱,中和后的亲和层析洗脱液稀释至1/4后上样,用缓冲液D 平衡层析柱,检测波长280 nm,至基线后,用缓冲液E(50 mmol/L NaAc,0.25 mol/L NaCl,pH5.6)洗脱,收集洗脱液,层析介质以1 mol/L NaOH 在位清洗,全过程流速50 mL/min。
1.5 Sephadex G25置换缓冲液
用5 倍体积的缓冲液A 平衡Sephadex G25 分子排阻层析柱,SP 阳离子洗脱蛋白质样品上样,收集目标峰,全过程完成后,层析介质以1 mol/L NaOH在位清洗,全过程流速50 mL/min。
1.6 蛋白质含量检测
发酵液上清中抗体蛋白质含量采用ELISA 法估算;其他纯化过程中蛋白质含量采用紫外法检测:采用岛津UV-1601 紫外分光光度计,先用相应空白缓冲液归零,然后将抗炭疽人源化抗体稀释至D280nm值为0.3~0.8,分别精确测定D280nm及D320nm值,每个样品测定3 次,取平均值,而后按照下式计算蛋白浓度(式中的抗炭疽人源化抗体的紫外光吸收系数为1.503):

1.7 SDS-PAGE法检测蛋白质相对分子质量
采用还原型SDS-PAGE。取20 μg 抗体,加入等体积2×上样缓冲液(含终浓度为1%的巯基乙醇),混匀后煮沸5 min。电泳结束后常规考马斯亮蓝染色,脱色后扫描分析结果。
1.8 SEC-HPLC检测纯度
采用Waters 2487/2695 高效液相色谱系统,分析柱为TSK G3000 SWXL 流动相为0.2 mol/L 磷酸盐加0.15 mol/L NaCl(pH6.8),流速0.8 mL/min,上样量50 μg,检测280 nm 波长处吸收峰,谱图结果用Empower 2软件分析。
1.9 Western印迹
取PA 及等量牛血清白蛋白(BSA,作为阴性对照)进行非还原型SDS-PAGE。用100 mA恒流电转3 h 将蛋白质转至PVDF 膜上,用3% BSA 室温封闭2 h,加入用封闭液按1∶10 000 稀释的抗炭疽人源化抗体,37℃孵育2 h,用TBST 洗膜3 次,加入用封闭液按1∶5000 稀释的HRP 标记的羊抗人Fc 二抗,37℃孵育1 h,用TBST洗膜3次,化学发光法显色。
1.10 体外细胞保护试验
J774A.1 细胞以2×105/mL 接种于96 孔细胞培养板,长至90%汇合后吸弃孔中培养液上清;将用培养液梯度稀释的抗体与100 ng/mL PA 和100 ng/mL LF 于37℃共孵育1 h 后加入细胞培养孔中,37℃孵育3 h,加入25 μL MTT(5 mg/mL),37℃孵育30 min,吸弃上清,每孔加入100 μL 盐酸异丙醇,振荡至沉淀溶解,测定各孔的D570nm值。以只加单纯新鲜培养基为全部存活对照孔,以未加抗体、只加PA 和LF 的培养液为全部死亡对照孔,D570nm值高于死亡对照孔0.1以上的细胞孔判为存活,此时的最大稀释度定义为TNA(毒素中和试验)效价。结果取2 个复孔的平均值。
1.11 其他检测
委托军事医学科学院仪器测试分析中心采用MOLDI-TOF 法测定抗体蛋白质的相对分子质量(Mr);蛋白A 残留检测采用试剂盒(Cygnus Technologies,F050)法;宿主蛋白质残留检测采用试剂盒(Cygnus Technologies,CM015)法;内毒素等的检测采用中国药典(2010版)方法。
2 结果
2.1 分离纯化及得率分析
MabSelect SuRe 亲和层析初步捕获抗体蛋白质(图1);SP-Sepharose FF 阳离子交换层析实现了杂质蛋白、抗体蛋白质多聚体及色素的分离(图2);Sephadex G25 分子筛层析实现了缓冲液的交换(图3)。各步得率见表1,总蛋白质得率为61.7%。
2.2 SEC-HPLC检测抗体纯度
SEC-HPLC 检测抗体纯度结果见图4,主峰保留时间8.608 min,百分比面积为99.25。故该法检测所得抗体纯度为99.25%。肩峰为二聚体,所占面积比例为0.75%。
2.3 蛋白质相对分子质量检测
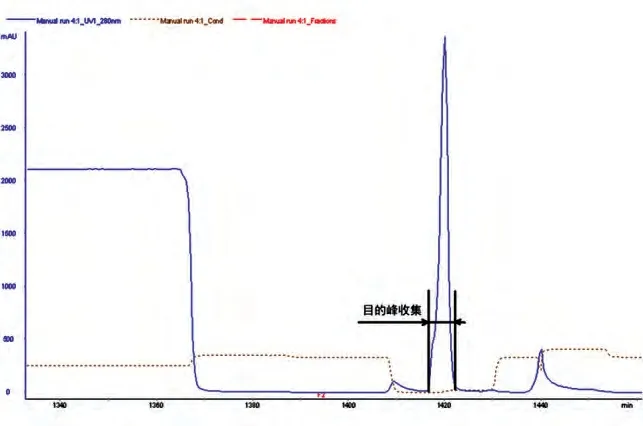
图1 MabSelect SuRe亲和层析色谱图
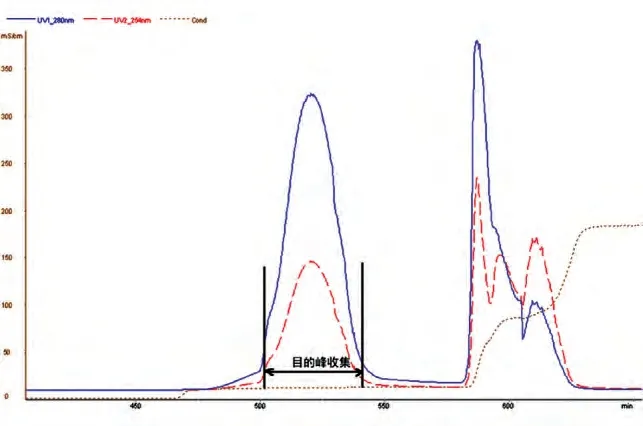
图2 SP-Sepharose FF离子交换层析色谱图
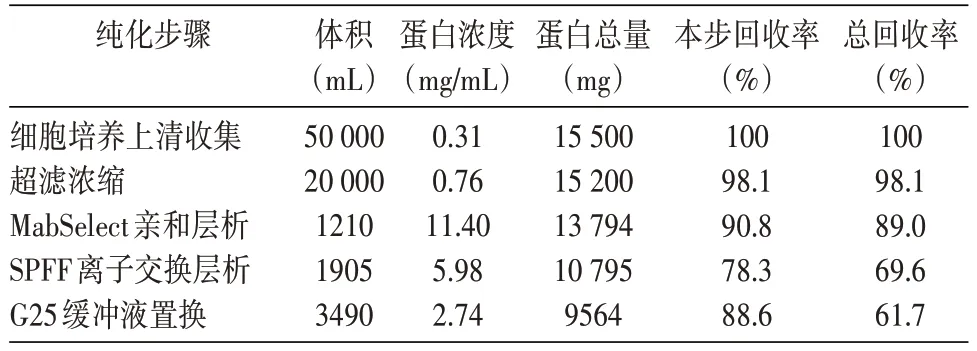
表1 目的蛋白质纯化各步效率及得率
抗体包括2条重链和2条轻链,其中成熟重链由452 个氨基酸残基组成,理论Mr为49 717;轻链由213 个氨基酸残基组成,理论Mr为23 219;还原SDS-PAGE 表明二者Mr均基本符合预期(图5)。MOLDI-TOF检测Mr为147 995,与预期相符(图6)。
2.4 Western印迹结果
Western 印迹结果见图7,可见抗体特异性地与PA发生结合。
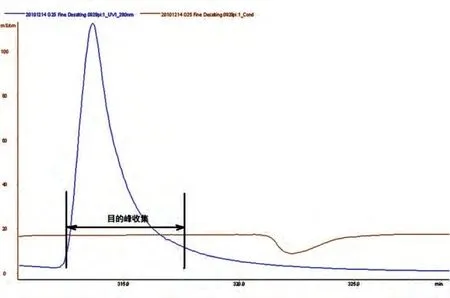
图3 Sephadex G25凝胶过滤层析色谱图
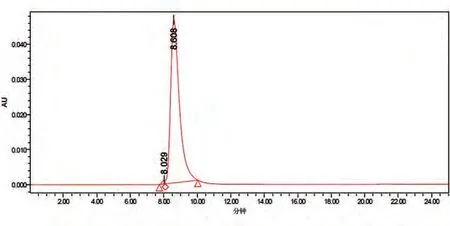
图4 SEC-HPLC法检测抗体纯度色谱图
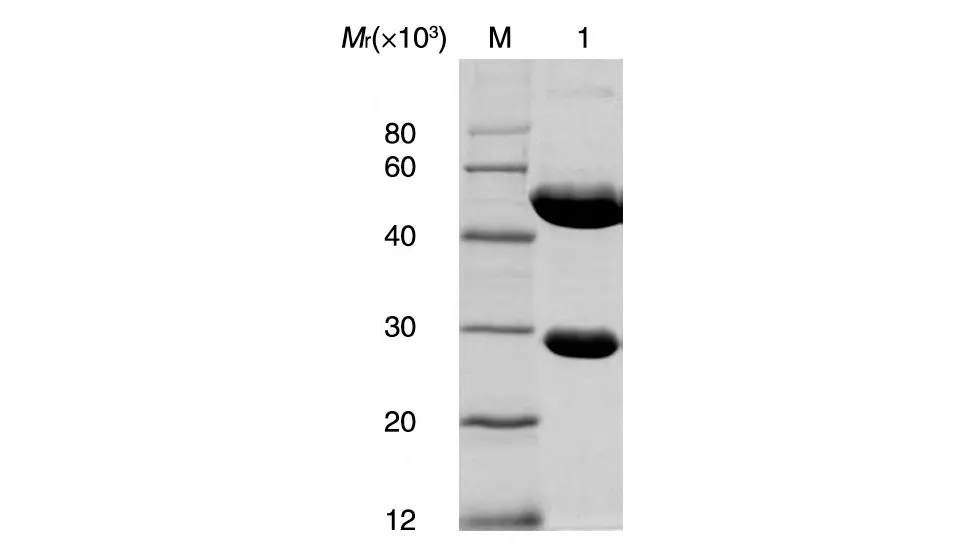
图5 SDS-PAGE法检测蛋白质相对分子质量
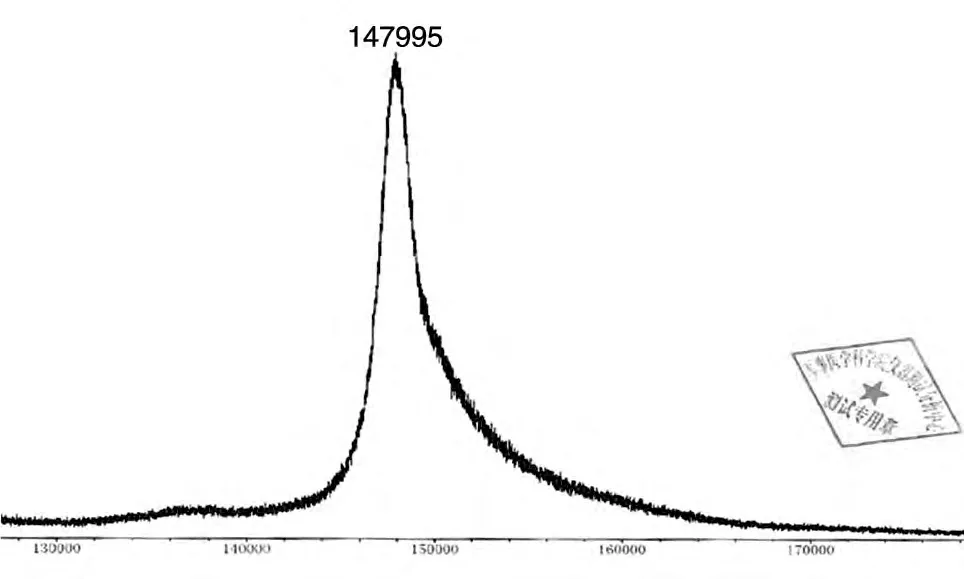
图6 MOLDI-TOF法检测蛋白质相对分子质量
2.5 体外细胞保护试验
细胞存活率与抗体加入浓度有明显的相关性,采用四参数法拟合曲线见图8,并计算出该抗体的EC50值为0.1516 μg/mL。
2.6 其他检测
经检测,蛋白A 含量为0.63 ng/mg 抗体,符合规定(≤0.01%);宿主蛋白残留量为0.62 ng/mg 抗体,符合规定(≤0.01%);内毒素含量等均符合中国药典规定。

图7 Western印迹鉴定PA的抗体结合特异性
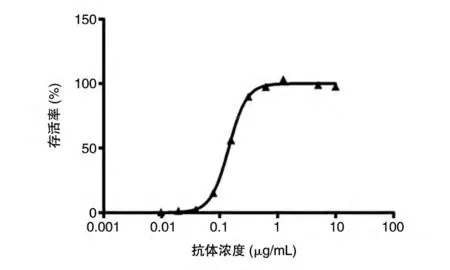
图8 PA细胞毒性中和作用实验
3 讨论
我们收集了激流式生物反应器所培养的CHO细胞发酵液上清,并采用Mabselect Sure 亲和层析、SP-Sepharose FF,通过精确控制纯化条件,实现了对抗炭疽人源化抗体的初步分离纯化。现在大多数厂家的分离纯化工艺是发酵后进行深层过滤获得澄清的上清,第一步进行亲和层析,层析后产物进行低pH 放置灭活病毒,经过滤后进行阴离子层析除去残余DNA 和内毒素,流穿液进行阳离子层析去除聚集体,洗脱产物进行纳滤去除病毒的工艺,再经过超滤和除菌过滤获得原液。相比之下,我们的现有工艺略显粗糙,还须进一步完善。例如,离心法澄清不适用于大规模生产,但可以通过简单地将离心操作转换为深层过滤或中空纤维柱微滤澄清,便可满足各种规模的生产需要。另外,还须进一步进行病毒的灭活/去除工艺研究。
单抗药物的质量要求是生物制品中比较高的,也是比较难进行质控的[10]。需要进行产品相关杂质(分子大小和电荷异构体)、工艺相关杂质(残余宿主蛋白、残余DNA 和泄漏的蛋白A 配基)、蛋白含量和生物活性、鉴别试验和安全性(内毒素和无菌)等研究[11]。现有质量研究数据基本确认表达了正确的具有生物学活性的完整单抗,质量控制则须进一步完善。需要建立Q-PCR 法检测残余DNA、离子高效液相色谱法考察电荷的异质性及HPLC 方法分析糖型等检测方法。
目前,炭疽的治疗主要依靠抗菌素[12],但在临床上往往由于服用不及时、自然产生的或因对炭疽菌的人为改构而产生的耐药性,使得抗菌素不能奏效,而抗PA 的人源化抗体在感染各期均可以对炭疽杆菌起的杀伤作用。美国政府非常重视炭疽的防控研究,早在2012年FDA 就批准人类基因组科学公司研制的Abthrax(raxi-bacumab)上市,用于炭疽的治疗。目前国内尚无同类用于急救的抗炭疽毒素药物。本研究基于本室前期研究结果,为抗炭疽人源化抗体的规模化生产及质控工作打下了基础。
[1]Schorle H.Anthrax.The growing danger[J].Pathologe,2002,23(3):167-169.
[2]Mourez M.Anthrax toxins[J].Rev Physiol Biochem Pharmacol,2004,152:135-164.
[3]Patocka J,Splino M.Anthrax toxin characterization[J].Acta Medica(Hradec Kralove),2002,45(1):3-5.
[4]Baillie L W,Huwar T B,Moore S,et al.An anthrax subunit vaccine candidate based on protective regions of Bacillus anthracis protective antigen and lethal factor[J].Vaccine,2010,28(41):6740-6748.
[5]Rudenko N V,Abbasova S G,Grishin E V.Preparation and characterization of monoclonal antibodies to Bacillus anthracis protective antigen[J].Bioorg Khim,2011,37(3):354-360.
[6]Chen Z,Moayeri M,Purcell R.Monoclonal antibody therapies against anthrax[J].Toxins(Basel),2011,3(8):1004-1019.
[7]Low D,O'leary R,Pujar N S.Future of antibody purification[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,848(1):48-63.
[8]李冰,李建民,张军,等.抗炭疽保护性抗原人-鼠嵌合抗体在CHO 细胞中的表达和活性研究[J].中华微生物学和免疫学杂志,2009,29(12):1069-1074.
[9]李冰,李建民,徐俊杰,等.抗炭疽保护性抗原单克隆抗体可变区基因的克隆及序列分析[J].生物技术通讯,2007,18(2):179-184.
[10]Liu H F,Ma J,Winter C,et al.Recovery and purification process development for monoclonal antibody production[J].MAbs,2010,2(5):480-499.
[11]Liu H F,Mccooey B,Duarte T,et al.Exploration of overloaded cation exchange chromatography for monoclonal antibody purification[J].J Chromatogr A,2011,1218(39):6943-6952.
[12]Weiss S,Kobiler D,Levy H,et al.Antibiotics cure anthrax in animal models [J].Antimicrob Agents Chemother,2011,55(4):1533-1542.

