人脐带间充质干细胞对百草枯中毒肺损伤小鼠模型的治疗作用
吕双红 ,王慧娜,杜丽欣,宋亚昆,吴东颖,刘兵,邱泽武
军事医学科学院 附属医院 a.肿瘤学研究室;b.307-青藤转化医学中心;c.中毒救治科;北京 100071
百草枯(paraquat,PQ)是一种广泛使用的高效除草剂,对人有较强的毒性作用。由于其中毒致死量小、无特效解毒剂、常规对症治疗效果极差,故死亡率居高不下。百草枯中毒的特征性改变是肺损伤,早期表现为肺泡上皮细胞受损,肺泡内出血水肿,晚期则表现为肺泡内和肺间质纤维化。
近年来,随着干细胞研究的进展,干细胞在临床难治性和顽固性疾病治疗方面的应用研究越来越多。间充质干细胞(mesenchymal stem cell,MSC)因取材方便、再生能力强、细胞增殖快、操作简单等优点而广受青睐。已有研究[1]显示,MSC可被募集到肺损伤部位,分化并修复肺泡上皮细胞,增加表面活性物质分泌,减轻炎症反应,具有治疗肺损伤的巨大潜力。在本研究中,我们探讨了脐带来源间充质干细胞(umbilical cord MSC,UCMSC)治疗百草枯中毒性肺损伤的可行性,旨在为百草枯中毒的临床治疗开拓新的途径。
1 材料与方法
1.1 UCMSC的分离、培养、鉴定
UCMSC 取自空军总医院健康剖腹产胎儿,经知情同意,无感染性疾病。将脐带样品冲洗干净,剪成2~3 mm3的小块,加入1%胶原酶消化液于37℃消化2 h,用70 μm 筛网过滤,收集上清,离心收集细胞;用PBS 清洗后,加入5 mL 培养液重悬细胞,37℃、5% CO2培养箱中培养,待80%~90%汇合时,按1∶2或1∶3 的比例传代。动物体内移植采用6~8 代细胞。采用流式细胞仪检测MSC表面标志的表达。
1.2 百草枯中毒性肺损伤模型的制备
健康成年雄性C57BL/6 小鼠(8 周龄,20~22 g)购自北京华阜康生物科技公司,在军事医学科学院实验动物中心饲养,于屏障环境内活动,室内恒温恒湿,人工照明12 h/d,自由进食、水。动物适应性饲养1 周后一次性腹腔注射百草枯溶液,注射液体量为0.2 mL/10 g。急性肺损伤动物模型于造模后7 d处死,肺纤维化模型于造模后21 d处死。
1.3 动物分组
105 只小鼠,根据百草枯给药剂量(40、50、60 mg/kg)及是否输注UCMSC 进行治疗分为6 组:40 mg/kg-PBS 组(n=30);40 mg/kg-UCMSC 组(n=29);50 mg/kg-PBS 组(n=13);50 mg/kg-UCMSC 组(n=13);60 mg/kg-PBS 组(n=10);60 mg/kg-UCMSC 组(n=10)。PBS 组于百草枯造模后24 h 尾静脉注射PBS;UCMSC 组于造模后24 h 尾静脉输注UCMSC。其中40 mg/kg-PBS 组和40 mg/kg-UCMSC 组各取14 只于21 d 处死,观察UCMSC 对百草枯诱导肺纤维化的治疗作用;其余动物于7 d处死,观察UCMSC对急性肺损伤的治疗作用。记录死亡率和体重变化,并取肺组织进行病理包埋和切片,病理评分。
1.4 肺组织病理切片染色及评分
肺组织切片经常规HE染色,按急性肺损伤或肺纤维化评分标准进行评分。急性肺损伤评分标准参照文献[2],病理评分范围为0~16 分。肺纤维化评分标准采用Ashcroft 的方法[3]。若每一视野内正常组织结构占主导(>50%),则予评0 分;若每一显微视野内肺纤维化病变占主导(>50%),则其具体分级标准如表1。若评分级别在2个奇数得分之间时,则取其中间值。
1.5 PCR检测UCMSC植入
8 只40 mg/kg 百草枯染毒动物,分别于UCMSC移植后3 h、24 h、7 d 取肺组织,提取基因组DNA,RT-PCR 检测人特异性线粒体基因chrome B mitochondria(CBM)的表达情况。所用引物为Forward(5'CATGGTGAAACCCCGTCTCTA3')和Reverse(5'GCCTCAGCCTCCCGAGTAG3')。扩增条件:94℃5 min,94℃ 30 s,58℃ 30 s,72℃ 1 min,72℃ 5 min,30个循环。
1.6 统计学分析
2 结果
2.1 UCMSC 移植对百草枯中毒性急性肺损伤的治疗作用
动物给予不同剂量百草枯腹腔注射造模,24 h后尾静脉输注UCMSC 治疗。结果显示,UCMSC 治疗可提高较低剂量(40、50 mg/kg)百草枯中毒动物的生存率,剂量过高(60 mg/kg)时UCMSC 对动物的生存率并没有改善,表明过高的百草枯引起的肺损伤过程可能已处于不可逆的状态。但肺组织病理评分没有统计学差异,这可能是由于病理的改变需要一定的时间。
2.2 UCMSC 对百草枯中毒诱导的肺纤维化的治疗作用
腹腔注射40 mg/kg 百草枯溶液后小鼠体重明显下降,到第5 d 下降到最低值,随后缓慢恢复,但UCMSC 尾静脉注射治疗组动物的体重恢复较早较快。生存率曲线显示,UCMSC 治疗后动物的生存率提高(图2)。

表1 肺组织纤维化分级标准
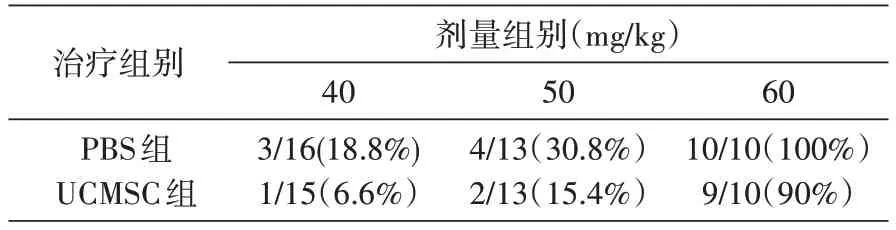
表2 UCMSC对急性百草枯中毒小鼠死亡率的影响
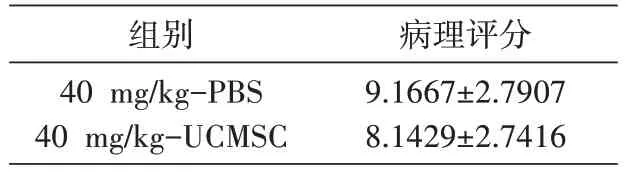
表3 小鼠急性肺损伤病理评分
百草枯染毒后21 d 肺组织有充血及出血,肺泡壁增厚,部分闭塞,血管及支气管周围可见纤维细胞增殖及胶原沉积,严重时可观察到肺结构明显破坏,纤维块或纤维束形成。UCMSC 治疗组肺组织纤维化程度减轻(图3),Ashcroft 病理评分显著降低(表4)。这些结果表明,UCMSC 治疗百草枯中毒诱导的纤维化可取得一定的疗效。
2.3 PCR检测UCMSC植入结果
RT-PCR 结果显示,在UCMSC 移植后3 h 的肺组织中有人特异性CBM基因表达,但24 h后未检测到,表明移植细胞在肺内可能无植入。
3 讨论
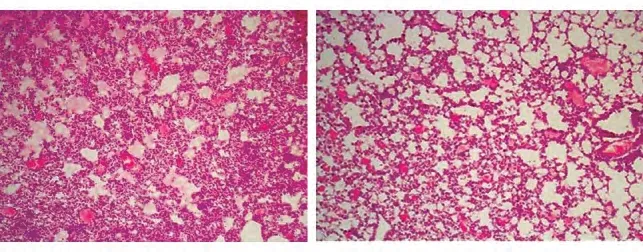
图1 小鼠急性百草枯中毒性肺损伤HE染色
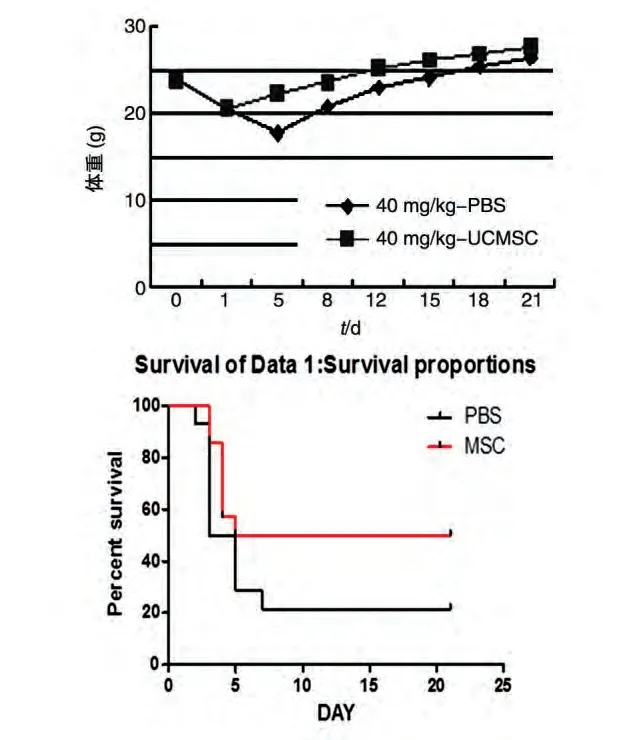
图2 UCMSC对小鼠百草枯中毒性肺纤维化的治疗作用

表4 UCMSC治疗百草枯诱导肺纤维化小鼠的死亡率及病理评分
百草枯是一种有较强毒性的除草剂,由于肺部细胞对其有主动摄取和蓄积作用,使得肺受损最为严重,临床尚无特效解毒药物,因此患者病死率极高。血液灌流是当前治疗百草枯中毒的有效方法,但其对百草枯所造成的肺损伤临床疗效极为有限。
MSC 最初在骨髓中被发现,因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点,日益受到人们的关注。研究证实[1],UCMSC 移植后能够植入损伤肺部,进一步分化为肺上皮细胞,并通过减少促炎症细胞因子、升高抗炎症细胞因子、减轻肺水肿等途径,对肺损伤起到一定的治疗作用。研究表明[4],与MSC 共培养可减少肺Ⅱ型上皮细胞对百草枯的蓄积量,上调抗氧化基因的表达,有利于上皮细胞的存活。将骨髓MSC 植入百草枯染毒大鼠后,减轻了模型动物的肺损伤[5-7]。但骨髓源MSC 受患者年龄、体质等因素的限制,且具有创伤性;而UCMSC 来源广泛,便于取材,对供者无不利影响,无伦理道德问题的限制,且细胞增殖、分化能力较强,适合体外大规模培养,因此,已成为骨髓MSC 的理想替代来源。但UCMSC 用于百草枯中毒性肺损伤的研究仅有个别报道。
已有动物实验研究[8]表明UCMSC 对脂多糖(LPS)引起的急性肺损伤具有治疗作用。国内也有临床应用UCMSC 治疗百草枯中毒病例的报道[9],发现治疗后病人死亡率降低。但目前尚无UCMSC 治疗百草枯肺损伤的动物实验研究,也没有证据表明UCMSC 治疗百草枯肺损伤有明确疗效。在本研究中我们发现,采用UCMCS 治疗百草枯中毒性急性肺损伤,在较低剂量百草枯中毒模型中可提高动物的生存率,但百草枯剂量过高时UCMSC 对动物生存率并没有改善,表明过高的百草枯引起的肺损伤过程已处于不可逆状态。低剂量百草枯中毒模型中UCMSC 虽能改善生存率,肺组织病理评分仍没有统计学差异,这可能是由于病理的改变需要一定的时间。有鉴于此,临床应用UCMSC 治疗急性百草枯中毒时,需要选择合适的病例。
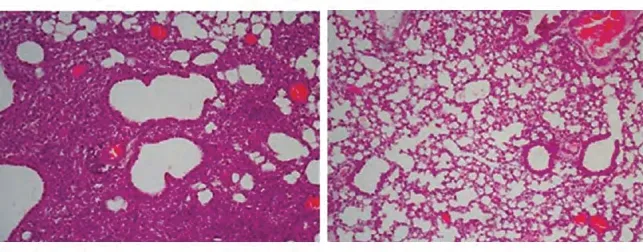
图3 UCMSC治疗小鼠百草枯中毒性肺纤维化HE染色

图4 人特异性CBM基因的RT-PCR检测结果
Yamashita[10]对存活的百草枯中毒患者进行随访发现,即使是轻微的肺损伤,仍可引起患者在较长时间内的限制性肺功能损伤,最终导致不可逆的肺间质纤维化,而一旦出现肺间质纤维化,病人预后极差,目前尚无确切有效的救治手段。Moodley 等[11]的研究表明,UCMSC 可减轻博莱霉素诱导的肺纤维化。另有研究[12]表明,骨髓MSC 可减轻百草枯中毒大鼠肺纤维化的程度。本研究证实,UCMSC 对百草枯诱导的肺纤维化有较好的治疗作用,动物体重恢复较早,存活率提高,肺纤维化评分显著降低。这一结果为未来使用UCMSC 治疗临床百草枯中毒病人的肺纤维化提供了理论依据。
目前认为,MSC 发挥治疗作用的主要机理是其旁分泌作用[13]。因为在很多移植研究中都发现,即使MSC 治疗有效,在移植部位也只能检测到很少或甚至不能检测到移植细胞。越来越多的研究表明,各种来源的MSC 均可分泌多种生物活性因子,以旁分泌的方式对靶细胞发挥抗疤痕形成、抗炎、抗凋亡等作用。本研究中,我们在移植后3 h 的肺组织中可检测到人特异性基因,但24 h 后未检测到,这表明UCMSC起作用的方式可能也是通过旁分泌途径。
[1]Rojas M,Xu J,Woods C R,et al.Bone marrow-derived mesenchymal stem cells in repair of the injured lung[J].Am J Respir Cell Mol Biol,2005,33:145-152.
[2]Takao Y,Mikawa K,Nishina K,et al.Attenuation of acute lung injury with propofol in endotoxemia[J].Anesth Analg,2005,100(3):810-816.
[3]Ashcroft T,Simpson J M,Timbrell V.Simple method of estimation severity of pulmonary fibrosis on a numerical scale[J].J Clin Pathol,1988,41(4):467-470.
[4]Tsai H L,Chang J W,Yang H W,et al.Amelioration of paraquat-induced pulmonary injury by mesenchymal stem cells[J].Cell Transplant,2013,22(9):1667-1681.
[5]Yang H,Wen Y,Yu H Y,et al.Combined treatment with bone marrow mesenchymal stem cells and methylprednisolone in paraquat-induced acute lung injury[J].BMC Emerg Med,2013,13(Suppl 1):S5.
[6]Yang H,Wen Y,Bin J,et al.Protection of bone marrow mesenchymal stem cells from acute lung injury induced by paraquat poisoning[J].Clin Toxicol,2011,49(4):298-302.
[7]张燕敏,邱泽武.骨髓间充质干细胞治疗大鼠百草枯中毒急性肺损伤的作用研究[J].中华急诊医学杂志,2011,20(1):39-43.
[8]Li J,Li D,Liu X,et al.Human umbilical cord mesenchymal stem cells reduce systemic inflammation and attenuate LPS-induced acute lung injury in rats[J].J Inflamm,2012,9(1):33.
[9]刘薇薇,余卫,陈嘉榆.脐带间充质干细胞治疗急性百草枯中毒致肺损伤临床观察[J].中华劳动卫生职业病杂志,2012,30(11):811-815.
[10]Yamashita M,Yamashita M,Ando Y.A long-term follow-up of lung function in survivors of paraquat poisoning[J].Hum Exp Toxicol,2000,19(2):99-103.
[11]Moodley Y,Atienza D,Manuelpillai U,et al.Human umbilical cord mesenchymal stem cells reduce fibrosis of bleomycininduced lung injury[J].Am J Pathol,2009,175(1):302-313.
[12]徐佳波,李燕芹,李莉,等.不同剂量BMSC 尾静脉输注对小鼠肺组织纤维化的影响[J].上海交通大学学报,2009,29(10):1157-1162.
[13]Meirelles L da S,Fontes A M,Covas D T,et al.Mechanisms involved in the therapeutic properties of mesenchymal stem cells[J].Cytokine Growth Factor Rev,2009,20:419-427.

